
Гречаниченко Екатерина, Менеджер по медицинским исследованиям, Натива
Стратегический вектор развития индустрии здравоохранения, основанный на этических принципах современного общества: лекарственные средства должны быть не только эффективными и безопасными, но и доступными для потребителей.
Риск-ориентированный подход в клинических исследованиях, описанный в новой редакции GCP R2 отражает этот тренд как нельзя лучше – меньше ресурсов при сохранении, а зачастую и улучшении качества проведения клинических исследований.
Аббревиатура RBM знакома нам всем. На эту тему в последние десять лет выпущено много статей и материалов, проведены бесчисленные конференции и обсуждения.
Многие знают, немногие делают. Почему? Безусловно, любые перемены - это испытание и труд. В этой статье мы делимся с вами своим опытом внедрения RBM.
Вызовы
При планировании и проведении исследований III фазы мы сталкиваемся с привычными сложностями:- высокие расходы на мониторинг и операции
- ограниченные ресурсы
Как следствие - увеличивается стоимость лекарственного средства и отодвигается срок его вывода на рынок.
2020 год привнес дополнительный фактор, связанный с пандемией COVID-19, - затруднение или полная невозможность очного мониторирования центров, что дополнительно увеличивает стоимость и сроки проведения исследований.
Зачем нам это было нужно
Мы столкнулись с теми же трудностями и начали анализировать возможные пути выхода из сложившейся ситуации. Единогласным решением стало введение RBM-модели.Это решение было принято еще до начала пандемии - но пандемия ускорила и расширила способы его реализации.
Как мы принимали решение
Мы преследовали конкретную цель: ускорить и удешевить процесс мониторирования при сохранении или росте качества получаемых данных.Поэтому основной задачей было изменить процесс, но оставить на прежнем высоком уровне:
- безопасность субъектов исследования,
- целостность и качество собираемых данных,
- качество исследуемого продукта.
- российские и международные регуляции (FDA, EMEA),
- опыт других компаний,
- наш предыдущий опыт внедрения и работы с RBM.
- внедрение риск-ориентированной методологии
- смещение фокуса мониторирования с очного на удаленное
- центральный мониторинг данных
- разработка дополнительных инструментов аналитической отчетности.
Сколько у нас было времени на переключение
Это был, безусловно, один из главных вызовов - на идущем исследовании в возможно кратчайшие сроки внедрить новый подход к мониторированию.Конечно, нам помогла гибкая платформа MainEDC™, обладающая техническими возможностями внедрения RBM.
Объединенная команда Натива и Data Management 365 выработала план перехода
Мы разбили процесс на этапы:- идентифицировать, оценить и приоритизировать риски, связанные с переходом на альтернативные принципы мониторирования
- определить методы и процедуры, позволяющие уменьшить вероятность реализации рисков
- определить процедуры, которые должны быть произведены в случае реализации рисков
- определить необходимый и достаточный объем документации
- оценить возможности создания операционно-программного комплекса
- внести необходимые изменения и дополнения в систему
- валидировать решение
- обучить команду проекта
- go live!
Делимся своим успехом и подробным описанием процесса
Определение стратегии RBMПодразумевается, что Мониторы исследования будут проводить удаленную верификацию определенного набора данных для каждого субъекта в каждом центре, при этом объем проверяемых и верифицируемых данных будет зависеть от текущего уровня оценки центра.
По окончании периода запрета на посещение центров также будет проведена он-сайт верификация определенного объема данных, также в зависимости от уровня оценки центра.
Идентификация и оценка рисков
Мы идентифицировали риски, сгруппировав их по типу:
- безопасность субъектов исследования,
- целостность и качество собираемых данных,
- качество исследуемого продукта.
- Серьезность риска
- Вероятность реализации риска
- Возможность обнаружения реализовавшегося риска.
Далее мы определили процедуры по снижению вероятности реализации каждого риска и устранению последствий.
Реорганизация бизнес-процессов
Для внедрения RBM и удаленного мониторинга, внутренние процессы компании Натива претерпели изменения. Было решено разработать документы, среди которых:
- Подробное описание стратегии RBM, где доступным для сотрудников медицинского отдела языком описывались цели, процедуры, риски удаленного мониторинга, а также общая информация по работе с данными;
- Пошаговая инструкция по работе с центрами, включающая в себя процедуру методики мониторирования центров, все необходимые для работы мониторов планы, схемы и шаблоны;
- Произведено обновление мониторингового плана и внутренних процедур компании.
При создании пакета мы учли, что документация может быть обновлена или переработана при необходимости.
Идентификация критических данных
Важнейшими факторами, влияющими на перечень и приоритет возможных рисков в исследовании, являются:
- данные по безопасности субъектов исследования
- данные для анализа первичных и вторичных точек протокола.
На этом этапе мы дополнительно обозначили события-триггеры, запускающие проверку критических данных.
Процедуры оценки центров (site health assessment)
Мы выработали перечень параметров оценки центров на основании данных, внесенных в MainEDC™, и назначили каждому параметру определенный вес.
Далее мы типизировали процедуры оценки:
- первичная
- рутинная (периодическая)
- внеплановая - вызванная определенным событием.
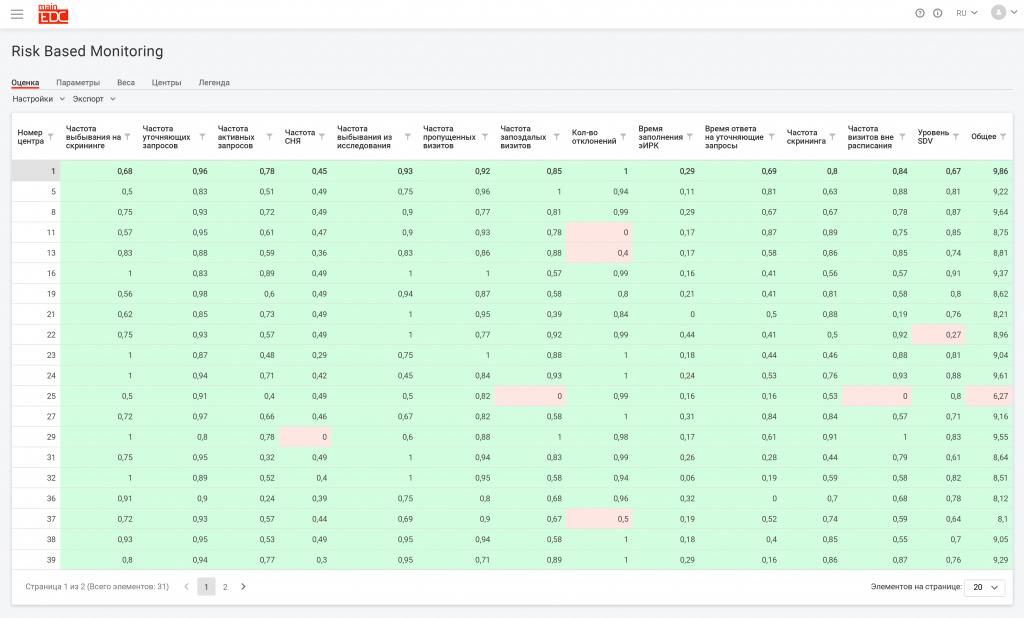
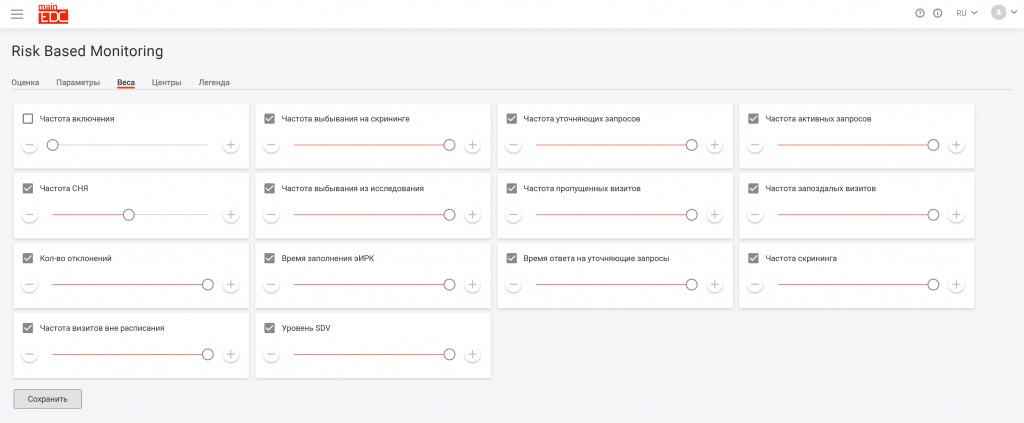
- необходимый масштаб SDV для каждого конкретного центра (в % от общего количества точек данных, вплоть до 100%)
- необходимость очной ре-верификации центра
- глубина Центрального Мониторинга.
Внесение необходимых изменений в MainEDC™
Мы проанализировали данные, которые должны помогать в принятии решений при оценке центра:
- состав данных и их представление в системе
- действия, которые могут быть произведены с данными
- разработали статистический базис для проведения оценки центра - линейная нормализация параметров и поиск выбросов
- реализовали и валидировали выбранное решение - от написания требований до приемочного тестирования Натива
- провели тренинги для мониторов Натива
После одобрения Натива инструмент RBM был перенесен на рабочую среду системы.
Что у нас получилось
Мы достигли поставленной цели. Срок и стоимость проведения исследования уменьшены, пандемия не привела к остановке процессов в исследовании.Мы оптимизировали свои бизнес-процессы и обкатали их настолько, чтобы масштабировать новый подход на другие проекты Натива.
Мы получили совершенный гибкий рабочий инструмент, отвечающий нашим ожиданиям и поставленным целям.
Качество получаемых данных не только осталось на заданном уровне, а даже повысилось.
Драматически упала нагрузка на мониторов и врачей. Теперь фокус специалистов направлен туда, где потенциально могут быть проблемы с данными.
Мы видим воодушевление команды мониторов!
Ссылки
Oversight of Clinical Investigations — A Risk-Based Approach to Monitoring (Guidance for Industry AUGUST 2013) https://www.fda.gov/regulatory-information/search-fda-guidance-documents/oversight-clinical-investig...
A Risk-Based Approach to Monitoring of Clinical Investigations Questions and Answers
(Draft Guidance for Industry MARCH 2019) https://www.fda.gov/regulatory-information/search-fda-guidance-documents/risk-based-approach-monitor...
Reflection paper on risk based quality management in clinical trials (18 November 2013 EMA/269011/2013 Compliance and Inspection) https://www.ema.europa.eu/en/documents/scientific-guideline/reflection-paper-risk-based-quality-mana...



























