Журнал "Амбулаторная хирургия" № 1-2, 2017г.
А.Е. Каратеев, д.м.н., ФГБНУ НИИР им. В.А. Насоновой
Нестероидные противовоспалительные препараты (НПВП) - один из основных классов анальгетиков и незаменимый компонент комплексной программы обезболивания в анестезиологической, хирургической и травматологической практике. Но использование НПВП может осложняться развитием целого спектра неблагоприятных реакций со стороны желудочно-кишечного тракта (ЖКТ), сердечно-сосудистой системы и почек, а также повышать риск развития послеоперационного кровотечения. Семейство НПВП насчитывает множество препаратов, но ни один из них нельзя признать идеальным по соотношению эффективности и безопасности. Поэтому появление нового представителя этой лекарственной группы - амтолметил гуацила -- вызывает большой интерес практикующих врачей. Этот препарат обладает особенностями фармакологического действия, определяющими его гастропротективный потенциал (прежде всего, за счет повышения концентрации окиси азота в слизистой оболочке), и способностью значительно снижать негативное действие на ЖКТ. Хотя амтолметил гуацил в основном применяют для купирования боли при заболеваниях суставов и позвоночника (остеоартрит, боль в спине, ревматоидный артрит и др.), он может с успехом применяться для контроля боли у хирургических пациентов.
Одним из главных фармакологических средств, используемых для контроля острой и хронической боли, являются нестероидные противовоспалительные препараты (НПВП). Их отличает комбинация анальгетического, противовоспалительного и жаропонижающего действия, с чем связано их преимущество в сравнении с другими обезболивающими средствами, такими как парацетамол и опиоиды. НПВП с успехом применяют при самых разных заболеваниях и патологических состояниях, которые проявляют себя болевыми ощущениями, вызванными повреждением или воспалением [1, 2].
Эти лекарства играют важную роль в программе комплексного обезболивания при травмах и хирургических операциях, поскольку фармакологическое действие НПВП определяется воздействием на основные элементы патогенеза острой боли [3, 4]. Нарушение целостности живой ткани приводит к выбросу биологически активных субстанций, активирующих болевые рецепторы. Основное значение здесь имеют простагландины (ПГ), синтез которых происходит благодаря «работе» фермента циклооксигеназы 2 (ЦОГ-2). Этот фермент становится фармакологической «мишенью» для всех НПВП, которые, независимо от химического строения, представляют собой селективные или неселективные ингибиторы ЦОГ- 2 [1, 5].
Но действие НПВП не исчерпывается только лишь снижением активности периферических болевых рецепторов. Существенное значение для развития анальгетического эффекта НПВП может иметь их влияние на центральные механизмы формирования боли. Прохождение мощного афферентного болевого импульса и стойкая активация нейронов, расположенных в задних рогах спинного мозга, вызывают реакцию со стороны глиальных клеток, что сопровождается выбросом провоспалительных субстанций, и прежде всего ПГЕ2. Этот процесс, с которым связывают феномен «центральной сенситизации», нарастающее повышение чувствительности спинальных нейронов, хорошо известен в патогенезе синдрома хронической боли. Синтез ПГЕ2 является ЦОГ-2-зависимым процессом, а следовательно, может подавляться НПВП [1, 2, 6].
Есть лабораторные и клинические данные, подтверждающие способность НПВП проникать в ткань центральной нервной системы (ЦНС). Как показали исследования, проведенные с участием здоровых добровольцев, после перорального приема или парентерального введения НПВП их концентрации в ликворе вполне достаточно для эффективного подавления ЦОГ-2 в ткани ЦНС [6-8].
Способность НПВП оказывать влияние как на периферические, так и на центральные ноцицептивные механизмы открывает уникальную возможность не только подавлять уже возникшую боль, но и предупреждать ее появление. Так, введение НПВП непосредственно перед операцией (т.н. «предоперационная аналгезия») позволяет достичь существенного снижения интенсивности боли, развивающейся после хирургического повреждения ткани, и значительно снижать потребность в анальгетиках в послеоперационном периоде [9-11].
В целом использование адекватных противовоспалительных доз НПВП в качестве монотерапии позволяет достичь приемлемого контроля боли, вызванной острой терапевтической патологией (например, при неспецифической боли в спине, остром подагрическом артрите, почечной колике и
т. д.). Монотерапия НПВП обеспечивает достаточный уровень анальгезии при небольших хирургических вмешательствах, таких как удаление зуба, при болезненных манипуляциях (например, репозиции костей после перелома), особенно если эти препараты применяются в качестве «предоперационной аналгезии», а также при небольших травмах. При очень сильной боли, связанной с серьезными хирургическими операциями или тяжелыми травмами, применение НПВП в программе комплексного обезболивания позволяет достичь лучших результатов аналгезии, обеспечивая большее снижение интенсивности боли и улучшение качества жизни, а главное -- снижая потребность в наркотических анальгетиках («опиоид-сберегающее» действие) [1, 4, 9].
НПВП -- незаменимый элемент лечения боли в послеоперационном периоде [12-14]. Хорошо известно, что неадекватная анальгезия в ближайшие дни после хирургического вмешательства является одним из главных факторов риска формирования синдрома хронической боли [15-17]. Это серьезная проблема, в частности, для ортопедической практики. Более четверти больных, перенесших тотальное эндопротезирование коленных и тазобедренных суставов по поводу остеоартрита (ОА), через год и более после операции продолжают испытывать серьезные боли в области оперативного вмешательства [18-20].
В качестве примера можно привести работу Wylde V. и соавт., которые оценили удовлетворенность результатами операции у 662 больных, перенесших эндопротезирование коленных суставов по поводу гонартроза. Через 3-4 года после хирургического вмешательства 40% больных предъявляли жалобы на боли в области оперированного сустава, а у 15% болевые ощущения оказались столь же выраженными или даже более сильными, чем до операции [21]. Близкие данные показали Liu S. и соавт.: среди 1 030 больных, перенесших эндопротезирование коленных и тазобедренных суставов, через год после операции 46% ощущали умеренно выраженную или сильную боль, в среднем >3 баллов по 10-бальной визуальной аналоговой шкале [22]. Bourne R. и соавт., проведя опрос 1 703 больных, перенесших эндопротезирование коленного сустава, показали, что 19% респондентов опрошенных не удовлетворены последствиями хирургического вмешательства [23].
Авторы серии методических обзоров, посвященных изучению причин боли после ортопедических операций, выделяют следующие факторы риска: хирургические проблемы и осложнения, патология околосуставных мягких тканей (тендиниты, тендовагиниты, бурситы и др.), исходные и сохраняющиеся нарушения биомеханики, дегенеративные изменения сопряженных с оперированным суставом структур (позвоночник, тазобедренный сустав, голеностопный сустав, стопа), неудовлетворительный психологический настрой, «катастрофизация» пациентов, а также исходно хроническая боль [15-17].
Очевидно, что контроль боли в первые дни и недели после операции требует активного использования обезболивающих препаратов, и НПВП, особенно в амбулаторном периоде, будут основой этой терапии.
К сожалению, эти препараты могут вызывать опасные неблагоприятные реакции (НР), прежде всего со стороны желудочно-кишечного тракта (ЖКТ), сердечно-сосудистой системы (ССС) и почек. Кроме этого, традиционные НПВП способны снижать свертываемость крови и усиливать кровоточивость из области хирургической раны. Поэтому врач, назначающий эти препараты, всегда должен уделять самое серьезное внимание оценке риска и профилактике возможных лекарственных осложнений [1, 24].
При относительно кратковременном использовании НПВП, которое практикуется в травматологической и хирургической практике, наиболее важен контроль ЖКТ-осложнений. Ведь хорошо известно, что патология ЖКТ - язвы, кровотечение, перфорация -- могут возникать в первые дни или даже часы после парентерального введения или перорального приема НПВП [1]. Очень наглядны данные финских исследователей Helin-Salmivaara A. и соавт., которые оценили зависимость риска развития ЖКТ-осложнений от длительности использования НПВП. Это было масштабное популяционное исследование по типу «случай-контроль», в котором основную группу составили 9 191 больных, у которых развилось ЖКТ-кровотечение, язва или перфорация, а контроль – 41,780 лиц без данной патологии. Оказалось, что опасность ЖКТ-осложнений была максимальной в первые 2 недели приема НПВП (отношение шансов, ОШ = 3,2), а затем существенно снижалась [25].
Как известно, основной причиной развития НР при использовании НПВП является способность этих препаратов блокировать, помимо индуцируемого фермента ЦОГ-2 (активность которого проявляется лишь после повреждения ткани), его биохимический «собрат» ЦОГ-1. Последний выполняет важную физиологическую роль, синтезируя цитопротективные ПГ (которые участвуют в защите слизистой ЖКТ), а также тромбоксан и простациклин, факторы, контролирующие агрегацию тромбоцитов. Неселективные НПВП (н-НПВП), такие как диклофенак, кетопрофен, лорноксикам, ибупрофен, кеторолак и др., не способны «различать» ЦОГ-1 и ЦОГ-2. Они подавляют активность обоих ферментов, что, с одной стороны, оказывает позитивное действие, уменьшая боль и воспаление, с другой стороны, увеличивает риск развития НР [1, 5].
С целью уменьшения риска развития ЖКТ-осложнений была создана новая генерация НПВП - селективные ЦОГ-2-ингибиторы (т. н. коксибы, от английского «COX-2 inhibitor»). Считается, что в терапевтических дозах эти препараты в очень малой степени влияют на активность физиологически важного фермента ЦОГ-1, тем самым существенно снижая вероятность НР. Ряд клинических исследований показал преимущество коксибов в плане существенного снижения частоты поражения ЖКТ и послеоперационного кровотечения в сравнении с н-НПВП при их применении в хирургической и травматологической практике [1-3].
Но, как оказалось, у коксибов есть важные недостатки. Так, эти препараты могут оказывать протромботическое действие и ухудшать почечный кровоток, что особенно важно в послеоперационном периоде. Этот факт подтверждает метаанализ 53 рандомизированных контролируемых исследований (РКИ), суммарно включавших 4 895 больных, в которых сравнивалась эффективность и безопасность коксибов, н-НПВП и плацебо в периоперационном периоде. Коксибы не вызывали повышения риска кровотечений (для традиционных НПВП ОШ был равен 4,54). Однако при их использовании достоверно чаще, в сравнении с плацебо, отмечались эпизоды олигурии (12%, ОШ = 1,47) и острой почечной недостаточности (1,4% на коксибах, 0,9% на н-НПВП и 0 на плацебо, ОШ = 4,86) [10].
Хорошо известно, что наиболее селективный НПВП – эторикоксиб - отчетливо повышает риск дестабилизации артериальной гипертензии. Это показывают данные исследования MEDAL, в ходе которого 34 701 больной ОА и ревматоидным артритом (РА) в течение не менее 1,5 лет получали эторикоксиб 60 и 90 мг или диклофенак 150 мг/сут. Эпизоды развития и дестабилизации артериальной гипертензии отчетливо чаще отмечались при использовании эторикоксиба - 2,2 и 2,5% в сравнении с диклофенаком - 1,1-1,6% [26, 27].
По данным популяционных исследований, применение эторикоксиба ассоциируется со значительным повышением риска развития инфаркта миокарда. Так, метаанализ 25 популяционных работ, включавших более 100 тыс. пациентов, перенесших инфаркт миокарда, показал что, эторикоксиб демонстрировал наибольший риск развития данного осложнения (ОШ = 1,97) [28].
Как видно, коксибы не могут претендовать на роль идеального анальгетика для ургентного обезболивания. Для реальной клинической работы хотелось бы иметь препарат, который обладает лучшей ЖКТ-переносимостью, чем н-НПВП, но при этом не вызывает значительного повышения кардиоваскулярного риска.
Таким препаратом может стать фармакологическая новинка последних лет - амтолметил гуацил (АМГ). Этот препарат представляет собой модификацию молекулы хорошо известного на Западе традиционного НПВП толметин. В клинической практике толметин применяется более 40 лет. Он зарекомендовал себя как надежный анальгетик с выраженными противовоспалительными свойствами. Его терапевтический потенциал доказан как для купирования острой боли, так и для лечения хронических ревматических заболеваний. Интересный факт, что в США толметин зарегистрирован для использования в педиатрической практике у детей с 2-летнего возраста [29, 30].
Модификация толметина произошла благодаря введению в его структуру аминокислоты ванилина, что позволило существенно изменить фармакологические свойства препарата. АМГ, в отличие от своего предшественника, приобрел отчетливые гастропротективные свойства [31]. Это в первую очередь определяется подавлением активности ингибиторов индуцируемой формы синтетазы окиси азота, NO (iNOS), что обеспечивает значительное повышение концентрации NO в слизистой ЖКТ [31--33]. Данный эффект подтверждается, в частности, работой Coruzzi G. и соавт., которые показали многократное нарастание активности iNOS в слизистой ЖКТ лабораторных животных на фоне введения АМГ; ни плацебо, ни толметин такого эффекта не давали [32].

Гастропротективный потенциал АМГ не исчерпывается только повышением концентрации NO: он также активирует рецепторы капсаицина, усиливает синтез кальцитонинген-связанного пептида, подавляет перикисное окисление липидов, снижает секреции соляной кислоты и ускоряет репарацию клеток слизистой желудка [31-33].
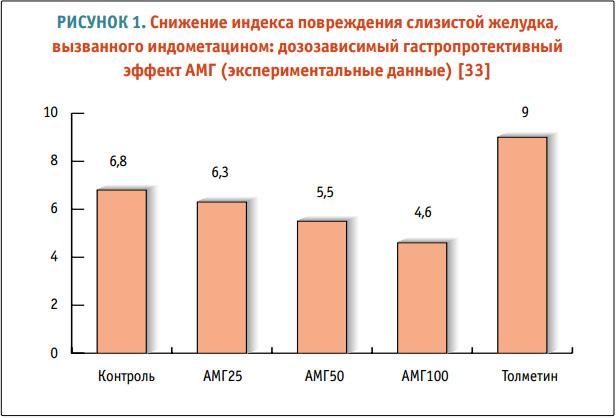
Позитивный потенциал АМГ был доказан серией лабораторных исследований. Например, в работе Tubaro E. и соавт. этот препарат демонстрировал зависящее от дозы подавление стимулированной желудочной секреции, работая как вполне эффективное антисекреторное средство (рис. 1). При этом АМГ усиливал секрецию бикарбоната, являющегося основой щелочного «буфера» слизистой желудка. Очень важно, что сам АМГ, будучи НПВП, снижал повреждающее действие других НПВП при комбинированном использовании. Так, в сравнении с плацебо или толметином на фоне введения АМГ у лабораторных животных было выявлено достоверное дозозависимое уменьшение выраженности повреждения слизистой, вызванной введением индометацина [33].
Ценные данные были представлены Morini G. и соавт., изучавших морфологическую картину слизистой желудка крыс, получавших АМГ, толметин и целекоксиб. Согласно полученным результатам, в группе животных, получавших АМГ, не было отмечено повреждения эндотелиальных клеток и воспалительных изменений в слизистой желудка в отличие от контрольных препаратов. Важно отметить, что воспалительные изменения слизистой развивались даже на фоне приема целекоксиба, который по праву считается одним из наиболее безопасных в отношении развития патологии ЖКТ представителей группы НПВП [34].
Прием АМГ действенно устранял нарушения моторики верхних отделов ЖКТ у здоровых добровольцев, получивших в качестве раздражающего средства 40--80 мг чистого этилового спирта. Его эффект практически не отличался от действия мизопростола (синтетического аналога ПГЕ1), который является мощным гастропротектором с доказанным лечебным потенциалом. При этом прием диклофенака и плацебо однозначно усиливал расстройства функции ЖКТ, вызванные приемом этилового спирта [35].
Хотя лабораторные исследования представляют большой интерес, наибольшее значение для оценки перспектив применения АМГ имеет опыт клинических испытаний, проведенных с участием реальных пациентов. На сегодняшний день было выполнено немало таких работ, позволяющих взвешенно судить о достоинствах нового препарата.
Так, имеются данные масштабного 30-дневного исследования, в ходе которого АМГ в дозе 1 200--600 мг/сут назначался 388 больным с острой болью, связанной с ОА крупных суставов или неспецифической болью в области спины. По всем параметрам оценки боли и нарушения функции прием АМГ обеспечивал достоверное улучшение [36].
В ходе 4-недельного РКИ было проведено сравнение АМГ и диклофенака у 50 больных с выраженной мышечно-скелетной болью. Выраженность боли оценивалась по 5-бальной шкале (от 0 до 4). Согласно полученным данным, АМГ не уступал, а по ряду параметров даже превосходил препарат контроля. Так, боль в покое, при движении и выраженность нарушения функции в конце терапевтического периода составила в исследуемых группах 0,5 и 1,2; 0,7 и 0,8; 0,4 и 1,1 баллов соответственно [37].
Хороший лечебный потенциал и относительную безопасность АМГ демонстрирует метаанализ серии 18 РКИ продолжительностью от 4 нед. до 6 мес., в которых сравнивалось лечебное действие и частота НР при использовании АМГ и традиционных НПВП, таких как диклофенак, толметин, пироксикам и индометацин (n = 780). Какие-либо осложнения на фоне приема нового препарата возникали гораздо реже, чем в контрольных группах - ОШ для их развития составило 0,2 (0,1-0,3); риск появления осложнений со стороны ЖКТ был меньше более чем в 3 раза - ОШ 0,3 (0,1--0,7). В трех работах (n = 92) безопасность АМГ оценивалась по результатам оценки эндоскопической картины верхних отделов ЖКТ. Препаратами сравнения здесь были индометацин, толметин и диклофенак (рис. 2). Как видно, лишь у нескольких больных, получавших АМГ, развились небольшие изменения слизистой ЖКТ в виде единичных геморрагий или эрозий. При этом использование обычных НПВП вызвало появление эрозий и язв почти у половины участников исследований [38].
Большой интерес представляет исследование хорватских ученых, которые сравнили безопасность АМГ и целекоксиба. Последний, как было отмечено выше, считается НПВП с наилучшей переносимостью. В ходе этой работы 180 больных РА в течение 6 месяцев получали АМГ в дозе 1 200 мг или целекоксиб в дозе 400 мг, причем всем до- и после курса лечения проводилось эндоскопическое исследование ЖКТ. Полученные данные представлены на рисунке 3. Можно видеть, что у подавляющего большинства пациентов не было отмечено развития каких-либо изменений ЖКТ. При этом АМГ по уровню ЖКТ-переносимости нисколько не уступал целекоксибу. Терапевтическая эффективность была эквивалентной в обеих группах, статистически значимые различия между двумя группами приема лекарственных препаратов во всех временных промежутках не наблюдались [39].

Уже появляются российские работы, показывающие успешное использование АМГ. Так, совсем недавно были опубликованы результаты исследования И.З. Гайдукова и соавт., в котором изучалась эффективность нового препарата у 48 больных анкилозирующим спондилитом. Было показано, что назначение высокой дозы 1 800 мг/сут с последующим ее снижением (деэскалация) до 600 мг/сут обеспечивала существенное уменьшение боли: в среднем она уменьшилась за 4 нед. с 5,5 до 2,3 баллов по 10-бальной ВАШ. При этом, что было областью особого контроля, у больных не отмечалось отрицательной динамики артериального давления. АМГ показал безопасное применение у пациентов с артериальной гипертонией [40].
В Европе АМГ используется под брендовыми наименованиями Artricol®, Artromed® (Medosan, Италия) и Eufans® (Sigma-Tau, Италия). В нашу страну новый препарат пришел под названием Найзилат® (производитель Доктор Редди’с). Можно думать, что этот представитель группы НПВП расширит возможности российских врачей при борьбе с острой и хронической болью. АМГ, по имеющимся литературным данным, имеет определенные преимущества в сравнении со многими традиционными НПВП. Ставший основой для создания нового препарата толметин хорошо известен врачам Европы и США как действенное анальгетическое и противовоспалительное средство. При этом, в соответствие с результатами серии РКИ, АМГ нисколько не уступает по лечебному потенциалу своему предшественнику. Найзилат® имеет собственное гастропротективное действие за счет повышения концентрацию NO в слизистой оболочке ЖКТ, увеличения репаративного потенциала эпителиоцитов и снижения синтеза соляной кислоты. Имеются доказательства большей безопасности АМГ для ЖКТ в сравнении со многими н-НПВП, в частности диклофенаком. Согласно результатам достаточно крупного РКИ, АМГ не уступает целекоксибу по своей переносимости и низкой частоте развития язв и эрозий ЖКТ. Необходимо отметить, что размеры работ, подтверждающих преимущества АМГ, относительно невелики; не все параметры его безопасности, в частности влияние на сердечно-сосудистую систему, изучены достаточно полно. Это определяет необходимость проведения собственных российских исследований АМГ. Тем не менее имеющаяся на сегодняшний день информация дает возможность рекомендовать Найзилат® в качестве хорошей альтернативы традиционным НПВП при лечении острой и хронической боли, в т. ч. в хирургической и травматологической практике.
2. Боль (практическое руководство для врачей). Под ред. Яхно Н.Н., Кукушкина М.Л., Москва, Издательство РАМН, 2012, 512 c.
3. Allegri M, Clark MR, De Andrés J, Jensen TS. Acute and chronic pain: where we are and where we have to go. Minerva Anestesiol, 2012 Feb, 78(2): 222-35. Epub 2011 Nov 18.
4. Schug S, Manopas A. Update on the role of non-opioids for postoperative pain treatment. Best Pract Res Clin Anaesthesiol, 2007, 21(1): 15-30.
5. Camu F. The role of COX-2 inhibitors in pain modulation. Drug, 2003, 63(suppl.): 1-7.
6. Mehta V, Johnston A, Cheung R, Bello A, Langford R. Intravenous parecoxib rapidly leads to COX-2 inhibitory concentration of valdecoxib in the central nervous system. Clin Pharmacol Ther, 2008, 83(3): 430-435.
7. Dembo G, Park S, Kharasch E. Central nervous system concentrations of cyclooxygenase-2 inhibitors in humans. Anesthesiology, 2005, 102(2): 409-415.
8. Bianchi M, Martucci C, Ferrario P, Franchi S, Sacerdote P. Increased Tumor Necrosis Factor- and Prostaglandin E2 Concentrations in the Cerebrospinal Fluid of Rats with Inflammatory Hyperalgesia: The Effects of Analgesic Drugs. Anesth Analg, 2007, 104: 949-954.
9. Marret E, Kurdi O, Zufferey P, Bonnet F: Effects of nonsteroidal antiinflammatory drugs on patient-controlled analgesia morphine side effects. Anesthesiology, 2005, 102: 1249-60.
10. Elia N, Lysakowski C, Tramèr M. Does Multimodal Analgesia with Acetaminophen, Non-steroidal Antiinflammatory Drugs, or Selective Cyclooxygenase-2 Inhibitors and Patient-controlled Analgesia Morphine Offer Advantages over Morphine Alone?: Meta-analyses of Randomized Trials. Anesthesiology, 2005, 103(6): 1296-1304.
11. Lamplot J, Wagner E, Manning D. Multimodal Pain Management in Total Knee Arthroplasty: A Prospective Randomized Controlled Trial. J Arthroplasty, 2013 Jul 11. pii: S0883-5403(13)00418-X. doi: 10.1016/j.arth.2013.06.005. [Epub ahead of print].
12. White P, Raeder J, Kehlet H. Ketorolac: its role as part of a multimodal analgesic regimen. Anesth Analg, 2012, 114(2): 250-254.
13. Guidelines for the Management of Postoperative Pain after Total Knee Arthroplasty Korean Knee Society Korean Knee Society. Knee Surg Relat Res, 2012, 24(4): 201-207. http://dx.doi.org/10.5792/ksrr.2012.24.4.201.
14. Осипова Н.А., Петрова В.В., Ермолаев П.М., Береснев В.А. Нестероидные противовоспалительные препараты в лечении послеоперационной боли у онкологических больных. Фарматека, 2006, 6: 74-78.
15. Puig MM. Can we prevent acute pain becoming chronic? J Pain Palliat Care Pharmacother, 2013 Aug, 27(3): 284-5. doi: 10.3109/15360288.2013.817499. Epub 2013 Aug 2.
16. Werner MU, Kehlet H. Characterization of persistent postoperative pain by quantitative sensory testing. Eur J Pain Suppl, 2010, 4: 203-7.
17. Granot M. Can we predict persistent postoperative pain by testing preoperative experimental pain? Curr Opin Anaesthesiol, 2009, 22: 425-30.
18. Piscitelli P, Iolascon G, Innocenti M et al. Painful prosthesis: approaching the patient with persistent pain following total hip and knee arthroplasty. Clinical Cases in Mineral and Bone Metabolism, 2013, 10(2): 97-110.
19. Hofmann S, Seitlinger G, Djahani O, Pietsch M. The painful knee after TKA: a diagnostic algorithm for failure analysis. Knee Surg Sports Traumatol Arthrosc, 2011, 19(9): 1442-1452.
20. Seil R, Pape D. Causes of failure and etiology of painful primary total knee arthroplasty. Knee Surg Sports Traumatol Arthrosc, 2011, 19(9): 1418-1432.
21. Wylde V, Hewlett S, Learmonth I, Dieppe P. Persistent pain after joint replacement: prevalence, sensory qualities, and postoperative determinants. Pain, 2011, 152(3): 566-572.
22. Liu SS, Buvanendran A, Rathmell JP et al. A cross-sectional survey on prevalence and risk factors for persistent postsurgical pain 1 year after total hip and knee replacement. Reg Anesth Pain Med, 2012 Jul-Aug, 37(4): 415-22. doi: 10.1097/AAP.0b013e318251b688.
23. Bourne R, Chesworth B, Davis A et al. Patient Satisfaction after Total Knee Arthroplasty. Who is Satisfied and Who is Not? Clin Orthop Relat Res, 2010, 468: 57-63.
24. Harirforoosh S, Asghar W, Jamali F. Adverse Effects of Nonsteroidal Antiinflammatory Drugs: An Update of Gastrointestinal, Cardiovascular and Renal Complications. J Pharm Pharm Sci, 2013, 16(5): 821-47.
25. Helin-Salmivaara A, Saarelainen S, Gronroos J, et al. Risk of upper gastrointestinal events with the use of various NSAIDs: A case-control study in a general population. Scan J Gastroenterol, 2007, 42: 923-932.
26. Krum H, Swergold G, Curtis SP, Kaur A, Wang H, Smugar SS, et al. Factors associated with blood pressure changes in patients receiving diclofenac or etoricoxib: results from the MEDAL study. J Hypertens, 2009, 27(4): 886-93.
27. Combe B, Swergold G, McLay J et al. Cardiovascular safety and gastrointestinal tolerability of etoricoxib vs diclofenac in a randomized controlled clinic trial (The MEDAL study). Rheumatology, 2009, 48: 425-432.
28. Varas-Lorenzo C, Riera-Guardia N, Calingaert B, Castellsague J, Salvo F, Nicotra F, Sturkenboom M, Perez-Gutthann S. Myocardial infarction and individual nonsteroidal anti-inflammatory drugs meta-analysis of observational studies. Pharmacoepidemiology and Drug Safety, 2013, 22: 559-570. DOI: 10.1002/pds Published online 25 April 2013 in Wiley Online Library (wileyonlinelibrary.com).
29. Cordrey LJ. Tolmetin sodium, a new anti-arthritis drug: double-blind and long-term studies. Journal of the American Geriatrics Society, 1976, 24(10): 440-446.
30. AHFS Drug Information 2007. McEvoy GK, ed. Tolmetin. Bethesda, MD: American Society of Health-System Pharmacists; 2007: 2118-2122.
31. Garg A, Shoeb A, Moodahadu LS et al. Amtolmetin: A Reappraisal of NSAID with Gastroprotection. Arthritis, 2016, 2016: 7103705. doi: 10.1155/2016/7103705. Epub 2016 Mar 22.
32. Coruzzi G, Coppelli G, Spaggiari S et al. Gastroprotective effects of amtolmetin guacyl: a new non-steroidal anti-inflammatory drug that activates inducible gastric nitric oxide svnthase. Dig Liver Dis, 2002, 34(6): 403-10.
33. Tubaro E, Belogi L, Mezzadri CM. The mechanism of action of amtolmetin guacyl, a new gastroprotective nonsteroidal anti-inflammatory drug. European Journal of Pharmacology, 2000, 387: 233-244.
34. Morini G, Guaita E, Lazzaretti M., et al. Morphological features of rat gastric mucosa after acute and chronic treatment with amtolmetin guacyl: comparison with non-selective and COX-2-selective NSAIDs. Digestion, 2003, 68(2-3): 124-32.
35. Riezzo G, Chiloiro M, Montanaro S. Protective effect of amtolmetin guacyl versus placebo diclofenac and misoprostol in healthy volunteers evaluated as gastric electrical activity in alcohol-induced stomach damage. Dig Dis Sci, 2001, 46(8): 1797-804.
36. Biasi G, Marcolongo R. Efficacy and safety of amtolmetin guacyl in the treatment of acute osteoarthritis. Minerva Med, 2001 Oct, 92(5): 315-24.
37. Tavella A, Ursini G. A clinical study on the anti-inflammatory activity and gastrointestinal tolerability of amtolmetin guacyl, a new NSAID, compared with diclofenac in aged patients with osteoarticular diseases. Article in Italian. Clin Ter, 1997 Nov, 148(11): 543-8.
38. Marcolongo R, Frediani B, Biasi G et al. A Meta-Analysis of the Tolerability of Amtolmetin Guacil, a Novel, Effective Nonsteroidal Anti-Inflammatory Drug, Compared with Established Agents. Clin Drug Invest, 1999, 17(2): 89-96.
39. Jajić Z, Malaise M, Nekam K et al. Gastrointestinal safety of amtolmetin guacyl in comparison with celecoxib in patients with rheumatoid arthritis. Clin Exp Rheumatol, 2005, 23(6): 809-18. 40. Гайдукова И.З., Ребров А.П., Апаркина А.В., Хондкарян Э.В. Эффективность и кардиоваскулярная безопасность амтолметин гуацила (Найзилата) у больных анкилозирующим спондилитом: промежуточные результаты исследования КОРОНА. Эффективная фармакотерапия. Ревматология. Травматология. Ортопедия, 2015, 3-4: 47-53.








