
Журнал "Медицинский совет" №20/2024
DOI: 10.21518/ms2024-433
Г.Е. Баймаканова1, И.Ю. Тараканова1,
М.В. Самсонова1,2, И.П. Белоглазова3,4, И.В. Канеева4,
Е.Н. Черникова1, О.В. Манченко4, Д.А. Цюкало3
1 Московский клинический научный центр имени А.С. Логинова; 111123, Россия, Москва, шоссе Энтузиастов, д. 86
2 Научно-исследовательский институт пульмонологии Федерального медико-биологического агентства; 115682, Россия, Москва, Ореховый бульвар, д. 28
3 Российский национальный исследовательский медицинский университет имени Н.И. Пирогова; 117997, Россия, Москва, ул. Островитянова, д. 1
4 Городская клиническая больница №52; 123182, Россия, Москва, ул. Пехотная, д. 3
В статье описаны клинические случаи повреждения легких, ассоциированного с курением электронных сигарет, — «болезнь вейперов» (англ. EVALI, от E-cigarette and Vaping use-Associated Lung Injury) с кратким обзором литературы. В связи с распространением и популяризацией электронных сигарет поражение легких, ассоциированное с их курением, встречается все чаще. Термин EVALI появился в 2019 г. во время самой масштабной вспышки заболевания в США, тогда же были разработаны критерии верификации диагноза. В обзоре приведены описания разнообразных устройств для вейпинга и курительных жидкостей, представлены возможные механизмы повреждения ткани легких, возникающие в результате курения электронных сигарет, а также травматические воздействия в результате взрыва литиевых батарей вейпов. Наиболее частыми клиническими проявлениями являются респираторные (одышка, кашель, боль в груди, кровохаркание), конституциональные (лихорадка, общая слабость) и гастроэнтерологические (тошнота, рвота, диарея, боль в животе) симптомы. Рентгенологическая и гистологическая картина заболевания неспецифична и разнообразна. Диагностика «болезни вейперов» включает широкий комплекс исследований и является диагнозом исключения. В лечении EVALI нет стандартизированных подходов, но большинству пациентов требуется кислородотерапия, респираторная поддержка и применение системных глюкокортикостероидов. В современной литературе отсутствуют сведения о хроническом поражении легких на фоне курения электронных сигарет. В представленной статье описаны клинические случаи острого повреждения легочной ткани и отдаленных последствий в результате вейпинга. Таким образом, EVALI является новым заболеванием, требующим дальнейшего наблюдения и изучения.
Для цитирования: Баймаканова ГЕ, Тараканов ИЮ, Самсонова МВ, Белоглазова ИП, Канеева ИВ, Черникова ЕН, Манченко ОВ, Цюкало ДА. Повреждение легких, ассоциированное с курением электронных сигарет (EVALI). Медицинский совет. 2024;18(20):30–39. https://doi.org/10.21518/ms2024-433.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Согласие пациентов на публикацию: пациенты подписали информированное согласие на публикацию своих данных.
Lung damage associated with e-cigarette smoking (EVALI)
Gulsara E. Baimakanova1, Irina Yu. Tarakanova1,
Maria V. Samsonova1,2, Irina P. Beloglazova3,4, Irina V. Kaneeva4,
Ekaterina N. Chernikova1, Oksana V. Manchenko4, Dmitrii A. Tsiukalo3
1 Loginov Moscow Clinical Scientific Center; 86, Entuziastov Shosse, Moscow, 111123, Russia
2 Research Institute for Pulmonology of the Federal Medical Biological Agency; 8, Orekhovy Boulevard, Moscow, 115682, Russia
3 Pirogov Russian National Research Medical University; 1, Ostrovityanov St., Moscow, 117997, Russia
4 Municipal Clinical Hospital No. 52; 3, Pekhotnaya St., Moscow, 123182, Russia
This article describes clinical cases of lung damage associated with e-cigarette smoking, EVALI (from E-cigarette and Vaping use-Associated Lung Injury) with a brief review of the literature. With the proliferation and popularization of electronic cigarettes, lung injury associated with their smoking is becoming more common. The term EVALI emerged in 2019 during the largest outbreak in the United States of America (USA), at which time criteria for verifying the diagnosis were developed. This review provides descriptions of a variety of vaping devices and smoking liquids, presents possible mechanisms of lung tissue damage resulting from smoking e-cigarettes, as well as traumatic effects from exploding lithium vape batteries. The most frequent clinical manifestations are respiratory (dyspnea, cough, chest pain, hemoptysis), constitutional (fever, general weakness) and gastroenterologic (nausea, vomiting, diarrhea, abdominal pain) symptoms. The radiologic and histologic pictures of the disease are nonspecific and varied. The diagnosis of “vape disease” includes a wide range of investigations and is a “diagnosis of exclusion”. There are no standardized approaches in the treatment of EVALI, but most patients require oxygen therapy, respiratory support, and the use of systemic glucocorticosteroids. In the current literature there is no information about chronic lung damage against the background of smoking electronic cigarettes. The presented article describes clinical cases of acute lung tissue damage and long-term consequences as a result of vaping. Thus, EVALI is an emerging disease requiring further surveillance and study.
For citation: Baimakanova GE, Tarakanova IYu, Samsonova MV, Beloglazova IP, Kaneeva IV, Chernikova EN, Manchenko OV, Tsiukalo DA. Lung damage associated with e-cigarette smoking (EVALI). Meditsinskiy Sovet. 2024;18(20):30–39. (In Russ.) https://doi.org/10.21518/ms2024-433.
Conflict of interest: the authors declare no conflict of interest.
Basic patient privacy consent: patients signed informed consent for the publication of their data.
Введение
«Болезнь вейперов» (EVALI) – неинфекционное респираторное заболевание, связанное с использованием электронных сигарет, которое получило официальное определение в 2019 г. [1].
В 2006 г. электронные сигареты появились на международном рынке и с этого времени неуклонно набирают популярность. Первоначально электронные сигареты презентовались как средство отказа от курения для взрослых, однако они стали активно использоваться молодежью в связи с внешней привлекательностью устройств для вейпинга (vapour – «пар», vape (вейп) – «курить, парить электронную сигарету»), разнообразием ароматов, вкусов и добавок подсластителей в курительные жидкости [1, 2].
При курении электронных сигарет вдыхается сложная смесь химических веществ, включая никотин, часто в высоких концентрациях, растворители (пропиленгликоль, растительный глицерин и др.), ароматизаторы, специфические для табака нитрозамины, летучие органические соединения, фенольные соединения, алкалоиды табака, альдегиды, фураны и металлы, оказывающие неблагоприятное воздействие на организм человека. А учитывая частое отсутствие достоверной и полной информации о химическом составе курительных жидкостей, смешивание различных курительных смесей с приобретением аддитивной токсичности компонентов, значительно повышаются риски передозировки никотина, неблагоприятных воздействий на легочную, сердечно-сосудистую, нервную системы и органы пищеварения [1, 2].
В настоящее время во множестве исследований описаны острые поражения органов и систем в результате вейпинга, а последствия долгосрочного воздействия «парения» продолжают активно изучаться.
В статье рассмотрены клинические случаи поражения легких при использовании электронных сигарет, освещены основные вопросы клинико-диагностических и лечебных мероприятий у пациентов с EVALI.
Клинический случай 1
Пациентка 23 лет, ИМТ 23,9 кг/м2, c жалобами на редкий малопродуктивный кашель госпитализирована в стационар.
Из анамнеза заболевания известно, что заболела остро 17.10.2022 г., когда появились жалобы на кашель, одышку при физической нагрузке (ходьба по ровной местности до 30–50 м), повышение температуры тела до 37,5 °C в ночные часы.
Пациентка отрицала контакт с инфекционными больными и хронические заболевания органов дыхания. Несколько месяцев работала бариста, в т.ч. самостоятельно молола кофейные зерна, на рабочем месте находилась возле работающей кофемашины. Стаж эпизодического курения составлял 3 года по 1 сигарете в сутки в летние месяцы. С лета 2021 г. пациентка перешла на регулярное курение электронных сигарет. Пациентка сообщила, что накануне заболевания 16.10.2022 г. отдыхала в клубе, где выявлялась задымленность от бесконтрольного массового курения посетителями электронных сигарет.
Ввиду нарастания одышки, появления кровохарканья госпитализирована 22.10.2022 г. с признаками острой дыхательной недостаточности в инфекционный стационар в отделение анестезиологии и реанимации (ОАР). При осмотре состояние тяжелое, аускультативно в нижних отделах легких на фоне ослабленного везикулярного дыхания выслушивалась крепитация; на воздухе SpO2 – 87%, на кислородотерапии 9 л/мин – 93%, артериальное давление 120/87 мм рт. ст., ЧСС 128 уд/мин. Остальные системы органов без патологии.
На компьютерной томограмме органов грудной клетки (КТ ОГК) в верхних и средних отделах легких отмечалось диффузное неравномерное снижение пневматизации по типу матового стекла, утолщение междольковых и внутридольковых перегородок, множественные мелкоочаговые уплотнения и мелкие полости, утолщение стенок бронхов в прикорневых отделах, количественное увеличение внутригрудных лимфатических узлов, паратрахеальной группы – до 11 мм, парааортальной – до 12 мм (рис. 1). Проведены ультразвуковые исследования сосудов нижних конечностей и органов брюшной полости, эхокардиограмма, компьютерная томограмма органов брюшной полости и забрюшинного пространства с контрастным усилением, патологии не выявлено.
Рисунок 1. КТ-картина диффузного снижения плотности легочной ткани, множественных, мелких полостей, количественной внутригрудной лимфаденопатии
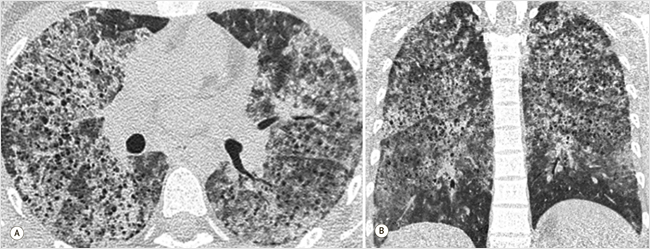
А – аксиальная плоскость, режим MPR; B – фронтальная плоскость, режим MPR. MPR (Multi-Planar Reconstruction) – режим многоплоскостной реконструкции
А – axial plane, MPR mode; B – frontal plane, MPR mode. MPR – Multi-Planar Reconstruction mode
В анализах крови в динамике определялось снижение уровня эритроцитов – 2,36 х 1012/л, гемоглобина – 71 г/л; повышение лейкоцитов – 12,5 х 109/л, С-реактивного белка (СРБ) – 107 мг/л, общего билирубина – 37,0 мкмоль/л (за счет непрямой фракции билирубина – 30,0 мкмоль/л), лактатдегидрогеназы – 330 ЕД/л, D-димера – 2645,09 нг/мл. Исследования крови на вирусы гриппа группы А, В, H1N1, H3N2, других возбудителей острых респираторных вирусных инфекций и иммуноглобулины М, G (IgМ, IgG) к Chlamydophila pneumonia и Mycoplasma pneumoniae, IgM к Cytomegalovirus показали отрицательные результаты.
В условиях ОАР проводилась терапия преднизолоном 120–250 мг/с и дексаметазоном 8–10 мг/с, антибиотиками и препаратами железа, постоянная кислородотерапия, а также однократная трансфузия эритроцитарной массы. После стабилизации состояния 28.10.2023 г. пациентка была переведена в терапевтическое отделение, потребность в кислородотерапии сохранялась. На контрольной КТ ОГК с контрастным усилением наблюдалось существенное снижение плотности видимых ранее сливных очагов и инфильтратов (рис. 2), центрилобулярная эмфизема легких. При проведении фибробронхоскопии (ФБС) выявлен диффузный бронхит 1-й степени интенсивности воспаления. УЗИ матки и придатков патологии не выявило.
Рисунок 2. КТ-картина уменьшения интенсивности очагов и инфильтративных изменений с сохранением мелких тонкостенных полостей
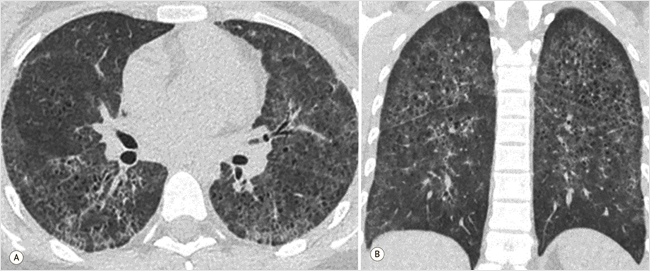
А – аксиальная плоскость, режим MPR; В – фронтальная плоскость, режим MPR. MPR (Multi-Planar Reconstruction) – режим многоплоскостной реконструкции
A – axial plane, MPR mode; B – frontal plane, MPR mode. MPR – Multi-Planar Reconstruction mode
Ревмоскрининг (в т.ч. антитела к нуклеарному антигену, ассоциированному с ревматоидным артритом, антитела к β2-гликопротеину, суммарные антитела к кардиолипину, антитела к протеиназе-3 (антиPR-3), суммарные антитела к фосфатидилсерину, антитела к негистоновому хромосомному белку Scl-70 (антиScl-70)) выявил изолированное повышение антител к миелопероксидазе (антиМПО) IgG – 31,0 МЕ/л (положительный результат при значении более 20).
После завершения обследования и улучшения состояния пациентка была направлена и госпитализирована 08.12.2022 г. в другой стационар для морфологической верификации изменений в легких. На данном этапе по динамике КТ-картины в сравнении с предыдущими исследованиями отмечалась существенная регрессия инфильтративных изменений в легочной ткани (рис. 3).
Рисунок 3. КТ-картина полного разрешения инфильтрации и очагов в обоих легких, внутригрудной лимфаденопатии, центрилобулярной эмфиземы легких
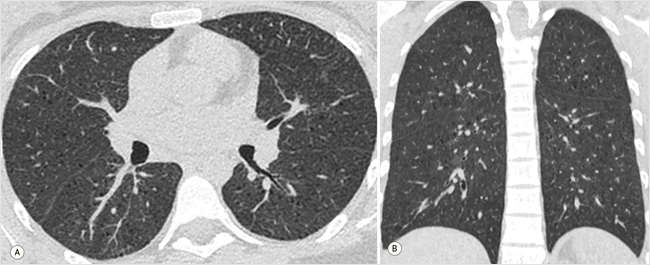
А – аксиальная плоскость, режим MPR; В – фронтальная плоскость, режим MPR. MPR (Multi-Planar Reconstruction) – режим многоплоскостной реконструкции
A – axial plane, MPR mode; B – frontal plane, MPR mode. MPR – Multi-Planar Reconstruction mode
Показатели общего клинического и биохимического анализа крови, мочи, общих IgA, IgМ, IgG, IgE, а также контрольное исследование антинуклеарного фактора (HEp-2), антиScl-70, антиPR-3, антиМПО были в пределах референсных значений.
Исследование функции внешнего дыхания (ФВД) выявило нарушение вентиляции легких по рестриктивному типу легкой степени тяжести: жизненная емкость легких 71% от долж., форсированная жизненная емкость легких 76% от долж., объем форсированного выдоха 75% от долж., индекс Тиффно 84,8%, общая емкость легких (ОЕЛ) 77% от долж., остаточный объем легких (ООЛ) 88% от долж., ООЛ/ОЕЛ 113%, резервный объем выдоха 76% от долж. Диффузионная способность легких составила (DLCO) 78% от долж., альвеолярный объем (Va) – 70% от долж., DLCO/Va – 114%.
Пациентке проведена диагностическая ФБС; выполнена трансбронхиальная криобиопсия левого легкого из 2-го и 6-го сегментов, бронхоальвеолярный лаваж (БАЛ) из 6-го сегмента левого легкого, получена геморрагическая жидкость.
Цитологический анализ БАЛ: цитоз – 2,60 х 106/мл, альвеолярные макрофаги – 91%, лимфоциты – 7%, нейтрофилы – 1%, эозинофилы – 1%; кислотоустойчивые микобактерии – не обнаружены; в окрашенном препарате фон – эритроциты.
При гистологическом исследовании в просветах альвеол были выявлены сидерофаги, местами – многоядерные клетки с кристаллоидными включениями холестерина; в стенках единичных бронхиол имели место фибробластические фокусы. Были также обнаружены гипертрофия мышечной оболочки части терминальных бронхиол, лимфогистиоцитарная инфильтрация в стенках терминальных бронхиол. Таким образом, выявленные изменения свидетельствуют в пользу хронического бронхиолита и альвеоло-геморрагического синдрома (рис. 4).
Рисунок 4. Морфологическое исследование криобиоптата 2-го и 6-го сегментов левого легкого, окраска гематоксилином и эозином
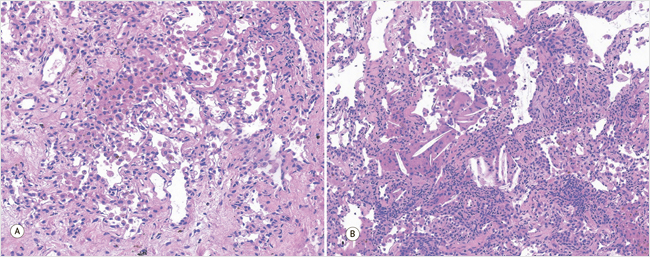
А – скопление сидерофагов; В – скопление гигантских многоядерных клеток с кристаллоидными включениями холестерина в просветах альвеол
A – accumulation of siderophages; B – accumulation of giant multinucleated cells with crystalloid inclusions of cholesterol in the lumen of the alveoli
С учетом выявленных клинических данных, лабораторноинструментальных данных, гистологической картины образцов легких у пациентки диагностирована «болезнь вейперов» (EVALI). Морфологическое заключение соответствует длительному (хронический бронхиолит, центрилобулярная эмфизема, гиперчувствительный пневмонит) и острому (диффузное альвеолярное кровоизлияние) повреждению легких, ассоциированному с вейпингом (EVALI).
Клинический случай 2
Пациентка 15 лет, ИМТ 24,1 кг/м2, c жалобами на редкий кашель, снижение толерантности к физическим нагрузкам, госпитализирована в стационар.
Из анамнеза заболевания известно, что в конце июля 2022 г. проходила стационарное лечение в педиатрическом отделении с диагнозом «пневмония легкой степени, рецидив простого герпеса, анемия 1-й степени»; выписана с рекомендациями приема препаратов железа.
В августе 2022 г. были эпизоды повышения температуры тела до 38,5 °C, проходящие спонтанно без приема антипиретиков. В крови выявлены высокие титры IgG к SARS-CoV2 4964 BAU/ml, отмечены в динамике колебания других показателей (гемоглобин 82–92 г/л, лейкоциты 8,3–11,8 х 109/л, тромбоциты 610–674 х 109/л, скорость оседания эритроцитов (СОЭ) 66–99 мм/ч; СРБ 118,6–170 мг/л). Выявленные изменения (двусторонние интерстициальные изменения) на КТ ОГК расценены в рамках вирусной инфекции COVID-19 с объемом поражения до 10%. С ноября 2022 г. у пациентки вновь отмечались эпизоды субфебрильной температуры (максимально до 37,8 °C), с декабря 2022 г. присоединились приступообразный кашель с отхождением слизистой мокроты, нарушение менструального цикла (менструация трижды за один месяц). В декабре 2022 г. проведена биопсия костного мозга. В миелограмме количество бластных клеток было в пределах нормы; немного расширен нейтрофильный росток с увеличением зрелых клеток и скорости их созревания; отмечалось увеличение количества моноцитов и лимфоцитов, резкое сужение эритроцитарного ростка; мегакариоциты в достаточном количестве были представлены зрелыми клетками. После консультации с онкологами и гематологами данных за онкологическое заболевание крови не получено.
Ревмоскрининг (ревматоидный фактор, антитела к двуспиральной ДНК, антитела к односпиральной ДНК, компонент комплемента С3, С4, HEp-2, антитела к гладкой мускулатуре, антитела к цитоплазме нейтрофилов, тест Кумбса прямой, уровень общих IgМ, IgG) не выявил патологии. Антитела IgG к аскаридам, IgG к цитомегаловирусу, IgG к вирусу Эпштейна – Барр, IgG к вирусу простого герпеса 6-го типа не обнаружены. Выявлены положительные антитела IgG к вирусу простого герпеса 1-го типа. Сывороточное железо было снижено до 3,65 ммоль/л; общая железосвязывающая способность сыворотки составила 42,25 мкмоль/л, латентная железосвязывающая способность сыворотки – 38,64 мкмоль/л, ферритин – 396 мкг/л. Гормональный профиль щитовидной железы (свободный трийодтиронин, тиреотропный гормон, антитела к тиреопероксидазе) в целом был в пределах референсных значений; отмечалось только минимальное изолированное повышение свободного тироксина (15,3 пмоль/л, норма до 14 пмоль/л).
В анализах крови сохранялись сниженные значения гемоглобина (86 г/л), тромбоцитоз (634 х 109/л), повышение СОЭ (99 мм/ч) и СРБ (120 мг/л). По результатам обследования осмотрена ревматологом, фтизиатром, данных за ревматологическую патологию и туберкулезный процесс не получено.
С января 2023 г. у пациентки появились жалобы на одышку при физической нагрузке, ежедневный кашель, общую слабость, эпизоды повышения температуры тела до 37,8 °С сохранялись. В начале апреля 2023 г. перенесла ветряную оспу. С конца апреля 2023 г. пациентка стала отмечать усиление кашля с отхождением слизистой мокроты, одышку при минимальной физической нагрузке, сердцебиение (ЧСС до 130/мин), снижение массы тела на 8 кг за 4 мес. В лабораторных анализах в динамике сохранялись сниженные значения гемоглобина – 99 г/л, тромбоцитоз – 599 х 109/л, повышенные значения СОЭ 36 мм/ч, СРБ – 93,7 мг/л. Антитела к ВИЧ 1, 2, поверхностному антигену вирусного гепатита B (HBsAg), к вирусу гепатита C (anti-HCV), IgG Bordetella pertussis не обнаружены. В мае 2023 г. на КТ ОГК определялись множественные сливающиеся диффузные зоны повышенной плотности по типу матового стекла; множественные тонкостенные полости с максимальным размером до 10 мм; центрилобулярные узелки преимущественно в нижних отделах легких; визуализировались овальные мягкотканые образования, в 6-м сегменте правого легкого диаметром до 10,4 мм, в 8-м сегменте левого легкого – до 7,7 мм; внутригрудная лимфаденопатия (лимфатические узлы 2–3-й групп с обеих сторон до 12 мм, 4–6-й групп – до 16 мм, 10-й группы – до 14 мм).
Пациентка амбулаторно была консультирована пульмонологом, рекомендованная небулайзерная терапия (ингаляционный глюкокортикостероид и бронхолитический препарат) была без эффекта.
В связи с развитием дыхательной недостаточности (ЧДД 40 в минуту, SpO2 – 77% на воздухе, в покое, на кислородотерапии 10 л/мин – 92%) пациентка была госпитализирована в ОАР. При сборе анамнеза жизни выяснено, что социально-бытовые условия удовлетворительные, домашних животных и птиц, аллергических реакций и сенсибилизации нет. Контакт с инфекционными больными не выявлен. С лета 2021 г. курила электронные сигареты, со слов пациентки, перестала курить с апреля 2023 г.
На очередной КТ ОГК отмечались признаки выраженных интерстициальных изменений легочной паренхимы с наличием множественных кистозных элементов во всех отделах легких, локальный участок уплотнения в 6-м сегменте правого легкого, лимфаденопатия средостения (рис. 5). По данным компьютерной бронхофонографии акустический компонент работы дыхания был в норме во всех частотных диапазонах, однако показатель аномально был мал в низкочастотном диапазоне, что соответствовало отеку ткани; выдох удлинен, проба с бронхолитиком положительная. Эзофагогастродуоденоскопия выявила признаки кандидоза пищевода I степени, катаральный рефлюкс-эзофагит, антральный умеренно выраженный гастрит, бульбит, дуоденогастральный рефлюкс. Проведены магнитно-резонансная томография головного мозга, диагностическая ректосигмоколоноскопия, ультразвуковая допплерография брахиоцефальных артерий, брюшной аорты и ее ветвей, эхокардиография сердца, ультразвуковое исследование органов гепатопанкреатобилиарной системы, желудка, кишечника, почек; патологии не выявлено.
Рисунок 5. КТ-картина интерстициальных изменений, множественных мелких полостей, очага уплотнения в 6-м сегменте правого легкого
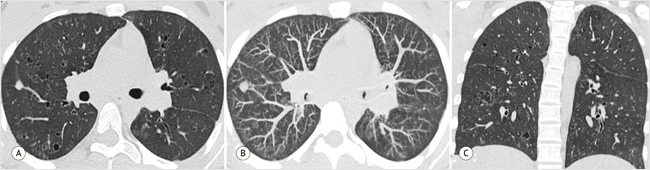
А – аксиальная плоскость, режим MPR; В – аксиальная плоскость, режим MIP; С – фронтальная плоскость, режим MPR. MIP (Maximum Intensity Projection) – режим максимальной интенсивности изображения
A – axial plane, MPR mode; B – axial plane, MIP mode; C – frontal plane, MPR mode. MPR – Multi-Planar Reconstruction mode. MIP – Maximum Intensity Projection mode
В лабораторных анализах крови: гемоглобин – 95 г/л, СОЭ – 19 мм/ч, СРБ – 97,8 мг/мл, железо сыворотки крови – 1,9 ммоль/л, повышение аланинаминотрансферазы – 129 ЕД/л, аспартатаминотрансферазы – 89 ЕД/л. Антитела IgМ, IgG к Chlamydophila pneumoniae, антиPR-3, антиМПО не обнаружены.
Проводилась противовоспалительная (дексаметазоном 16–8–4 мг/сут), антибактериальная и противогрибковая терапия, кислородотерапия с положительной клинической динамикой (регресс респираторной симптоматики, нормализация SpO2 – 96% на воздухе, в покое).
Проведен врачебный консилиум в составе врача-пульмонолога, аллерголога, ревматолога; данных за ревматологическую патологию не выявлено; рекомендована биопсия легкого. Выполнена торакоскопическая атипичная резекция левого легкого. В постоперационном периоде проводилась антибактериальная терапия, продолжалась терапия системными глюкокортикостероидами.
При гистологическом исследовании ткань легкого была на большем протяжении с тонкими межальвеолярными перегородками; местами – умеренно утолщенными за счет лимфоплазмоцитарной инфильтрации, местами – с примесью лейкоцитов, пролиферацией альвеолоцитов II типа; в просветах альвеол визуализировалось много макрофагов; респираторные бронхиолы местами сужены, щелевидные, с гипертрофией мышечной оболочки; в части респираторных и терминальных бронхиол — лимфоидная инфильтрация, местами – с примесью значительного числа плазмоцитов; единичные мегакариоциты в капиллярах межальвеолярных перегородок. В ткани легкого встречались множественные гигантские многоядерные клетки, в т. ч. с фагоцитированными клетками (аутофагия); единичные бронхиолоэктазы; фибробластические фокусы в стенках единичных бронхиол; подплевральные полости с фиброзными стенками и/или лимфоидной инфильтрацией. Таким образом, у пациентки морфологически верифицирована десквамативная интерстициальная пневмония, фолликулярный бронхиолит, бронхиолоэктазы (рис. 6).
Рисунок 6. Морфологическое исследование биоптата левого легкого, окраска гематоксилином и эозином
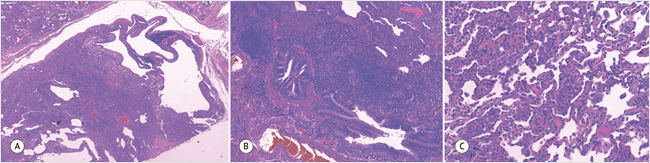
А – фолликулярный бронхиолит с образованием кистозных полостей; В – фолликулярный бронхиолит; С – десквамативная интерстициальная пневмония – в просветах альвеол скопление макрофагов, в т. ч. многоядерных
А – follicular bronchiolitis with formation of cystic cavities; B – follicular bronchiolitis; C – desquamative interstitial pneumonia – accumulation of macrophages, including multinucleated ones,
in the lumen of alveoli
Совокупность всех данных позволила определить у пациентки диагноз «болезнь вейперов» (EVALI). После комплексного лечения пациентка была выписана из стационара в удовлетворительном состоянии под динамическое наблюдение пульмонолога в поликлинике по месту жительства.
Обсуждение
Описанные случаи «болезни вейперов» (EVALI) представляют интерес ввиду сложности диагностики и многообразия клинических и рентгенологических проявлений. Это обусловлено разнообразием самих устройств, используемых для вейпинга.
Электронные сигареты – это устройства с батарейным типом питания, предназначенные для доставки аэрозольного никотина в дыхательные пути. Они состоят из батареи, нагревательного элемента и жидкого раствора, который обязательно содержит растворитель (пропиленгликоль или глицерин), подсластители, ароматизаторы и, как правило, никотин [2].
Выделяют несколько классификаций электронных сигарет: 1) по основным активным компонентам нагреваемой жидкости; 2) по поколениям устройств (табл. 1). Первое поколение устройств называется cig-a-likes – это одноразовые, не перезаряжаемые, имеющие ограниченный объем жидкости устройства, по размеру и форме напоминающие обычную сигарету [3]. Устройства второго поколения похожи на ручки с более мощной перезаряжаемой батареей с картриджами, которые можно заправлять жидкостью. Электронные сигареты третьего поколения (иногда называемые «модами») многоразовые, более крупные, позволяют пользователю управлять многими функциями, например мощностью устройства, температурой нагрева. Самая последняя версия электронных сигарет — это устройства на основе капсул, имеющие меньшие размеры по сравнению с устройствами предыдущего поколения, могут использовать как одноразовую, так и многоразовую капсулу, содержащую нагревательный элемент и жидкость, которая часто имеет более высокую концентрацию никотина, чем другие электронные сигареты. Общей особенностью устройств четвертого поколения является используемая жидкость – это раствор с более низким уровнем рН, состоящий из никотина, конъюгированного со слабым основанием (называемым солью никотина), который быстрее проникает в кровь [4, 5].
Таблица 1. Классификация электронных сигарет по основным активным веществам нагреваемой жидкости
| Основные виды | Активное вещество |
|---|---|
| I. Никотиновые электронные сигареты | Содержат никотин табачного происхождения или синтетический никотин |
| II. Электронные сигареты с каннабиноидами | Содержат в своем составе каннабиноиды |
| III. Другие электронные сигареты | Содержат другие активные ингредиенты: мелатонин, витамины, кофеин, эфирные масла и т. д. |
Несмотря на продолжающиеся исследования, точная причина(ы) и механизм(ы) EVALI остаются неясными.
Исследования вейп-аэрозолей позволили предположить наличие многочисленных провоспалительных эффектов на дыхательную систему. Было установлено, что они вызывают окислительный стресс в эпителиальных клетках легких [5], повреждение ДНК с нарушением ее восстановления, что соответствует потенциальному канцерогенному эффекту [6, 7].
По данным С. Matthew, хроническое вдыхание аэрозоля, образующегося при нагревании основных жидких компонентов электронных сигарет, таких как пропиленгликоль и растительный глицерин, может приводить к снижению иммунного статуса легких [8].
Ацетат витамина Е является распространенной добавкой к жидкостям для электронных сигарет, содержащих тетрагидроканнабинол или каннабидиол. Окончательный механизм, посредствам которого ацетат витамина Е может повреждать легкие, неясен, однако исследования показывают, что он нарушает функционирование легочного сурфактанта. Наличие именно этого вещества в жидкости для электронных сигарет связывают со вспышкой EVALI в 2019–2020 гг. в США [9].
Сами механические устройства электронных сигарет могут вызывать травмы и ожоги в результате взрыва литиевых батарей [10].
Термин EVALI впервые появился в 2019 г. в Штатах, где было зарегистрировано 2 807 случаев острого повреждения легких в результате использования электронных сигарет, в т. ч. 68 смертей [11, 12]. В том же году центры США по контролю и профилактике заболеваний опубликовали критерии подтвержденного и вероятного диагноза EVALI [1]. Подтвержденный случай включает наличие инфильтративных изменений на рентгенограмме грудной клетки или КТ, которые возникают в течение 90 дней после употребления электронных сигарет, с учетом отсутствия альтернативной причины их возникновения после медицинского обследования. При вероятном диагнозе EVALI минимальные критерии инфекционной диагностики соблюдены не полностью или выявлены положительные результаты тестов на инфекционные агенты, которые, по мнению лечащего врача, не объясняют выявленные изменения в легких (табл. 2).
Таблица 2. Критерии подтвержденных и вероятных случаев EVALI по определению центров США по контролю и профилактике заболеваний
| Подтвержденный диагноз: |
|---|
| Использование электронных сигарет в течение 90 дней до появления симптомов; + Инфильтративные изменения в легких на рентгенограмме грудной клетки или на КТ ОГК; + Отсутствие респираторной инфекции при первичном обследовании. Минимальными критериями являются: 1. Отрицательный анализ на COVID-19. 2. Отрицательный результат ПЦР или экспресс-теста на грипп. 3. Другие клинические исследования на респираторные инфекционные заболевания отрицательные (например, антиген крови на атипичных микровозбудителей, культуральное исследование мокроты, БАЛ, оппортунистические респираторные инфекции, связанные с ВИЧ). + Отсутствие данных в медицинской карте об альтернативных вероятных диагнозах (кардиологический, ревматологический или неопластический процесс) |
| Вероятный диагноз: |
| Использование электронных сигарет в течение 90 дней до появления симптомов. + Инфильтративные изменения в легких на рентгенограмме грудной клетки или на КТ грудной клетки. + Инфекция выявлена с помощью культурального исследования или ПЦР, но есть подозрения, что эта инфекция не является единственной причиной повреждения легких или минимальные критерии для исключения легочной инфекции не соблюдены. + Отсутствие данных в медицинской карте об альтернативных вероятных диагнозах (кардиологический, ревматологический или неопластический процесс) |
Примечание. БАЛ – бронхоальвеолярный лаваж; COVID-19 – новая коронавирусная инфекция; КТ – компьютерная томография; ВИЧ – вирус иммунодефицита человека; ПЦР – полимеразная цепная реакция.
По данным Е. Laura, начало EVALI носит острый или подострый характер, признаки заболевания могут появиться в течение как нескольких часов-дней, так и нескольких недель и даже месяцев [13, 14]. Основными клиническими симптомами были одышка, кашель, боль в груди, тахикардия, тошнота, рвота, диарея, боль в животе, лихорадка и общая слабость [15]. М. Cano Aguirre и С. Reynolds [16, 17] наблюдали случаи, когда ведущей жалобой пациента было кровохарканье. Большинство пациентов нуждались в стационарном лечение, 25% больных лечились в ОАР [18].
Результаты лабораторной диагностики обычно определяли лейкоцитоз с преобладанием нейтрофилов, повышение СОЭ, СРБ и печеночных трансаминаз [13, 18].
Рентгенологическая картина при EVALI неспецифична. Описаны различные варианты поражения легких, такие как организующаяся пневмония, диффузное альвеолярное повреждение, острая эозинофильная пневмония, диффузное альвеолярное кровоизлияние, гиперчувствительный пневмонит, экзогенная липоидная пневмония и гигантоклеточная интерстициальная пневмония [19, 20]. По данным Е. Meghan, наиболее часто встречающимся паттерном повреждения легких, наблюдаемым при EVALI, являлась организующаяся пневмония [1].
Для постановки диагноза биопсия легких раньше не требовалась, поэтому сведения о морфологических особенностях болезни отставали от клинико-рентгенологических данных. Гистопатологические исследования свидетельствовали об остром повреждении легких, включая острый фибринозный пневмонит, диффузное альвеолярное повреждение, организующуюся пневмонию, респираторный бронхиолит [1, 14, 21]. Специфических гистологических признаков вейпинга выявлено не было, однако Y. Butt et al. в большинстве морфологических препаратах обнаруживали пенистые макрофаги и чрезмерную вакуолизацию альвеолоцитов, что, по мнению авторов, может стать полезной диагностической подсказкой при соответствующей клинико-анамнестической картине [21]. S. Mukhopadhyay et al. описали случай смешанной гистологической картины острого повреждения легких, сочетающий организующуюся пневмонию и диффузное альвеолярное повреждение [22].
Решающее значение для клинического ведения пациентов с EVALI имеет прекращение употребления электронных сигарет. В целом лечение при развитии дыхательной недостаточности включает кислородотерапию, неинвазивную и инвазивную вентиляцию легких, реже экстракорпоральную мембранную оксигенацию [14]. У большинства пациентов с EVALI сообщалось о системном применении глюкокортикостероидов [13, 14]. В зависимости от клинической картины возможно применение антибактериальной терапии, противовирусных препаратов и другой симптоматической терапии [23].
Заключение
Таким образом, в первом описанном клиническом случае пациентка соответствовала всем критериям подтвержденного диагноза EVALI. Второй клинический случай соответствовал вероятному диагнозу EVALI ввиду несоблюдения минимальных критериев исключения легочных инфекций. У пациентки были положительные антитела к SARS-COV-2 и эпизод ветряной оспы. Совокупность данных в обоих случаях позволяет предположить не только острое повреждение легких (диффузное альвеолярное кровоизлияние), но и более отдаленные последствия (гиперчувствительный пневмонит, десквамативная интерстициальная пневмония, фолликулярный бронхиолит, хронический бронхиолит, бронхиолоэктазы, центрилобулярная эмфизема легких). Необходимы дальнейшие исследования для уточнения природы как острых, так и отдаленных последствий EVALI.
Список литературы / References
Развернуть
- Rebuli ME, Rose JJ, Noël A, Croft DP, Benowitz NL, Cohen AH et al. The E-cigarette or Vaping Product Use – Associated Lung Injury Epidemic: Pathogenesis, Management, and Future Directions. AnnalsAT S. 2023;20(1):1–17. Available at: https://www.atsjournals.org/.
- Banks E, Yazidjoglou A, Brown S, Nguyen M, Martin M, Beckwith K et al. Electronic cigarettes and health outcomes: umbrella and systematic review of the global evidence. Med J Aust. 2023;218(6):267–275. doi: 10.5694/mja2.51890.
- Gordon T, Karey E, Rebuli ME, Escobar YNH, Jaspers I, Chen LC. E-Cigarette Toxicology. Ann Rev Pharm Toxicol. 2022:62301–322. doi: 10.1146/annurev-pharmtox-042921-084202.
- Voos N, Goniewicz ML, Eissenberg T. What is the nicotine delivery profile of electronic cigarettes? Expert Opin Drug Deliv. 2019;16(11):1193–1203. doi: 10.1080/17425247.2019.1665647.
- Prochaska JJ, Vogel EA, Benowitz N. Nicotine delivery and cigarette equivalents from vaping a JUULpod. Tob Control. 2022;31(e1):e88-e93. doi: 10.1136/tobaccocontrol-2020-056367.
- Lerner CA, Sundar IK, Yao H, Gerloff J, Ossip DJ, McIntosh S et al. Vapors Produced by Electronic Cigarettes and E-Juices with Flavorings Induce Toxicity, Oxidative Stress, and Inflammatory Response in Lung Epithelial Cells and in Mouse Lung. PLoS ONE. 2015;10(2):1–26. doi: 10.1371/journal.pone.0116732.
- Leea HW, Parka SH, Wenga M, Wanga H, Huang WC, Leporb H et al. E-cigarette smoke damages DNA and reduces repair activity in mouse lung, heart, and bladder as well as in human lung and bladder cells. PNAS. 2018;115(7):E1560–E1569. doi: 10.1073/pnas.1718185115.
- Madison MC, Landers CT, Gu BH, Chang CY, Tung HY, You R et al. Electronic cigarettes disrupt lung lipid homeostasis and innate immunity independent of nicotine. J Clin Invest. 2019;129(10):4290–4304. doi: 10.1172/JCI128531.
- Blount BC, Karwowski MP, Morel-Espinosa M, Rees J, Sosnoff C, Cowan E et al. Evaluation of Bronchoalveolar Lavage Fluid from Patients in an Outbreak of E-cigarette, or Vaping, Product Use – Associated Lung Injury — 10 States, August-October 2019. MMWR Morb Mortal Wkly Rep. 2019;68(45):1040–1041. doi: 10.15585/mmwr.mm6845e2.
- Jones CD, Ho W, Gunn E, Widdowson D, Bahia H. E-cigarette burn injuries: Comprehensive review and management guidelines proposal. Burns. 2018;45(4):763–771. doi: 10.1016/j.burns.2018.09.015.
- Park JA, Crotty Alexander LE, Christiani DC. Vaping and Lung Inflammation and Injury. Annu Rev Physiol. 2022;84:611–629. doi: 10.1146/annurev-physiol-061121-040014.
- Marrocco A, Singh D, Christiani DC, Demokritou P. E-cigarette vaping associated acute lung injury (EVALI): state of science and future research needs. Crit Rev Toxicol. 2022;52(3):188–220. doi: 10.1080/10408444.2022.2082918.
- Crotty Alexander LE, Ware LB, Calfee CS, Callahan SJ. Eissenberg T, Farver C et al. E-cigarette or vaping product use-associated lung injury: Developing a research agenda. An NIH workshop report. Am J Respir Crit Care Med. 2020;202(6):795–802. doi: 10.1164/rccm.201912-2332WS.
- Smith ML, Gotway MB, Crotty Alexander LE, Hariri LP. Vaping-related lung injury. Virchows Arch. 2021;478(1):81–88. doi: 10.1007/s00428-020-02943-0.
- Layden JE, Ghinai I, Pray I, Kimball A, Layer M, Tenforde MW et al. Pulmonary illness related to e-cigarette use in Illinois and Wisconsin — final report. N Engl J Med. 2020;382(10):903–916. doi: 10.1056/NEJMoa1911614.
- Cano Aguirre MDP, Esperanza Barrios A, Martínez Muñiz F, Alonso Viteri S, Muñiz González F, Segoviano Mateo R, Algaba Calderón Á. Hemoptysis induced by vaping. Arch Bronconeumol. 2021;57(7):505–506. doi: 10.1016/j.arbr.2021.05.006.
- Reynolds C, Staples H. Hemoptysis in an adolescent with EVALI. Pediatr Pulmonol. 2022;57(11):2875–2876. doi: 10.1002/ppul.26090.
- Aberegg SK, Cirulis MM, Maddock SD, Freeman A, Keenan LM, Pirozzi CS et al. Clinical, Bronchoscopic, and Imaging Findings of e-Cigarette, or Vaping, Product Use – Associated Lung Injury Among Patients Treated at an Academic Medical Center. JAMA Netw Open. 2020;3(11):e2019176. doi: 10.1001/jamanetworkopen.2020.19176.
- Henry TS, Kligerman SJ, Raptis CA, Mann H, Sechrist JW, Kanne JP. Imaging Findings of Vaping-Associated Lung Injury. AJR Am J Roentgenol. 2020;214(3):498–505. doi: 10.2214/AJR.19.22251.
- Kligerman S, Raptis C, Larsen B, Henry TS, Caporale A, Tazelaar H et al. Radiologic, Pathologic, Clinical, and Physiologic Findings of Electronic Cigarette or Vaping Product Use-associated Lung Injury (EVALI): Evolving Knowledge and Remaining Questions. Radiology. 2020;294(3):491–505. doi: 10.1148/radiol.2020192585.
- Butt YM, Smith ML, Tazelaar HD, Vaszar LT, Swanson KL, Cecchini MJ, et al. Pathology of Vaping-Associated Lung Injury. N Engl J Med. 2019;381(18):1780–1781. doi: 10.1056/NEJMc1913069.
- Lung Biopsy Findings in Severe Pulmonary Illness Associated With E-Cigarette Use (Vaping). Am J Clin Pathol. 2020;153(1):30–39. doi: 10.1093/ajcp/aqz182.
- Jonas A. Impact of vaping on respiratory health. BMJ. 2022;378:e065997. doi: 10.1136/bmj-2021-065997.








