
Журнал "Медицинский совет" №12/2023
DOI: 10.21518/ms2023-204
А.В. Витебская, http://orcid.org/0000-0001-5689-0194
А.В. Попович, http://orcid.org/0000-0002-9660-8795
Е.Ю. Афонина, http://orcid.org/0000-0001-9643-5567
О.В. Батырева, http://orcid.org/0009-0006-7961-7004
Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет); 119435, Россия, Москва, ул. Большая Пироговская, д. 19
Гипергликемия - известный побочный эффект терапии глюкокортикоидами (ГК), которая может приводить к развитию стероидного сахарного диабета (СД). Пациентам, принимающим ГК, необходим контроль гликемии. Приводятся клинические случаи нарушений углеводного обмена (гипергликемии), требующие контроля гликемии у детей, принимающих ГК. В первом случае выявлена транзиторная гипергликемия натощак до 8,3 ммоль/л (при нормальных значениях после еды) в течение трех суток после начала пульс-терапии ГК по поводу бронхиальной астмы. Нормализация гликемии - с 4-х суток, несмотря на продолжавшуюся 6 дней терапию ГК. Во втором случае транзиторная гипергликемия на фоне пульс-терапии при юношеском артрите с системным началом выявлена на 3-и сутки (7,25 ммоль/л), добавлен таблетированный ГК, пульс-терапия с постепенным снижением дозы продолжена еще 9 дней. Гипергликемия (до 11,7 ммоль/л) персистировала 4 суток, затем отмечена нормализация гликемии, несмотря на продолжающуюся терапию ГК (50 мг или 0,7 мг/кг). В третьем случае стероидный СД у пациентки с ювенильной системной склеродермией, отягощенным семейным анамнезом по СД 2-го типа и ожирением манифестировал через 2 мес. приема таблетированного ГК (35 мг или 0,6 мг/кг), назначен метформин. При снижении дозы ГК отмечена тенденция к нормализации гликемии. Через 4 мес. после отмены ГК диагностирована нарушенная толерантность к глюкозе и инсулинорезистентность. Для пациентов, получающих ГК, необходим гликемический контроль. Гипергликемия при приеме ГК может быть как транзиторной, так и длительно персистирующей. Риск стероидного СД выше при наличии отягощенного семейного анамнеза, ожирения, при высоких дозах и длительной терапии ГК. У пациентов из групп риска СД 2-го типа возможно сохранение нарушений углеводного обмена после отмены ГК, что требует повторного обследования.
Для цитирования: Витебская А.В., Попович А.В., Афонина Е.Ю., Батырева О.В. Контроль гликемии у детей, получающих терапию глюкокортикоидами. Медицинский Совет. 2023;(12):68-74. https://doi.org/10.21518/ms2023-204
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Благодарности. Для контроля гликемии пациенты использовали глюкометры Контур Плюс и Контур Плюс Уан и тест-полоски к ним, предоставленные компанией ООО «Асцензия Диабетическая продукция».
Glycemic control in children receiving glucocorticoid therapy
Alisa V. Vitebskaya, http://orcid.org/0000-0001-5689-0194
Anastasia V. Popovich, http://orcid.org/0000-0002-9660-8795
Elena Yu. Afonina, http://orcid.org/0000-0001-9643-5567
Oksana V. Batyreva, http://orcid.org/0009-0006-7961-7004
Sechenov First Moscow State Medical University (Sechenov University); 19, Bolshaya Pirogovskaya St., Moscow, 119435, Russia
Hyperglycemia is a well-known side effect of glucocorticoid (GC) therapy. GC treatment can lead to steroid diabetes mellitus (DM) manifestation. Glycemic control is essential for patients receiving GC. Three clinical cases of carbohydrate metabolism impairment (hyperglycemia) in children receiving GC needing glycemic control were described. In the 1st case transient fasting hyperglycemia up to 8.3 mmol/l (while normal data after meals) was detected during 3 days after start of GC pulse-therapy of bronchial asthma. Normalization of glycaemia was evident since the 4th day in spite of GC therapy continuing for 6 days. In the 2nd case transient hyperglycemia while pulse-therapy of juvenile arthritis with systemic onset was detected on the 3rd day (7.25 mmol/l), GC in tablets was added, pulse-therapy with gradually dose reduction continued 9 days else. Hyperglycemia (up to 11.7 mmol/l) persisted for 4 days, then glycaemia normalization was detected in spite of continuing GC therapy (50 mg or 0.7 mg/kg). In the 3 rd case steroid DM in a patient with juvenile systemic scleroderma, familial history of DM type 2, and obesity manifested after 2 months of treatment with GC tablets (35 mg or 0.6 mg/kg), metformin was prescribed. While reduction of GC dose trend to glycaemia normalization was seen. In 4 months after cessation of GC impaired glucose tolerance and insulin resistance were diagnosed Glycemic control is essential for patients receiving GC. Hyperglycemia while receiving GC can be both transient or persistent. Risk of steroid DM is higher in cases of family history of DM type 2, obesity, high doses, and prolonged GC treatment. In patients at-risk of DM type 2 impairment of carbohydrate metabolism can persist after cessation of GC; this needs repeated examination.
For citation: Vitebskaya A.V., Popovich A.V., Afonina E.Yu., Batyreva O.V. Glycemic control in children receiving glucocorticoid therapy. Meditsinskiy sovet = Medical Council. 2023;(12):68-74. (In Russ.) https://doi.org/10.21518/ms2023-204
Conflict of interest: the authors declare no conflict of interest.
Acknowledgments. To control glycemia, patients used glucometers Contour Plus and Contour Plus One and test strips
for them, provided of charge by Ascension Diabetic Products LLC.
Введение
Гипергликемия относится к ожидаемым побочным эффектам терапии глюкокортикоидами (ГК), так как они стимулируют глюконеогенез в печени и влияют на механизмы формирования инсулинорезистентности, таким образом способствуя развитию нарушений углеводного обмена. Считается, что длительное воздействие ГК может приводить к дисфункции бета-клеток у генетически предрасположенных пациентов [1, 2].
Сахарный диабет (СД), развивающийся вследствие приема ГК, принято называть стероидным. Это состояние диагностируется на основании критериев, аналогичных для других типов СД [3, 4].
СД может существенно снижать качество жизни пациентов и утяжелять течение основного заболевания, по поводу которого проводится терапия ГК. В связи с этим необходимо активное выявление нарушений углеводного обмена у пациентов, получающих ГК. Важен контроль гликемии и при необходимости – подбор сахароснижающей терапии [5].
Далее приводятся клинические случаи нарушений углеводного обмена, требующие контроля гликемии у детей, принимающих ГК.
Клинический случай 1
Пациент с транзиторной гипергликемией на фоне пульс-терапии глюкокортикоидами
Пациент, юноша 13 лет, наблюдается пульмонологом по поводу бронхиальной астмы средней степени тяжести. В связи с обострением был госпитализирован в пульмонологическое отделение. После однократного внутривенного введения дексаметазона в дозе 12 мг в биохимическом анализе крови на следующее утро выявлена гипергликемия натощак 8,3 ммоль/л, в общем анализе мочи – аглюкозурия.
Впервые консультирован эндокринологом после получения результатов лабораторных исследований. При осмотре обращали на себя внимание небольшой избыток массы тела (рост 160,5 см (SDS (коэффициент стандартного отклонения: от –2,0 до +1,0 – норма, от +1,0 до +2,0 – избыток массы тела, выше +2,0 – ожирение) +0,5), масса тела 56,8 кг (ИМТ 22,1 кг/м2, SDS +1,3)) и неограниченное ежедневное потребление легкоусвояемых углеводов. Наследственный анамнез по СД не отягощен.
При повторном измерении гликемии на следующие сутки отмечена тенденция к нормализации гликемии. Внутривенное капельное введение дексаметазона продолжено в дозе 6 мг в вечернее время в течение следующих 6 суток, гликемия в пределах нормальных значений. На 3-й день госпитализации проведена проба с завтраком (нагрузка 7 хлебных единиц, что соответствует 70 г углеводов): гликемия натощак 6,1 моль/л, через 2 ч – 4,8 моль/л. При дальнейшем контроле гликемии все показатели были в норме, несмотря на продолжавшуюся инфузионную терапию (табл. 1).
С целью дифференциальной диагностики доклинической стадии СД 1-го типа и стероидного СД проведено исследование антител к бета-клеткам (0,33 Ед/мл), глутаматдекарбоксилазе (1,62 МЕ/мл), фосфотирозинфосфатазе (1,59 МЕ/мл) – все показатели в пределах нормы.
Таблица 1. Гликемические профили пациента 1 в стационаре
| День обследования | Значение гликемии, ммоль/л | |||||
| Перед завтраком | Перед вторым завтраком | Перед обедом | Перед полдником | Перед ужином | Перед сном | |
| 1* | 8,4 | – | – | – | – | – |
| 2** | 6,8 | – | – | – | – | – |
| 3** | 6,1 | 4,8 | 5,1 | 5,0 | 4,9 | 5,7 |
| 4** | 5,5 | 5,0 | 5,4 | 4,4 | 5,1 | 5,3 |
| 5** | 4,9 | – | – | – | – | – |
| 6** | 5,2 | – | – | – | – | – |
| 10*** | 5,3 | – | – | – | – | – |
* На следующий день после 12 мг дексаметазона.
** На следующий день после введения 6 мг дексаметазона.
*** Через 5 дней после прекращения введения глюкокортикоида.
Клинический случай 2
Пациент с транзиторной гипергликемией на фоне пульс-терапии и инициации таблетированной терапии глюкокортикоидами
Пациент, юноша 17 лет, был госпитализирован в детское ревматологическое отделение в связи с манифестацией юношеского артрита с системным началом. При поступлении гликемия 5,3 ммоль/л. Наследственность по СД не отягощена.
Через 3 суток пульс-терапии метилпреднизолоном в дозе 1000 мг/сут впервые в биохимическом анализе крови была выявлена гипергликемия 7,25 ммоль/л. В связи с этим пациенту было рекомендовано ограничить легкоусвояемые углеводы, измерять гликемию (перед основными приемами пищи и через 2 ч после них) и вести дневник.
На смартфон пациента было установлено мобильное приложение Contour Diabetes (Контур Диабитис), в котором фиксировались результаты измерения гликемии, проводимые сопряженным с ним глюкометром Контур Плюс Уан [1]. Использование данного приложения позволяет пациентам вести в смартфоне электронный дневник, вносить дополнительные сведения о количестве потребляемых углеводов, дозах инсулина, физической нагрузке, делать заметки о любых других значимых событиях. Пациент вносил в него сведения о приемах пищи (подсчет количества углеводов велся совместно с детским эндокринологом) и лекарственных препаратах (вместо инсулина указывались дозы ГК). В данном клиническом случае в приложении был установлен индивидуальный целевой диапазон, соответствующий нормальным значениям для здорового подростка (натощак – менее 6,1, после еды – менее 7,8 ммоль/л), и все результаты измерения гликемии, превышающие нормальные, автоматически окрашивались в дневнике в желтый цвет. Использование приложения позволило сформировать отчет о гликемии за 2 нед. наблюдения (рисунок).
Рисунок. Дневник гликемии пациента 2

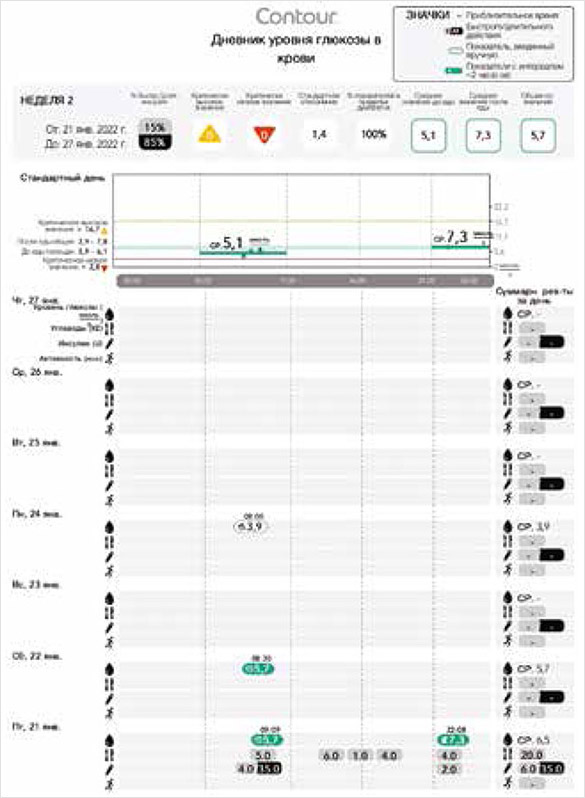
Несмотря на впервые выявленную гипергликемию, начат пероральный прием преднизолона 50 мг/сут, добавлена пульс-терапия дексаметазоном в начальной дозе 32 мг/сут с постепенным снижением вплоть до полной отмены через 9 дней. Пациент тщательно соблюдал диету с ограничением легкоусвояемых углеводов. На этом фоне в течение 4 суток сохранялись повышенные значения глюкозы (до 11,7 ммоль/л). Тенденция к нормализации гликемии отмечена с 5-го дня (на фоне перорального приема преднизолона 50 мг и внутривенного введения дексаметазона 18 мг), что было подтверждено при лабораторном исследовании глюкозы на 7-й день перед обедом (4,02 ммоль/л) и натощак на 11-й день (3,97 ммоль/л) (рисунок).
Пациент использовал отметки «натощак» (перечеркнутое яблоко), «перед едой» (целое яблоко), «после еды» (съеденное яблоко), в соответствии с которыми значения гликемии в пределах нормального диапазона (натощак – менее 6,1, после еды – менее 7,8 ммоль/л) автоматически окрашивались в зеленый цвет, а превышающие нормативные – в желтый. Результаты лабораторного исследования глюкозы крови (от 14, 20, 24 января) внесены в электронный дневник вручную, поэтому они не окрашены. Под значениями гликемии приведены дополнительные отметки потребляемого в течение дня количества углеводов в виде хлебных единиц (1 хлебная единица соответствует 10 г углеводов), под количеством углеводов – дозы ГК в течение соответствующего дня. Серым цветом окрашена доза внутривенного дексаметазона, черным – перорального преднизолона (с момента нормализации гликемии пациент перестал вносить данные о вечерней дозе) (рисунок).
При последующих лабораторных исследованиях вплоть до выписки из стационара гликемия сохранялась в пределах нормальных значений (5,00 – 3,62 – 4,30 – 4,30 – 3,94 – 3,90 ммоль/л).
В дальнейшем была инициирована биологическая терапия тоцилизумабом. Пациент был повторно обследован через 6 мес. на фоне постепенного снижения дозы ГК. Несмотря на соблюдаемые диетические ограничения, отмечена выраженная прибавка массы тела (16,5 кг). Однако гликемия соответствовала нормальным значениям (табл. 2).
Таблица 2. Динамика показателей у пациента 2 на фоне терапии глюкокортикоидами
| Возраст пациента | Длительность приема ГК, мес. | Рост, см | Масса тела, кг | ИМТ (SDS), кг/м2 | ГПН, ммоль/л при лабораторном исследовании | HbA1c, % | Доза ГК (в пересчете на преднизолон) на момент обследования, мг |
| 17 лет 4 мес. | 0 | 174 | 67,5 | 22,3 (+0,3) | 5,30 | – | – |
| 17 лет 10 мес. | 6 | 175 | 84 | 27,4 (+1,6) | 3,58 | 5,5 | 32,5* |
Примечание. ИМТ – индекс массы тела; SDS – коэффициент стандартного отклонения; ГПН – глюкоза плазмы натощак; HbA1c – гликированный гемоглобин; ГК – глюкокортикоиды.
* Максимальная доза с момента предыдущего обследования составила 50 мг.
Клинический случай 3
Пациентка со стероидным сахарным диабетом на терапии метформином
Пациентка, девушка 13 лет, наблюдается ревматологом по поводу ювенильной склеродермии с 7-летнего возраста. Длительное время для лечения применялись только местные средства, в 10 лет в связи с выраженным прогрессированием заболевания впервые назначен метотрексат, а с 11 лет 10 мес. – ГК в суточной дозе 35 мг или 0,6 мг/кг (в пересчете на преднизолон) (табл. 3).
Впервые проконсультирована детским эндокринологом через 2 мес. после начала терапии ГК. Выявлено, что наследственность отягощена по СД 2-го типа. Отмечена прибавка массы тела 6 кг, перераспределение подкожно-жировой клетчатки по кушингоидному типу. В биохимическом анализе крови впервые случайно выявлена гипергликемия 7,3 ммоль/л. При повторных лабораторных исследованиях гликемия натощак в пределах нормальных значений (4,8 – 4,8 – 5,3 ммоль/л), уровень гликированного гемоглобина (HbA1с) соответствовал верхней границе нормы (табл. 3). В связи с этим проводилось исследование гликемии с помощью глюкометра Контур Плюс, в послеобеденное время неоднократно выявлялась гипергликемия выше 11,1 ммоль/л (табл. 4), что было подтверждено лабораторно, на основании чего диагностирован стероидный СД [2].
После обследования начато постепенное снижение дозы ГК. Рекомендовано соблюдение диеты с ограничением легкоусвояемых углеводов, назначен метформин в дозе 500 мг 2 раза в сутки.
Через 6 мес. от начала терапии масса тела увеличилась еще на 5 кг. На фоне постепенного снижения дозы ГК до 5 мг/сут отмечено постепенное улучшение гликемического профиля, нормализация гликированного гемоглобина, прекращен прием метформина (табл. 3, 4).
Суммарная длительность терапии ГК составила 1 год. Пациентка прошла повторное эндокринологическое обследование через 4 мес. после прекращения приема ГК. Масса тела увеличилась еще на 2 кг, несмотря на отмену ГК; отмечено небольшое увеличение роста, за счет чего уменьшилась выраженность ожирения. Уменьшилось отложение подкожно-жировой клетчатки на лице и туловище, сохранялось перераспределение в абдоминальной области. Гликемия утром натощак была повышена до 6,8 ммоль/л (норма – менее 6,1 ммоль/л), в течение дня – в пределах нормальных значений (норма – менее 7,8 ммоль/л) [2]. По результатам перорального глюкозотолерантного теста (ПГТТ) выявлена нарушенная толерантность к глюкозе и выраженная инсулинорезистентность (табл. 3–5).
Таблица 3. Динамика показателей у пациентки 3 на фоне терапии глюкокортикоидами
| Возраст пациентки | Длительность приема ГК, мес. | Рост, см | Масса тела, кг | ИМТ (SDS), кг/м2 | ГПН, ммоль/л при лабораторном исследовании | HbA1c, % | Доза ГК (в пересчете на преднизолон) на момент обследования, мг |
| 11 лет 10 мес. | 0 | 158 | 57 | 22,8 (+1,6) | 5,1 | – | – |
| 12 лет 0 мес. | 2 | 158 | 63 | 25,2 (+2,0) | 4,8–7,3 | 6,0 | 35 |
| 12 лет 4 мес. | 6 | 158 | 68 | 27,2 (+2,3) | 5,9 | 5,8 | 5 |
| 13 лет 2 мес. | 4 после отмены ГК | 161 | 70,0 | 27,0 (+2,1) | 5,6-5,7 | 6,0 | – |
Примечание. ИМТ – индекс массы тела; SDS – коэффициент стандартного отклонения; ГПН – глюкоза плазмы натощак; HbA1c – гликированный гемоглобин; ГК – глюкокортикоиды.
Таблица 4. Гликемические профили пациентки 3 в стационаре
| День обследования | Значение гликемии, ммоль/л | |||||
| Перед завтраком | Перед вторым завтраком | Перед обедом | Перед полдником | Перед ужином | Перед сном | |
| Через 3 месяца терапии глюкокортикоидами (35 мг) | ||||||
| 1 | – | – | – | 12,5* | 13,5* | 7,1 |
| 2 | 6,4 | 7,4 | 8,5 | 13,4* | 8,5 | 11,4* |
| 3 | 5,6 | 8,4 | – | 13,8* | 12,6* | 5,7 |
| 4 | 6,2 | 4,2 | 7,3 | 10,3 | 10,3 | 6,9 |
| 5 | 6,7 | 6,0 | – | 8,4 | 10,2 | 5,9 |
| 6 | 5,1 | 7,1 | – | 10,0 | 9,0 | 5,1 |
| 7 | 7,1* | 7,4 | 7,0 | – | – | – |
| Через 6 месяцев терапии глюкокортикоидами (5 мг) | ||||||
| 1 | – | – | 6,3 | 8,6 | 5,4 | 6,7 |
| 2 | 6,3 | 8,0 | 6,1 | 7,9 | 6,3 | 8,2 |
| 3 | 6,7 | 8,7 | – | 8,2 | 6,0 | 7,1 |
| 4 | 5,3 | 8,3 | 5,9 | – | – | – |
| Через 4 месяца после отмены глюкокортикоидами (1 год 3 месяца от начала терапии) | ||||||
| 1 | – | 6,9 | 5,5 | 6,2 | 6,9 | 7,5 |
| 2 | 6,7 | 5,4 | 6,6 | 6,3 | 7,3 | 6,7 |
| 3 | 6,8 | 5,8 | 5,8 | 5,2 | 5,9 | 5,4 |
| 4 | 6,4 | 6,4 | 7,3 | 6,2 | 7,7 | 7,7 |
| 5 | 5,9 | 6,8 | 6,8 | 5,7 | 6,0 | 5,9 |
* Сахарный диабет может быть диагностирован при гипергликемии натощак (7,0 ммоль/л и более) или случайном выявлении уровня глюкозы 11,1 ммоль/л и более [2].
Таблица 5. Пероральный глюкозотолерантный тест пациентки 3 через 4 месяца после отмены глюкокортикоидов
| Время, мин | Глюкоза, ммоль/л | Инсулин, мкМЕ/мл |
| 0 | 5,75 | 37,9 |
| 120 | 8,0* | Более 300 |
* Через 2 ч после приема раствора 75 г глюкозы уровень гликемии более 7,8, но менее 11,1 ммоль/л расценивается как нарушенная толерантность к глюкозе [2].
Обсуждение
Несмотря на активное внедрение в клиническую практику современной биологической терапии, ГК продолжают применяться в лечении аутоиммунных и аутовоспалительных заболеваний. Применение ГК приводит к ятрогенному гиперкортицизму или медикаментозному синдрому Иценко – Кушинга. К ведущим эндокринологическим проявлениям данного состояния относятся выраженная прибавка массы тела с перераспределением подкожно-жировой клетчатки по кушингоидному типу (избыточное отложение на лице, туловище, в области 7-го шейного позвонка), соматогенная задержка роста, метаболические нарушения (гипергликемия, гипокалиемия, остеопороз) [5, 6].
Разработаны диетические рекомендации для пациентов, принимающих ГК, с целью минимизации нежелательных явлений со стороны костной и мышечной ткани (оптимизация потребления кальция, витамина D, белка), массы тела, липидного и углеводного обмена (увеличение доли необработанной или минимально обработанной пищи в рационе, снижение калорийности), сердечно-сосудистой и мочевыделительной системы (потребление адекватного количества калия и натрия) [7]. Однако, как следует из приведенных клинических примеров, далеко не все пациенты соблюдают эти рекомендации.
Согласно современной классификации, стероидный СД относится к категории III – другие специфические типы диабета к подгруппе E – СД, индуцированный лекарственными препаратами или химическими веществами. Для диагностики этого состояния используют критерии, общепринятые для других типов СД:
– гипергликемия натощак (7,0 ммоль/л и более);
– случайно выявленная гипергликемия независимо от приема пищи (11,1 ммоль/л и более);
– высокие значения гликемии при проведении ПГТТ (11,1 ммоль/л и более через 2 ч после приема 75 г глюкозы);
– уровень HbA1c 6,5% и более [3, 4].
У всех описываемых пациентов отмечались эпизоды гипергликемии, соответствующие критериям диагностики СД.
При оценке тяжести состояния и принятии решения о назначении лечения СД необходимо учитывать целевые значения гликемии для детей и подростков с СД: 4,0–7,0 ммоль/л натощак, 5,0–10,0 через 2 ч после еды и 4,4–7,8 ммоль/л перед сном и ночью. Следует отметить, что данные целевые значения используются независимо от типа диабета и, следовательно, применимы и при стероидном СД [4, 8].
В клиническом примере 1 гликемия натощак лишь при первом измерении превышала целевые значения, а на 2-е и 3-е сутки соответствовала им (табл. 1). В дальнейшем отмечена спонтанная нормализация гликемии, несмотря на продолжавшуюся пульс-терапию ГК. Проводившийся контроль гликемии позволил не только зафиксировать гипергликемию, но и продемонстрировать безопасность применения ГК, отсутствие потребности в сахароснижающей терапии.
В 2018 г. Объединенные британские диабетические ассоциации (Joint British Diabetes Societies) опубликовали рекомендации по ведению пациентов с гипергликемией на фоне терапии ГК. Согласно данному документу, пациентам, принимающим ГК, следует измерять гликемию по крайней мере 1 раз в день. При гликемии ниже 12 ммоль/л – продолжать измерения 1 раз в день после завтрака или обеда, при более высоких значениях – переходить на 4-разовое измерение гликемии (перед основными приемами пищи и перед сном). При повторном выявлении гликемии выше 12 ммоль/л в течение 1 суток назначается терапия [9].
В клиническом примере 2 ГК вводились не только в качестве пульс-терапии, но и в таблетированном виде, причем в значительных дозах. Показатели гликемии натощак и после приема пищи в первые несколько суток соответствовали критериям СД. Измерение гликемии с помощью глюкометра Контур Плюс Уан 6 раз в сутки (перед основными приемами пищи и через 2 ч после еды) и использование мобильного приложения Контур Диабитис позволили сформировать отчет, в котором наглядно (желтым цветом) отмечены все значения, превышающие целевые (в данном случае это показатели, превышающие нормальные для пациента без СД). Однако лишь некоторые из них на 1–3 ммоль/л превышают целевые значения для пациентов с СД [4, 8], что позволило воздержаться от назначения сахароснижающей терапии [9]. По дневнику также видно, что нормализация гликемии (значения окрашены зеленым) отмечена на 5-е сутки (рисунок).
Необходимо подчеркнуть значение приверженности пациента к выполнению врачебных рекомендаций. В данном клиническом примере пациент строго соблюдал диету и вел дневник. Учитывая отсутствие предшествующих нарушений углеводного обмена, он не обладал знаниями по контролю гликемии, однако ведение дневника в мобильном приложении существенно облегчило оценку показателей как для пациента, так и для врача. Результаты измерения гликемии автоматически фиксировались в приложении, цветовая индикация демонстрировала соответствие или несоответствие показателей целевому диапазону. Именно такой формат контроля гликемии может быть рекомендован пациентам с транзиторной гипергликемией как в стационаре, так и в амбулаторных условиях, так как позволяет объективно оценивать тяжесть состояния и при необходимости принимать решение о назначении сахароснижающей терапии.
В клиническом примере 3 зафиксирована длительно сохраняющаяся гипергликемия на терапии ГК, в результате чего был диагностирован стероидный СД. К факторам риска развития СД на фоне применения ГК относят отягощенный семейный анамнез по СД 2-го типа, наличие ожирения и предшествующих нарушений углеводного обмена, дозу и длительность применения ГК [5, 9]. Интересно отметить, что именно у 3-й пациентки семейный анамнез был отягощен по СД 2-го типа, а на момент инициации терапии ГК был избыток массы тела, быстро прогрессировавший до ожирения (табл. 3). Стероидный СД манифестировал на фоне несоблюдения диеты и выраженной прибавки массы тела. Кроме того, пациентка длительное время получала ГК в относительно большой дозе.
Согласно литературным данным, при сохраняющейся гипергликемии на фоне длительной терапии ГК могут применяться сахароснижающие препараты, среди которых в педиатрической практике разрешено использование метформина и инсулина [10]. Пациентке 3 был рекомендован прием метформина, который она получала амбулаторно. Тенденция к нормализации гликемии отмечена при снижении дозы ГК до 5 мг. И к моменту поступления в стационар через 6 мес. после начала приема ГК применение метформина уже не было актуально.
Для стероидного СД типична нормализация гликемии при снижении доз или прекращении терапии ГК. Однако в некоторых случаях могут сохраняться нарушения углеводного обмена. Считается, что эту группу составляют пациенты с предрасположенностью к СД 2-го типа, у которых прием ГК сыграл роль триггера в развитии заболевания. Для повторной диагностики нарушений углеводного обмена рекомендуется измерение глюкозы плазмы натощак и проведение ПГТТ через 6 нед. после прекращения терапии [1, 9].
Результаты проведенного обследования пациентки 3 через 4 мес. после прекращения терапии ГК подтвердили наличие у нее преддиабета и инсулинорезистентности. Мы можем предположить, что причиной персистирования нарушения углеводного обмена у нашей пациентки являются отягощенная наследственность и наличие ожирения. В связи с ожирением, осложненным нарушением углеводного обмена, девочке показано дальнейшее наблюдение детским эндокринологом.
Заключение
Описанные клинические случаи демонстрируют важность контроля гликемии у детей, получающих ГК для лечения аутоиммунных и аутовоспалительных заболеваний. Гипергликемия при приеме ГК может быть как транзиторной, так и длительно персистирующей. Риск стероидного СД выше при наличии отягощенного семейного анамнеза и ожирения, при высоких дозах и длительном приеме ГК. Снижении дозы или отмена ГК при стероидном СД приводит к нормализации гликемии. У пациентов из групп риска СД 2-го типа возможно сохранение нарушений углеводного обмена после отмены ГК, что требует повторного обследования.
[1] РУ №ФСЗ 2008/02237 от 18.12.2018 г., №РЗН 2015/2584 от 17.12.2018 г.
Список литературы / References
- Drucis M., Irga-Jaworska N., Mysliwiec M. Steroid-induced diabetes in the paediatric population. Pediatr Endocrinol Diabetes Metab. 2018;24(3):136-139. https://doi.org/10.5114/pedm.2018.80995.
- Hwang J.L., Weiss R.E. Steroid-induced diabetes: a clinical and molecular approach to understanding and treatment. Diabetes Metab Res Rev. 2014;30(2):96-102. https://doi.org/https//doi.org/10.1002/dmrr.2486.
- Mayer-Davis E.J., Kahkoska A.R., Jefferies C., Dabelea D., Balde N., Gong C.X. et al. ISPAD Clinical Practice Consensus Guidelines 2018: Definition, epidemiology, and classification of diabetes in children and adolescents. Pediatr Diabetes. 2018;19(Suppl. 27)7-19. https://doi.org/https//doi.org/10.1111/pedi.12773.
- Дедов И.И., Шестакова М.В., Майоров А.Ю. (ред.). Алгоритмы специализированной медицинской помощи больным сахарным диабетом. 10-й вып. Сахарный диабет. 2021;24(1S):1-148. https://doi.org/10.14341/DM12802.
- Bonaventura A., Montecucco F. Steroid-induced hyperglycemia: An under-diagnosed problem or clinical inertia? A narrative review. Diabetes Res Clin Pract. 2018;139:203-220. https://doi.org/10.1016/j.diabres.2018.03.006.
- Lodish M.B., Keil M.F., Stratakis C.A. Cushing's Syndrome in Pediatrics: An Update. Endocrinol Metab Clin North Am. 2018;47(2):451-462. https://doi.org/10.1016/j.ecl.2018.02.008.
- Esteves G.P., Mazzolani B.C., Smaira F.I., Mendes E.S., de Oliveira G.G., Roschel H. et al. et al. Nutritional recommendations for patients undergoing prolonged glucocorticoid therapy. Rheumatol Adv Pract. 2022;6(2):rkac029. https://doi.org/10.1093/rap/rkac029.
- DiMeglio L.A., Acerini C.L., Codner E., Craig M.E., Hofer S.E., Pillay K., Maahs D.M. ISPAD Clinical Practice Consensus Guidelines 2018: Glycemic control targets and glucose monitoring for children, adolescents, and young adults with diabetes. Pediatr Diabetes. 2018;19(Suppl. 27):105-114. https://doi.org/10.1111/pedi.12737.
- Roberts A., James J., Dhatariya K. Management of hyperglycaemia and steroid (glucocorticoid) therapy: a guideline from the Joint British Diabetes Societies (JBDS) for Inpatient Care group. Diabet Med. 2018;35(8):1011-1017. https://doi.org/10.1111/dme.13675.
- Wallace M.D., Metzger N.L. Optimizing the Treatment of Steroid-Induced Hyperglycemia. Ann Pharmacother. 2018;52(1):86-90. https://doi.org/10.1177/1060028017728297.








