Журнал "Медицинский совет" №19/2024
DOI: 10.21518/ms2024-360
Н.Л. Гуревич1,2, ORCID: 0000-0002-8309-2398
Т.М. Черкасова1, ORCID: 0000-0001-6841-7134
А.Б. Казанина1, ORCID: 0009-0006-2320-4964
К.Д. Видершпан2
1 Алтайский государственный медицинский университет; 656038, Россия, Барнаул, проспект Ленина, д. 40
2 Алтайский краевой клинический центр охраны материнства и детства; 656019, Россия, Барнаул, ул. Гущина, 179
Болезнь Бурневилля – Прингла (туберозный склероз) – мультисистемное, генетически детерминированное заболевание, манифестирующее преимущественно в детском возрасте и проявляющееся образованием в различных органах и тканях доброкачественных новообразований (гамартом). Туберозный склероз относится к редким (орфанным) заболеваниям. Распространенность туберозного склероза среди новорожденных варьирует от 1 : 6000 до 1 : 10000. Наследуется данная патология по аутосомно-доминантному типу. В статье представлен анализ клинического случая новорожденного ребенка с туберозным склерозом, особенностью которого является диагностика заболевания в ходе пренатального ультразвукового скрининга в третьем триместре с выявлением множественных объемных образований головного мозга и сердца плода. Подтверждение диагноза в раннем неонатальном периоде основано на наличии первичных (больших) диагностических критериев: множественные рабдомиомы сердца, туберы головного мозга и гамартомы сетчатки. Диагноз был выставлен преимущественно на основании данных эхографических методов исследования, которые продемонстрировали свою эффективность в выявлении типичных признаков данного заболевания в перинатальном периоде. Врачи-неонатологи должны быть насторожены в отношении детей с рабдомиомами сердца, выявляемыми пренатально, в связи с тем, что данная опухоль сердца с высокой вероятностью сочетается с туберозным склерозом и является его диагностическим маркером. Помимо поражения сердца ранний дебют заболевания в перинатальном и постнатальном периодах проявляется в поражении ЦНС. Пациентам с туберозным склерозом требуется пожизненное наблюдение с первых дней жизни мультидисциплинарной команды специалистов с особым вниманием к жизнеугрожающим осложнениям (прогрессирующая гидроцефалия, эпилептический статус, почечная недостаточность, дыхательная недостаточность). Ведение пациента с такой патологией является сложной мультидисциплинарной проблемой.
Для цитирования: Гуревич НЛ, Черкасова ТМ, Казанина АБ, Видершпан КД. Клиническое наблюдение новорожденного ребенка с туберозным склерозом. Медицинский совет. 2024;18(19):30–37. https://doi.org/10.21518/ms2024-360.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Согласие пациентов на публикацию: пациент подписал информированное согласие на публикацию своих данных.
Clinical case of a newborn with tuberous sclerosis
Natalia L. Gurevich1,2, ORCID: 0000-0002-8309-2398
Tatiana M. Cherkasova1, ORCID: 0000-0001-6841-7134
Anastasia B. Kazanina1, ORCID: 0009-0006-2320-4964
Ksenia D. Vidershpan2
1 Altai State Medical University; 40, Lenin Ave., Barnaul, 656038, Russia
2 Altai Regional Clinical Center for the Protection of Motherhood and Childhood; 179, Gushchin St., Barnaul, 656019, Russia
Bourneville-Pringle disease or tuberous sclerosis is a multisystem, genetically determined disease that manifests mainly in childhood and is manifested by the formation of benign neoplasms (hamartomas) in various organs and tissues. Tuberous sclerosis is a rare (orphan) disease. The prevalence of tuberous sclerosis among newborns ranges from 1:6000 to 1:10000. Tuberous sclerosis is inherited in an autosomal dominant manner. An analysis of a clinical case of a newborn child with tuberous sclerosis (Bourneville-Pringle disease) is presented. The peculiarity of the presented observation is the diagnosis of the disease during prenatal ultrasound screening in the third trimester with the identification of multiple space-occupying formations in the brain and heart of the fetus. Confirmation of the diagnosis in the early neonatal period is based on the presence of primary (major) diagnostic criteria: multiple cardiac rhabdomyomas, brain tubera and retinal hamartomas. The diagnosis was made primarily on the basis of data from echographic research methods, which have demonstrated their effectiveness in identifying typical signs of this disease in the perinatal period. Neonatologists should be wary of children with cardiac radbomyomas detected prenatally, due to the fact that this cardiac tumor is highly likely to be combined with tuberous sclerosis and is its diagnostic marker. In addition to heart damage, the early onset of the disease in the perinatal and postnatal periods manifests itself in damage to the central nervous system. Patients with tuberous sclerosis require lifelong monitoring from the first days of life by a multidisciplinary team of specialists with special attention to life-threatening complications (progressive hydrocephalus, status epilepticus, renal failure, respiratory failure). Managing a patient with this pathology is a complex multidisciplinary problem.
For citation: Gurevich NL, Cherkasova TM, Kazanina AB, Vidershpan KD. Clinical case of a newborn with tuberous sclerosis. Meditsinskiy Sovet. 2024;18(19):30–37. (In Russ.) https://doi.org/10.21518/ms2024-360.
Conflict of interest: the authors declare no conflict of interest.
Basic patient privacy consent: patient signed informed consent regarding publishing their data.
Введение
Туберозный склероз (ТС) – это генетически обусловленное заболевание из группы факоматозов с полиморфной клинической картиной, характеризующееся формированием доброкачественных опухолей (гамартом) в различных органах и системах, включая кожу, центральную нервную систему, сердце, легкие и почки [1].
ТС представляет собой редкое заболевание с частотой в популяции – 1 : 10 000, а в период новорожденности – 1 : 6000 [1, 2]. Широкий спектр клинических симптомов не всегда позволяет заподозрить это заболевание, особенно в связи с низкой частотой встречаемости в практической деятельности врача-неонатолога и отсутствием настороженности, а также недостаточным обследованием пациентов [1, 3].
Диагностика ТС основывается на выявлении клинических и генетических маркеров. Наличие мутаций в локусах TSC1 и TSC2 признается главнейшим этиологическим фактором данного заболевания. Согласно «Федеральным клиническим рекомендациям по диагностике и лечению туберозного склероза» все клинические признаки делятся на 11 первичных (больших) и 6 вторичных (малых). Первичные признаки представлены специфическими кожными проявлениями (не менее 3 ангиофибром лица или фиброзных бляшек на лбу; не менее 3 гипопигментных пятен размером более 5 мм; участок «шагреневой кожи»), поражениями ЦНС в виде кортикальных дисплазий (туберов, миграционных трактов), субэпендимальных узлов (СЭУ), субэпендимальной гигантоклеточной астроцитомы (СЭГА), а также гамартомы сетчатки, рабдомиомы сердца, множественных ангиомиолипом почек, лимфангиолейомиоматоза легких. Вторичные признаки включают пятна «конфетти» на коже, углубления эмали зубов, фибромы полости рта, ахроматический участок сетчатки глаза, множественные кисты почек, гамартомы внутренних органов. Диагноз ТС выставляется лечащим врачом по совокупности двух первичных или одного первичного и двух и более вторичных признаков [1, 4, 5].
В литературе описаны случаи ТС у детей раннего возраста. Цель этого исследования состоит в том, чтобы сообщить о случае ранней диагностики ТС в перинатальном периоде. Наблюдение и обследование пациента проводилось в перинатальном центре третьего уровня.
Клинический случай
Новорожденный Ш. родился на сроке 39/1 нед. от первой беременности первых родов. Матери 21 год, брак зарегистрирован, семья проживает в труднодоступном и малонаселенном районе. Семейный анамнез не отягощен, случаи врожденных аномалии, пороков развития и уродств женщина отрицала. Соматические заболевания матери: вегетососудистая дистония по гипотоническому типу и железодефицитная анемия I степени. С 29-й нед. беременности был диагностирован гестационный сахарный диабет, компенсированный диетой. Во время беременности проводились ультразвуковые исследования в скрининговые сроки согласно приказу Министерства здравоохранения РФ от 20.10.2020 № 1130н «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология»». Во время 3-го скринингового ультразвукового исследования (срок гестации 31/3 нед.) у плода обнаружены множественные объемные образования головного мозга и сердца без признаков нарушения гемодинамики. В рамках перинатального консилиума женщина проконсультирована в ФГБУ «НМИЦ имени академика Е.Н. Мешалкина». По заключению сердечно-сосудистого хирурга прогноз на пренатальном этапе определить не представлялось возможным. Нейрохирургом было рекомендовано проведение МРТ головного мозга с контрастным усилением после родоразрешения.
Роды срочные, через естественные родовые пути, физиологические. Безводный промежуток составил 35 мин, околоплодные воды светлые. Ребенок родился с массой 3130 г и длиной тела 53 см, окружность головы 35 см, что соответствует долженствующим значениям антропометрических параметров в 39/1 нед. гестации. Оценка по шкале Апгар – 6/8 баллов. После рождения состояние ребенка оценивалось как тяжелое в связи с выявленными антенатально множественными объемными образованиями головного мозга и сердца. При осмотре кожные покровы розовые, цианоз носогубного треугольника. В левой локтевой области и подмышечной впадине имелись три гипопигментированных участка кожи, диаметром 0,5 см. Родовая конфигурация головы, большой родничок 3 × 3 см. Отмечалось снижение мышечного тонуса, нестойкость физиологических рефлексов. В легких дыхание равномерное, хрипы не выслушивались, частота дыханий 44 в мин. Пульсовая волна на верхних и нижних конечностях удовлетворительная. Тоны сердца ясные, ритмичные, частота сердечных сокращений 134 удара в мин, короткий систолический шум по левому краю грудины, без иррадиации за пределы сердца. Живот мягкий, безболезненный, печень и селезенка не увеличены. Половые органы сформированы по мужскому типу, яички опущены в мошонку, анус есть. Пищевод проходим. Предварительный диагноз «множественные объемные образования головного мозга и сердца (рабдомиомы). Доношенный к сроку гестации 39/1 нед.». В условиях транспортного кувеза новорожденный был переведен в отделение реанимации и интенсивной терапии. Проведенные лабораторные исследования в первые сутки жизни представлены в табл. 1, 2.
Таблица 1. Показатели клинического анализа крови
| Сут. жизни | Гемоглобин, г/л | Эритроциты, 1012/л | Лейкоциты, 109/л | П, % | Э, % | С, % | Л, % | М, % | Tr, 109/л | Рет, % |
|---|---|---|---|---|---|---|---|---|---|---|
| 1-е | 190 | 5,17 | 7,99 | - | 2 | 59 | 29 | 10 | 175 | 1 |
| 3-и | 199 | 5,32 | 10,7 | - | 4 | 48 | 39 | 9 | 173 | 1 |
| 7-е | 179 | 4,89 | 10,8 | - | 1 | 26 | 66 | 7 | 277 | 1 |
Таблица 2. Показатели биохимического анализа крови
| Сут. жизни | Общий белок, г/л | Глюкоза, ммоль/л | Мочевина, ммоль/л | Креатинин, мкмоль/л | Калий, ммоль/л | Натрий, ммоль/л | Кальций, ммоль/л | Общий билирубин, ммоль/л | Прямой | АЛТ / АСТ |
|---|---|---|---|---|---|---|---|---|---|---|
| 1-е | 47,3 | 3,37 | 3,05 | 74,7 | 4,60 | 135,1 | - | 41,9 | 7,6 | 21,7 / 126,3 |
| 3-и | 52,4 | 3,0 | - | 76,8 | - | 140,3 | 2,45 | 268,7 | 10,5 | 22,4 / 125,7 |
| 7-е | 44,4 | 2,10 | 64,8 | 5,04 | 136,9 | 2,43 | 257,9 | 13,6 | 19,4 / 50,4 |
СРБ: 1-е сут. жизни – 6,60 мг/л; 3-и сут. жизни – 5,74мг/л; 7-е сут. жизни – 0,59 мг/л.
Серологические исследования крови на внутриутробные инфекции на 6-е сут. жизни: ПЦР ДНК EBV; ЦМВ; ВПГ не обнаружены; ИФА toxo отрицательно; ИФА ЦМВ отрицательно; ИФА ВПГ IgM отрицательно, IgG копий клеток – 14,91, индекс авидности – 80,42%. Посев крови на флору – роста нет.
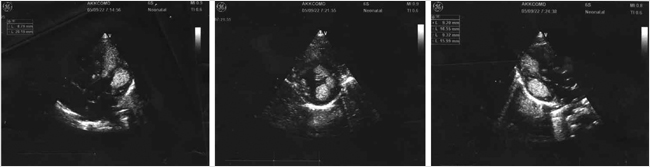
Инструментальные методы исследования в первые дни жизни. Эхокардиография: в полости левого желудочка (ЛЖ) по боковой стенке и области верхушки лоцируются множественные объемные образования размерами 17 × 7 × 10 и 12,7 × 8 мм, а также 8,6 × 6,8 мм в толще межжелудочковой перегородки (МЖП) без признаков внутрижелудочковой обструкции. Размеры и показатели общей сократимости ЛЖ в пределах нормы, фракция выброса (ФВ) 69%. Заключение: «Рабдомиомы сердца» (рис. 1).
Рисунок 1. Рабдомиомы сердца
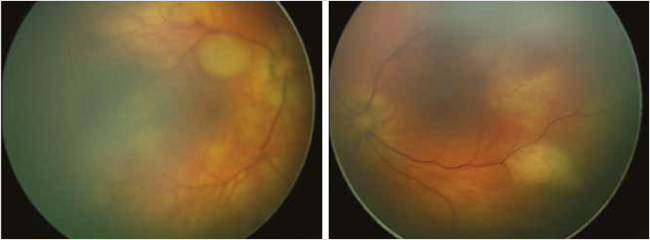
Нейросонография: визуализируются множественные очаговые образования в проекции боковых желудочков головного мозга с повышением эхогенности в перивентрикулярной области. По данным ультразвукового исследования (УЗИ) внутренних органов выявлены: деформация желчного пузыря, двухсторонняя пиелоэктазия, повышение эхогенности паренхимы и синусов обеих почек. По данным обзорной рентгенографии органов грудной клетки и брюшной полости патологических признаков не обнаружено. Состояние ребенка в динамике оценивалось как стабильное, в респираторной поддержке не нуждался и на 2-е сут. жизни для последующего обследования и наблюдения был переведен в отделение патологии новорожденных и недоношенных детей. Ребенок был осмотрен узкими специалистами. Кардиологом был выставлен диагноз «Множественные рабдомиомы левого и правого желудочка, МЖП без обструкции выходного отдела, НК 0 ст.». При осмотре глазного дна врачом-офтальмологом был выявлен еще один первичный (большой) признак туберозного склероза: ватообразные очаги по всей поверхности сетчатки – гамартомы сетчатки OU (рис. 2).
Рисунок 2. Гамартома сетчатки
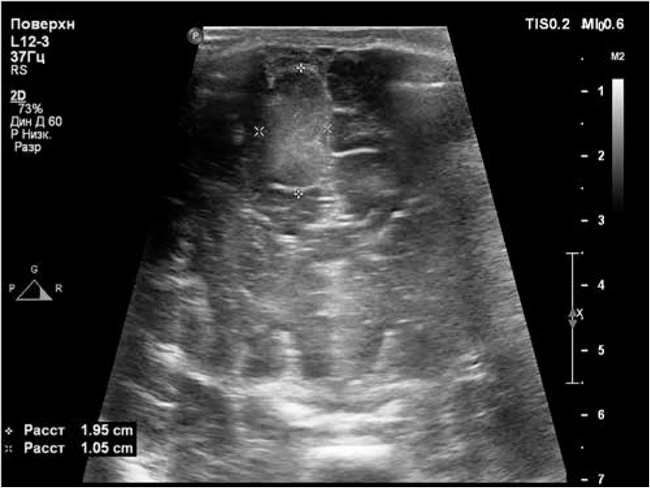
По результатам МРТ головного мозга с контрастированием на 7-е сут. жизни выявлены множественные очаговые изменения в интра-, субкортикальных и паравентрикулярных отделах вещества мозга лобных, теменных, височных и затылочных долей с признаками кистозной дегенерации с вовлечением базальных ядер, ствола; субэпендимальных узловых образований в области боковых желудочков (рис. 3).
Рисунок 3. Субэпендимальные узловые образования
Диагноз «Туберозный склероз» был выставлен по совокупности трех выявленных диагностических лабораторных критериев, характерных для данного заболевания: множественные рабдомиомы сердца, туберы головного мозга и гамартомы сетчатки и клинических – гипопигментные пятна. Эти критерии относятся к первичным (большим). Учитывая вероятность возникновения осложнений проводилась эхокардиография в динамике, с помощью которой оценивалось состояние объемного образования в полости ЛЖ, его размеры и отношение к выходному отделу желудочка. Размеры рабдомиом на 3-и и 14-е сут. жизни не имели существенных различий, признаков внутрижелудочковой обструкции не зафиксировано. На ЭКГ выявлен вариабельный синусовый ритм с тахикардией на фоне беспокойства, диффузные нарушения процессов реполяризации миокарда. Нейросонография не показала отрицательной динамики на 5-е сут. жизни. Была осуществлена телемедицинская консультация с ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» МЗ РФ, в ходе которой было рекомендовано проведение многоканальной ЭЭГ для исключения субклинических эпилептических приступов и при выявлении эпиактивности решение вопроса о назначении противоэпилептической терапии для сохранения когнитивных функций. Также рекомендовано генетическое консультирование семьи, проведение анализа на поиск мутации генов TSC1 и TSC2. Видеомониторирование ЭЭГ в возрасте 8 сут. жизни типичной эпилептиформной активности не регистрировало и эпилептических состояний во время исследования не отмечалось. Ребенок выписан из перинатального центра на амбулаторный этап в возрасте 14 сут. жизни на грудном вскармливании с адекватной прибавкой массы тела. Ребенок наблюдался по месту жительства, по направлению участкового врача-педиатра в 2 мес. был консультирован специалистами детского краевого консультативно-диагностического центра (КДЦ). Жалоб со стороны матери нет. Вскармливание естественное, прибавки в массе тела достаточные (масса тела 5670 г, окружность головы 39,5 см). Самочувствие не нарушено. Особо обращают внимание изменения со стороны нервной системы: голова долихоцефалической формы, выражен венозный рисунок, передний родничок 3 × 3 см, не выбухает. Мышечный тонус с рук и ног, физиологические безусловные рефлексы снижены. Эмоции отсутствуют: не фиксирует взгляд, нет улыбки, реакции слежения за предметом. Задержка психомоторного и доречевого развития. Из результатов проведенных инструментальных методов обследования: при ЭЭГ обращало на себя внимание замедление внутристволового проведения на понто-мезэнцефальном уровне с двух сторон при проведении АСВП (акустические стволовые вызванные потенциалы); НСС – в проекции хвостатого ядра слева выявлен очаг размером 11,6 × 4 мм, справа 2 очага размерами 3 × 4 и 3,5×2,7 мм. Повторный осмотр в возрасте 4 мес. жизни: за это время увеличилось число гипопигментных пятен на коже туловища и конечностей. По заключению врача-невролога и врача-логопеда выставлен диагноз «Задержка психомоторного и доречевого развития». НСС показала, что в головном мозге сохраняются ранее выявленные объемные образования, но без увеличения их размеров в динамике, по допплерографии сосудов головного мозга – без гемодинамических нарушений. При видеомониторировании ЭЭГ зафиксировано общее замедление корковой ритмики, эпилептических состояний за время проведения дневного мониторинга не отмечалось. В возрасте 5 мес. жизни у ребенка на коже появился участок «шагреневой кожи» в области поясницы плотной консистенции, желтовато-коричневого цвета, умеренно выступающий над поверхностью окружающей кожи. И в этот же период произошел дебют серийных эпилептических приступов. На терапии препаратом вальпроевой кислоты в течение 2 нед. эффекта не было, смена противосудорожной терапии на необратимый селективный ингибитор GABA-аминотрансферазы (вигабатрин) дала положительный эффект, приступы купировались (доза 500 мг/сут). В возрасте 7 мес. жизни ребенок проконсультирован в НИКИ педиатрии и детской хирургии имени академика Ю.Е. Вельтищева. По данным ЭхоКГ выявлено функционирующее овальное окно, эхонегативные образования в ЛЖ до 3,5 мм, в ПЖ около свободной стенки до 4,5 мм – без признаков обструкции. Размеры полостей сердца в пределах нормы. При МРТ-исследовании головного мозга сохраняется картина ТС с наличием кортикальных и субкортикальных туберсов, СЭУ. Проводился видеомониторинг ЭЭГ дневного сна и бодрствования в течение 4 ч на фоне противосудорожной терапии вигабатрином в дозе 1000 мг/сут. В ходе исследования в период бодрствования зарегистрирована низкосинхронизированная региональная эпилептиформная активность в левой теменно-центральной и теменно-центрально-височной областях. В период сна также зарегистрирована низкосинхронизированная мультирегиональная эпилептиформная активность, преимущественно по левому полушарию. Эпилептических приступов не зарегистрировано. При осмотре глазного дна в парамакулярной области справа и слева выявлены округлые сероватые образования диаметром 1,5 ДЗН и 2-3 ДЗН соответственно. Пациенту было рекомендовано продолжить постоянный длительный прием противосудорожной терапии и динамическое наблюдение по месту жительства.
Обсуждение
Туберозный склероз – это генетически детерминированное заболевание из группы факоматозов с широким спектром клинических проявлений, сопровождающееся развитием множественных доброкачественных опухолей (гамартом) в различных органах, включая головной мозг, глаза, кожу, сердце, почки, печень, легкие, желудочно-кишечный тракт, эндокринную и костную системы [1]. Причина ТС обусловлена мутациями в генах TSC1 или TSC2, которые в норме являются естественными генами-супрессорами опухолевого роста. Основное звено патогенеза ТС – мутация генов (TSC1 или TSC2) и потеря ингибирующей функции белков – гамартина и туберина на киназу mTOR. Происходит усиление роста и пролиферации клеток, активация ангиогенеза и формирование гамартом (от греч. hamarta – ошибка) с 7–20-й нед. внутриутробного развития [5]. Гигантские дисморфные клетки мигрируют из зародышевой зоны и на своем пути останавливаются в различных отделах мозга, формируя там опухоли из незрелой эмбриональной ткани [6]. У наблюдаемого нами ребенка при проведении анализа на мутации генов TSC1 и TSC2 выделена мутация гена TSC1, при которой заболевание течет мягче. Факторы риска отсутствуют, т. к. заболевание генетическое (многогенное). Ранний дебют заболевания в данном клиническом случае проявился в антенатальном периоде преимущественно поражением ЦНС (субэпендимальные узлы боковых желудочков), сердца (рабдомиомы) [7, 8]. При рождении у наблюдаемого нами новорожденного выявлены клинические признаки – гипопигментированные участки кожи диаметров 5 мм и гамартомы сетчатки. Туберы представляют собой участки фокальной корковой дисплазии со сниженным числом ГАМК-эргических нейронов и характеризуются потерей классической 6-слойной цитоархитектуры коры мозга. Неблагоприятным с прогностической точки зрения фактором является наличие более 8 туберов: вероятность развития эпилепсии в раннем возрасте очень высока [1]. У данного ребенка к 4-м мес. жизни при МРТ-исследовании головного мозга сохраняется картина ТС с наличием кортикальных и субкортикальных туберсов, СЭУ, но тубер был «немой» – неэпилептогенный. В 5 мес. жизни произошел дебют серийных эпилептических приступов. При видеомониторинге ЭЭГ зарегистрирована низкосинхронизированная региональная эпилептиформная активность в левой теменно-центральной и теменно-центрально-височной областях. Причина эпилептических приступов связана с нарушением функции TSC1, что приводит к повышенной экспрессии инотропных рецепторов к глутамату, нарушению процессов возбуждения и торможения в ЦНС и формированию очагов эпилептической активности [6, 9]. Судороги у ребенка резистентны к препарату вальпроевой кислоты. Смена противосудорожной терапии на необратимый селективный ингибитор GABA-аминотрансферазы (вигабатрин) дала положительный эффект, приступы купировались (доза 500 мг/сут). После рождения у ребенка клинические признаки дебюта заболевания с поражением нервной системы в виде инфантильных спазмов, синдрома Веста, кожных проявлений, задержки психомоторного развития манифестировали на первом году жизни [10]. Выявление СЭУ решает вопрос дифференциальной диагностики с другими заболеваниями метаболического, эндокринного или инфекционно-воспалительного генеза. Очаговые изменения паренхимы мозга могут формироваться и после перенесенных внутриутробных инфекций, таких, например, как цитомегаловирусные инфекции, герпес или токсоплазмоз. Проведенные серологические исследования крови у данного ребенка на внутриутробные инфекции исключили инфекционный процесс, связанный с поражением нервной системы. Область БЖМ и субэпендимальные зоны являются наиболее доступными для визуализации у детей, что позволяет выявить деформацию стенок боковых желудочков за счет субэпендимально расположенных узлов [11]. Если определяется более одного СЭУ с характерной деформацией стенок БЖМ, то диагноз ТС не вызывает сомнений [12]. Согласно литературным данным, изменения в головном мозге при ТС часто сочетаются с нахождением сердечных рабдомиом, что и было выявлено у наблюдаемого нами ребенка. По разным источникам, от 60 до 80% случаев рабдомиом связаны с ТС [2]. Рабдомиомы сердца выявлены в антенатальном периоде с локализацией в ЛЖ в толще МЖП без признаков внутрижелудочковой обструкции. После рождения отмечается остановка в росте рабдомиом, о чем свидетельствуют данные эхокардиографии, которые проводились в динамике. Согласно литературным данным, после 32-й нед. гестации в клетках рабдомиом запускается процесс апоптоза под действием протеина убиквитина, что приводит к регрессии опухоли. Опухоль никогда не малигнизирует и не метастазирует [11]. Но некоторые рабдомиомы могут вызывать тяжелые формы нарушения ритма и нарушения гемодинамики из-за внутрисердечной обструкции или деформации проводящей системы сердца [13]. Высокий уровень спонтанного обратного развития рабдомиом в постнатальном периоде, вероятно, связан еще и с уменьшением эффектов материнского эстрогена и потерей постнатального митотического потенциала клеток рабдомиом. Таким образом, особенность сердечных рабдомиом заключается в высоком уровне их регрессирования, часто полном исчезновении в раннем детстве [11]. Основной регресс опухоли происходит в 70% случаев в возрасте до 4 лет [2]. Морфологическое подтверждение диагноза не требуется при нахождении множественных некальцифицированных образований сердца у новорожденных и детей раннего возраста, особенно в сочетании с другими клиническими признаками ТС [1]. На фоне регрессирования рабдомиом в первые годы жизни у детей с ТС поражение ЦНС становится доминирующим [13]. В рассматриваемом нами клиническом случае у новорожденного ребенка помимо поражения головного мозга и сердца были выявлены множественные объемные образования сетчатки обоих глаз. Гамартомы сетчатки выявляются более чем у половины пациентов и могут быть как с одной, так и с обеих сторон [7]. Данные образования характеризуются эндофитным ростом, в некоторых случаях с течением времени подвергаются кистозной дегенерации с формированием гиалиновых и кальциевых включений. В большинстве случаев наличие гамартом бессимптомно, их размеры в течение жизни не меняются либо со временем возможен регресс. Осложнения, приводящие к снижению зрения, развиваются редко [5, 7]. ТС относится к заболеваниям с прогредиентным течением и неблагоприятным исходом, с формированием нарушений функций организма, в том числе психических и ментальных [1, 5, 14, 15], что имеет место у наблюдаемого нами ребенка. При ранней диагностике заболевания и своевременном начале лечения есть возможность улучшить прогноз и качество жизни пациентов [2]. В 2012 г. был зарегистрирован препарат Эверолимус, который является ингибитором сигнального пути mTOR. Использование данного препарата приводит к снижению роста опухолей в головном мозге, сокращению рабдомиом сердца большого объема, вызывающих гемодинамические изменения и нарушения ритма [14]. Имеются многоцентровые ретроспективные исследования по эффективности и возможности лечения этим препаратом [9, 16].
Заключение
Наиболее оптимальным периодом для диагностики ТС, по нашему мнению, является перинатальный период в связи с возможностью выявления характерных диагностических признаков заболевания. Но по приказу МЗ РФ от 20.10.2020 № 1130н исключено проведение третьего скрининга как обязательного. Поэтому при манифестации аномалий развития после 21-й нед. беременности эти изменения плода могут остаться недиагностированными.
В связи с тем что ТС является орфанным заболеванием с относительно поздним дебютом клинических проявлений и быстрым наступлением инвалидизации пациента, большую значимость имеет вопрос возможности проведения скрининговых эхографических исследований головного мозга и сердца всем новорожденным в родовспомогательных учреждениях.
Учитывая основные клинические критерии ТС, обязательными элементами диагностического поиска должны быть тщательный осмотр кожных покровов пациента, такие инструментальные методы обследования, как электрокардиография и эхокардиография, УЗИ органов брюшной полости и почек, для выявления образований в ЦНС – нейросоноскопия и МРТ. Высокая вероятность возникновения эпилептической активности диктует необходимость включения ЭЭГ в план обследования пациента. Для выявления конкретной мутации используется генетическое тестирование, что помогает определить прогноз течения болезни и риск развития возможных осложнений ТС.
С учетом обнаруженных при обследовании симптомов заболевания, всем пациентам с диагнозом «туберозный склероз» требуется длительное, в течение всей жизни, наблюдение врачами различных специальностей. Несомненно, особое внимание специалистов должно быть направлено на предотвращение и купирование жизнеугрожающих осложнений, которые крайне вероятны у таких больных.
Список литературы / References
Развернуть
- Дорофеева МЮ, Белоусова ЕД, Пивоварова АМ. Рекомендации по диагностике и лечению туберозного склероза. Журнал неврологии и психиатрии им. С.С. Корсакова. 2014;114(3):58–74. Режим доступа: https://elibrary.ru/. / Dorofeeva MIu, Belousova ED, Pivovarova AM. Recommendations for diagnosis and treatment of tuberous sclerosis. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2014;114(3):58–74. (In Russ.) Available at: https://elibrary.ru/.
- Dahdah N. Everolimus for the treatment of tuberous sclerosis complex–related cardiac rhabdomyomas in pediatric patients. J Pediatr. 2017;190(7):21–26. doi: 10.1016/j.jpeds.2017.06.076.
- Гамирова РГ, Князева ОВ, Гадиева АР, Билялова СМ. Болезнь Бурневилля – Прингла: клинический случай из практики детского невролога. Практическая медицина. 2017;1(1):157–161. Режим доступа: https://pmarchive.ru/. / Gamirova RG, Knyazeva OV, Gadieva AR, Bilalova SM. Bourneville – Pringle disease: a clinical case report from pediatric neurologist practice. Practical Medicine. 2017;1(1):157–161. (In Russ.) Available at: https://pmarchive.ru/.
- Curatolo P, Bombardieri R, Jozwiak S. Tuberous sclerosis. Lancet. 2008;372(9639):657–668. doi: 10.1016/S0140-6736(08)61279-9.
- Portocarrero L, Quental K, Samorano L, Oliveira Z, Rivitti-Machado M. Tuberous sclerosis complex: review based on new diagnostic criteria. An Bras Dermatol. 2018;93(3):323–329. doi: 10.1590/abd1806-4841.20186972.
- Евтушенко СК, Гагара ДА. Туберозный склероз как междисциплинарная проблема в нейропедиатрии (научный обзор и личные наблюдения). Международный неврологический журнал. 2015;(6):12–22. Режим доступа: https://elibrary.ru/. / Yevtushenko SK, Hahara DA. Tuberous sclerosis as an interdisciplinary problem in neuropediatrics (scientific review and personal observations). International Neurological Journal. 2015;(6):12–22. (In Russ.) Available at: https://elibrary.ru/.
- Дорофеева МЮ, Белоусова ЕД, Пивоварова АМ, Кобринский БА, Подольная МА, Шагам ЛИ и др. Первые результаты функционирования регистра больных туберозным склерозом. Российский вестник перинатологии и педиатрии. 2015;60(5):113–120. Режим доступа: https://elibrary.ru/. / Dorofeeva MYu, Belousova ED, Pivovarova AM, Kobrinsky BA, Podolnaya MA, Shagam LI et al. The first results of tuberous sclerosis registry. Russian Bulletin of Perinatology and Pediatrics. 2015;60(5):113–120. (In Russ.) Available at: https://elibrary.ru/.
- Хмелевская ИГ, Бец ОГ, Матвиенко ЕВ, Архипова АГ. Спонтанный регресс рабдомиомы сердца в неонатальном периоде. Трудный пациент. 2021;19(3):11–14. Режим доступа: https://elibrary.ru/. / Khmelevskaya IG, Bets OG, Matvienko EV, Arkhipova AG. Spontaneous regression of cardiac rhabdomyoma in the neonatal period. Trudnyi Patsient. 2021;19(3):11–14. (In Russ.) Available at: https://elibrary.ru/.
- de Groen AC, Bolton J, Bergin AM, Sahin M, Peters JM. The Evolution of subclinical seizures in children with tuberous sclerosis complex. J Child Neurol. 2019;34(12):770–777. doi: 10.1177/0883073819860640.
- Ebrahimi-Fakhari D, Mann L, Poryo M, Graf N, Kries R, Heinrich B et al. Incidence of tuberous sclerosis and age at first diagnosis: new data and emerging trends from a national, prospective surveillance study. Orphanet J Rare Dis. 2018;13(1):117–125. doi: 10.1186/s13023-018-0870-y.
- Черданцева СЮ, Черданцева ЮЕ, Канайлова ОП, Свищева МЕ. Туберозный склероз у детей в практике врача ультразвуковой диагностики: обзор литературы с собственными клиническими наблюдениями. Радиология – практика. 2022;(2):49–64. doi: 10.52560/2713-0118-2022-2-49-64. / Cherdantseva SYu, Cherdantseva YuE, Kanailova OP, Svishcheva ME. Tuberous Sclerosis in the Practice of Ultrasound Specialist: a Literature Review with our Own Observations. Radiology – Practice. 2022;(2):49–64. (In Russ.) doi: 10.52560/2713-0118-2022-2-49-64.
- Божко ОВ, Чураянц ВВ, Дорофеева МЮ, Никанорова МЮ. Роль лучевых методов в диагностике туберозного склероза. Медицинская визуализация. 2001;(2):22–26. Режим доступа: https://publish.vidar.ru/. / Bozhko OV, Churayans VV, Dorofeeva MYu, Nikanorova MYu. The role of radiation methods in the diagnosis of tuberous sclerosis. Medical Visualization. 2001;(2):22–26. (In Russ.) Available at: https://publish.vidar.ru/.
- Науменко ЕИ, Ануфриева ВГ, Гришуткина ИА. Опухоль сердца у новорожденного как маркер туберозного склероза: клинический случай. Педиатрическая фармакология. 2020;17(2):148–151. doi: 10.15690/pf.v17i2.2101. / Naumenko EI, Anufrieva VG, Grishutkina IA. Cardiac tumor in newborn as a marker of tuberous sclerosis: clinical case. Pediatric Pharmacology. 2020;17(2):148–151. (In Russ.) doi: 10.15690/pf.v17i2.2101.
- Белоусова ЕД, Влодавец ДВ, Пивоварова АМ, Катышева ОВ, Дорофеева МЮ. Таргетная терапия туберозного склероза. Российский вестник перинатологии и педиатрии. 2016;61(5):106–112. doi: 10.21508/1027-4065-2016-61-5-106-112. / Belousova ED, Vlodavets DV, Pivovarova AM, Katysheva OV, Dorofeeva MYu. Targeted therapy for tuberous sclerosis complex. Russian Bulletin of Perinatology and Pediatrics. 2016;61(5):106–112. (In Russ.) doi: 10.21508/1027-4065-2016-61-5-106-112.
- Лаптева НМ, Скачкова МА, Тарасенко НФ, Долгушина МВ, Мирошникова ЛА. К вопросу о применении противоопухолевого препарата «Эверолимус» в лечении ребенка с туберозным склерозом. Российский вестник перинатологии и педиатрии. 2020;65(4):289. Режим доступа: https://cyberleninka.ru/. / Lapteva NM, Skachkova MA, Tarasenko NF, Dolgushina MV, Miroshnikova LA. On the issue of the use of the antitumor drug «everolimus » in the treatment of a child with tuberous sclerosis. Russian Bulletin of Perinatology and Pediatrics. 2020;65(4):289. (In Russ.) Available at: https://cyberleninka.ru/.
- Saffari A, Brösse I, Wiemer-Kruel A, Wilken B, Kreuzaler P, Hahn A et al. Safety and efficacy of mTOR inhibitor treatment in patients with tuberous sclerosis complex under 2years of age – a multicenter retrospective study. Orphanet J Rare Dis. 2019;14(1):96–109. doi: 10.1186/s13023-019-1077-6.








