Журнал "Медицинский совет" №1/2024
DOI: 10.21518/ms2024-004
И.Н. Захарова1, И.М. Османов2, С.А. Коровин1, С.А. Оробинский2, Я.В. Оробинская1, И.В. Бережная1, А.Д. Гостюхина1
1 Российская медицинская академия непрерывного профессионального образования; 125993, Россия, Москва, ул. Баррикадная, д. 2/1, стр. 1
2 Детская городская клиническая больница имени З.А. Башляевой; 125373, Россия, Москва, ул. Героев Панфиловцев, д. 28
Острый аппендицит является наиболее часто встречающейся хирургической патологией в педиатрической практике. Оперативные вмешательства у детей с острым и осложненным аппендицитом выполняются по экстренным показаниям в различные сроки заболевания. В настоящее время лапароскопическая аппендэктомия стала «золотым стандартом» экстренной хирургической помощи детям. Совершенствование технологических приемов оперативных вмешательств и протоколов послеоперационного ведения минимизировали осложнения у детей до 5–7%. В настоящее время предметом обсуждения являются вопросы аргументации выполнения «попутных аппендэктомий» при минимальных макроскопических изменениях червеобразного отростка у детей с неспецифическим брыжеечным лимфаденитом, кишечными инвагинациями, конкрементами в просвете червеобразного отростка, обоснования показаний и сроков для оперативных вмешательств при хроническом аппендиците. Долгое время аппендикс считался «ненужным» органом, просто рудиментом, оставшимся в процессе эволюции человека. За последние два столетия велась большая работа по исследованию аппендикса. Строение червеобразного отростка уникально. Он имеет узкий просвет, обильную мукозо-ассоциированную лимфоидную ткань и ценный микробный состав. Недавно была выдвинута гипотеза о том, что аппендикс имеет иммуномодулирующие функции и служит убежищем для микробиоты, предоставляя комменсальные бактерии для восстановления кишечника после перенесенных инфекций или проведения антибактериальной терапии. Есть исследования, свидетельствующие о том, что после удаления аппендикса возрастает риск воспалительных заболеваний кишечника, включая язвенный колит. Однако механизмы этой причинно-следственной связи остаются неясными. В данной статье мы рассматриваем современные данные о микробиоме аппендикса и связи между аппендиксом и язвенным колитом.
Для цитирования: Захарова И.Н., Османов И.М., Коровин С.А., Оробинский С.Б., Оробинская Я.В., Бережная И.В., Гостюхина А.Д. Аппендикс – «приложение к двенадцати метрам кишечника или кладовая микробиоты»? Медицинский Совет. 2024;(1):293–301. https://doi.org/10.21518/ms2024-004
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Аppendix: “an appendage to a twelve-meter gut or a storehouse for microbiota”?
Irina N. Zakharova1, Ismail M. Osmanov2, Sergey A. Korovin1, Sergey B. Orobinsky2, Yana V. Orobinskaya1, Irina V. Berezhnaya1, Anastasia D. Gostyukhina1
1 Russian Medical Academy of Continuous Professional Education; 2/1, Bldg. 1, Barrikadnaya St., Moscow, 125993, Russia
2 Children's City Clinical Hospital named after Z. A. Bashlyaeva; 28, Geroyev Panfilovtsev St., Moscow, 125373, Russia
Acute appendicitis is the most common surgical pathology in paediatric practice. Surgical interventions in children with acute and complicated appendicitis are performed when urgently indicated at various stages of the disease. Laparoscopic appendectomy has become the current “gold standard” for providing emergency surgery care to children. Improvements in surgical techniques and post-operative protocols have reduced complications in children to 5–7%. The current discussion topics include the issues of argumentation of “incidental appendectomies” to be performed in minimal macroscopic changes in the vermiform appendix in children with nonspecific mesenteric lymphadenitis, intestinal indigitation, appendiceal lithiasis, justifications for indications and timing for surgical interventions in chronic appendicitis. The appendix has long been considered an “unnecessary” organ, just vestigial structures left over in the process of human evolution. Over the past two centuries, much work has been done to study the appendix. The structure of the vermiform appendix is unique. It has a narrow lumen, abundant mucosa-associated lymphoid tissue and valuable microbial composition. It has recently been hypothesized that the appendix has immunomodulatory functions and serves as a “safe house” for the microbiota, providing commensal bacteria that may restore the gut after infections or antibiotic therapy. Some studies suggest that removal of the appendix increases the risk of inflammatory bowel disease, including ulcerative colitis. However, mechanisms underlying such causal relationship remain unclear. This article considers current knowledge when addressing the appendix microbiome and the relationship between the appendix and ulcerative colitis.
For citation: Zakharova I.N., Osmanov I.M., Korovin S.A., Orobinsky S.B., Orobinskaya Ya.V., Berezhnaya I.V., Gostyukhina A.D. Appendix: “an appendage to a twelve-meter gut or a storehouse for microbiota”? Meditsinskiy sovet = Medical Council. 2024;(1):293–301. (In Russ.) https://doi.org/10.21518/ms2024-004
Conflict of interest: the authors declare no conflict of interest.
Введение
В настоящее время аппендэктомия является одной из наиболее распространенных неотложных хирургических операций у детей и взрослых во всем мире. Общая заболеваемость составляет от 3 до 6 на 1 000 детей [1]. «Золотым стандартом» в экстренной хирургической помощи детям стала лапароскопическая аппендэктомия. Применение данного метода значительно снизило число послеоперационных осложнений у детей до 5–7% [2]. Актуальным остается вопрос о целесообразности выполнения аппендэктомии при минимальных макроскопических изменениях червеобразного отростка у детей с неспецифическим брыжеечным лимфаденитом, илеоцекальными инвагинациями и конкрементами в просвете червеобразного отростка в виду малой доказательной базы [3].
Несмотря на то что за последние два столетия была сделано много открытий, связанных с аппендиксом и аппендэктомией, физиологическая функция червеобразного отростка и патогенез аппендицита до конца не изучены. Согласно данным Ассоциации детских хирургов, в детском возрасте аппендицит развивается быстрее, а деструктивные изменения в отростке, приводящие к аппендикулярному перитониту, возникают значительно чаще, чем у взрослых. Эти закономерности наиболее выражены у детей первых лет жизни, что обусловлено анатомо-физиологическими особенностями детского организма, влияющими на характер клинической картины заболевания и в некоторых случаях требующими особого подхода к решению тактических и лечебных задач.
Острый аппендицит может возникнуть в любом возрасте, включая новорожденных, однако пик заболеваемости приходится на возраст 9–12 лет [4]. Недавний метаанализ показал тенденцию к увеличению заболеваемости аппендицитом в промышленно- развитых странах [5]. Аппендицит определяется как воспаление червеобразного отростка. Европейская ассоциация эндоскопической хирургии (EAES) разделяет острый аппендицит на 2 вида – неосложненный и осложненный [6]. Неосложненным является острый аппендицит без признаков перфорации, абсцесса или флегмоны; осложненный аппендицит возникает в результате разрыва червеобразного отростка с последующим образованием абсцесса или флегмоны [7].
В 1880 г. Роберт Лоусон Тейт впервые поставил диагноз «аппендицит» и удалил аппендикс хирургическим путем, а в 1886 г. Реджинальд Хибер Фитц опубликовал исследование об аппендиците и назвал процедуру аппендэктомией. Позднее, в 1889 г., Тейт вскрыл и дренировал воспаленный аппендикс, не удаляя его. А в 1981 г. появился новый «золотой стандарт» в хирургическом лечении острого и хронического аппендицита – лапороскопическая аппендэктомия, которую впервые выполнил Курт Семм [8].
Аппендэктомия является методом выбора при неосложненном остром аппендиците во всех возрастных группах [9]. Существует несколько предполагаемых причин развития аппендицита. Наиболее распространенным объяснением является внутрипросветная обструкция в результате лимфоидной гиперплазии, попадания инородных тел, скопления паразитов или разрастание опухолей. Это приводит к скоплению кишечного секрета и растяжению просвета аппендикса, что нарушает капиллярный кровоток и ослабляет эпителиальный слизистый барьер, потенциально делая возможным бактериальную инвазию в стенку аппендикса [10]. Появляется все больше доказательств того, что механическая обструкция вряд ли может быть основной причиной всех случаев аппендицита [11]. Несмотря на то что первое подробное исследование аппендиколита было проведено еще в 1966 г., сведения об аппендикулярных конкрементах скудны [12]. Обструкция просвета аппендикса, вызванная аппендиколитом, лимфоидной гиперплазией или отеком, считалась основной причиной аппендицита, а избыточный бактериальный рост рассматривался как следствие [13, 14]. Несмотря на неопределенность в отношении последовательности событий, ведущих к развитию аппендицита, в настоящее время предполагается, что микробиом играет центральную роль в патогенезе развития воспаления. Этот факт подтверждает то, что во многих публикациях задокументировано успешное консервативное лечение неосложненного аппендицита антибиотиками в детском и взрослом возрасте [15]. Также было высказано предположение, что аппендикс может функционировать как резервуар для комменсальных бактерий, что позволяет повторно заселять микробиом кишечника после таких нарушений, как диарея, антибиотикотерапия и т.д. [16].
Не стоит забывать, что червеобразный отросток структурно является высокоиммунологическим органом и, как сообщается, обладает важной иммунологической функциональностью [17]. Понимание патофизиологии и факторов, способствующих рецидивирующему аппендициту, имеет жизненно важное клиническое значение для оценки оптимальных парадигм лечения неосложненного острого аппендицита.
Данная статья представляет собой краткое изложение текущей литературы, посвященной изучению микробиома аппендикса, причин развития аппендицита и возможной взаимосвязи аппендэктомии с воспалительными заболеваниями кишечника (ВЗК). Во многих исследованиях подтверждено микробное разнообразие и роль бактерий в развитии воспаления. Также предполагается, что частота ВЗК уменьшается после аппендэктомии по поводу острого аппендицита до постановки диагноза и наоборот.
Аппендикс – «убежище» для комменсальной кишечной флоры
Иммунология аппендикса
Червеобразный отросток находится рядом с илеоцекальным клапаном, на стыке тонкой и толстой кишки [18]. Как известно, он не играет роли в пищеварении, а занимает промежуточное положение [19]. Эта уникальная структура, одновременно соединенная с просветом кишки, защищена от фекального потока и его патогенного потенциала. Эволюция такого расположения могла быть вызвана потребностью в иммунной поддержке и защите кишечного микробиома [20].
Рассматривая гистологическую структуру аппендикса, видно, что его стенка, подобно толстой кишке, состоит из слизистой, подслизистой, наружной мышечной и серозной оболочки (рис. 1). Однако внутри этих слоев количество и функция клеток различаются. Это имеет важное значение в понимании того, как аппендикс может обеспечивать иммунный ответ [21].
Особенностью подслизистого слоя является наличие лимфоидных фолликулов. Их обычно называют лимфоидной тканью, ассоциированной с кишечником (Gastro-Associated Lymphoid Tissue – GALT). Аппендикс, обогащенный GALT, чьи свойства, сходны с пейеровыми бляшками, представляет собой вторичный лимфоидный орган, который играет важную роль в обнаружении и удалении патогенов [22]. Рассматривая строение самого лимфоидного фолликула, отмечено заметное обилие В-лимфоцитов и Т-лимфоцитов в мантийной области. В зародышевом центре обнаружены фолликулярные дендритные клетки (FDC) и центроциты, а в дистальной части имеются участки с высокой долей CD4+/CD8+-клеток, что указывает на то, что подслизистая оболочка может участвовать в распознавании антигена и вызывать иммунный ответ [23].
Рисунок 1. Схематическое изображение слоев аппендикса с лимфоидными тканями и комменсальными микробами
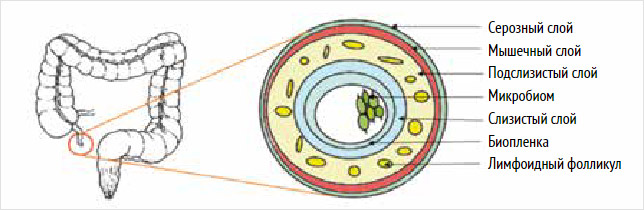
Что касается слизистой оболочки, она состоит из столбчатого эпителия с энтероцитами и бокаловидными клетками. Наряду с макрофагами, в собственной пластинке обнаруживается большое количество плазматических, NKT-клеток и активированных Т- и В-лимфоцитов, продуцирующих иммуноглобулин IgA и IgG, которые специфичны для аппендикса и играют важную роль в качестве эффекторов в иммунных реакциях на микробы [24]. Ранее сообщалось, что выработка антител, а именно IgA, осуществляется для секреторного или слизистого поверхностного иммунитета [25]. IgA представляет собой наиболее многочисленный класс антител в просвете кишечника человека, прикрепляясь к комменсальным бактериям с низким сродством, он контролирует их численность и состав, а также выступает в качестве основной линии защиты эпителия кишечника от токсинов и внешних патогенов [26]. В модели мышей с аппендэктомией наблюдалось отсроченное и сниженное накопление IgA-клеток, наблюдаемых в толстой кишке, что приводило к изменениям состава кишечной фекальной микробиоты [27]. Такое наблюдение можно объяснить тем, что основной функцией секреторного IgА именно в аппендиксе является стимуляция агглютинации бактерий. Муцин улавливает эти агглютинированные бактерии в слое слизи, образуя биопленки.
Биопленки
Биопленки определяются как прикрепленные друг к другу колонии бактерий, растущие во внеклеточном матриксе, и в настоящее время считаются нормальным компонентом кишечной флоры [28]. Биопленка состоит из двух частей, одна из которых представляет собой тонкий слой рыхлого муцина, перекрывающий более толстый компонент [23]. Второй слой лежит непосредственно на эпителиальных клетках кишечника, нерастворим и помогает обеспечить барьер для предотвращения проникновения патогенов через слизистую оболочку кишечника [29].
У человека биопленки наиболее распространены в аппендиксе. К концу толстой кишки их количество, непрерывность и плотность уменьшается [30]. Данное наблюдение было зарегистрировано с помощью электронной микроскопии в нормальном кишечнике крысы, бабуина и человека. D. Palestrant et al. в 2004 г. исследовали бактериальные колонии, и их наблюдения показали, что, помимо образования механического барьера, части биопленки сбрасываются, что позволяет бактериям перемещаться [31]. Считается, что отслоение частей самой биопленки облегчает (повторное) заселение полезных бактерий [32]. Это наблюдение ярко продемонстрировано во время заболеваний, вызывающих диарею. Оборот энтероцитов и, следовательно, отслоение биопленки ускоряется, в результате чего стенка кишечника теряет свой защитный барьер [33]. Единственное место с относительно небольшим контактом с фекалиями, защищенное от диарейного клиренса, – это аппендикс [34].
Поэтому вызывает большой интерес то, что червеобразный отросток, возможно, регулярно повторно заселяет толстую кишку при возникновении временных нарушений кишечного микробиома. В отчетах задокументировано, что кишечный микробиом (помимо диарейных заболеваний) может подвергаться ежедневным неблагоприятным воздействиям. Это происходит на фоне психологических (стресс), диетических воздействий или даже при кратковременном приеме антибиотиков [35]. Такие нарушения могут поддерживать бактериальные механизмы, которые дестабилизируют сбалансированную микробиоту, приводя к дисбактериозу кишечника. Опираясь на исследование C.M. Guinane et al. 2013 г., можно говорить, что аппендикс содержит большое разнообразие кишечных микробов, в т. ч. «полезных бактерий», включая роды Bacteroides, Lactobacillus и Bifidobacterium. Вполне вероятно, что эти бактерии присутствуют в биопленках на эпителиальном слое аппендикса и могут служить резервуаром для пополнения популяций, которые были уничтожены в кишечнике (рис. 2) [36]. Этот механизм можно рассматривать аналогично пересадке микробиоты толстой кишки, используемой для восстановления здоровой флоры при рецидивирующих инфекциях, поддерживая идею о том, что рецидив может быть связан с истощенным микробиомом [37].
Рисунок 2. Цикл выздоровления от диарейных заболеваний, поддерживаемый червеобразным отростком
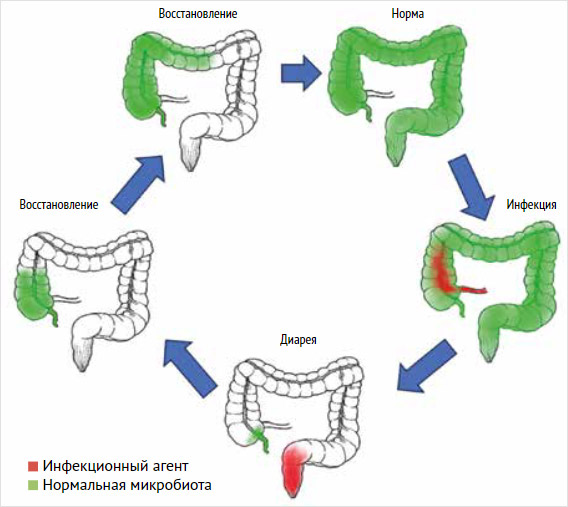
Примечание: на схеме полезные бактерии (зеленые) быстро выводятся при диарее вместе с патогенными бактериями (красные), оставляя в пищеварительном тракте гораздо меньше бактерий, чем обычно (обозначено белыми областями). После этой «чистки» бактерии, выделенные из аппендикса, инокулируют толстую кишку, инициируя повторный рост флоры толстой кишки [38].
Учитывая высокую плотность бактерий в аппендиксе и его предполагаемую функцию «убежища», это может указывать на то, что биопленка играет решающую иммунологическую роль в содействии развитию нормальной (кишечной) иммунной системы. Следовательно, потенциальная роль аппендикса в гомеостазе и патогенезе заболевания, вероятно, опосредована микробами и иммунитетом. Эта деятельность открыла возможности для улучшения здоровья путем тщательного изучения или поощрения благотворного воздействия на микробиом.
Разнообразие микробиоты при воспалении червеобразного
отростка
Несмотря на то что сейчас существует множество исследований, в которых изучался состав кишечного микробиома, для червеобразного отростка доступно не так много данных. Основной интерес большинства исследований был сосредоточен на различиях в микробиомах здоровых и воспаленных аппендиксов как у детей, так и у взрослых.
В 2000 г. N.J. Carr et al. заявили, что в генезе аппендицита возможна инвазия его внутрипросветными бактериями [39]. В 2022 г. А. de Costa A. et al. в своем обзоре также указывают на то, что нарушение первого слоя эпителиального барьера и слоев слизи приводит к воспалительным последствиям, что может позволить оппортунистическую колонизацию ниши аппендикса [40]. В ранних исследованиях использовался метод культивирования in vitro, при котором большинство видов желудочно-кишечных микробов было невозможно выявить. Именно поэтому в настоящее время этот метод не подходит для описания сложного микробного состава в червеобразном отростке. К счастью, возможности расширились, и в более поздних исследованиях для оценки микробного разнообразия проводились исследования микробиоты аппендикса на основе секвенирования 16S рДНК бактериальных компонентов [41].
До сих пор существует спор о преобладающих возбудителях. Некоторые авторы считают, что Escherichia coli и анаэробный Clostridium perfringens являются самыми распространенными. Другие указывают на преобладание Klebsiella spp., Enterobacter spp. или Bacteroides fragilis, Pseudomonas aeruginosa, Enterococcus spp. и альфа- и гамма-гемолитических стрептококков [42].
В проспективное когортное исследование, проведенное S. Vanhatalo et al., было включено 308 пациентов с неосложненным и осложненным аппендицитом. Bacteroides fragilis и Escherichia UNK появились как преобладающие виды независимо от тяжести аппендицита. Aggregatibacteria segnis и Streptococcus UNK преобладали только при неосложненном аппендиците, в то время как Fusobacterium, Haemophilus parainfluenzae, Bacteroides faecis, Bacteroides dorei – только при осложненном [43]. Схожие данные были получены S. Munakata et al., которые изучали микробиоту 12 пациентов, перенесших аппендэктомию. В их исследовании основными компонентами микробиома аппендикса были Bacteroidetes, Firmicutes, Proteobacteria, Fusobacterium, Synergistetes и Actinobacteria. [44]. Образцы, взятые у 20 детей с острым аппендицитом в исследовании Y. Bi et al. также показали разнообразие Firmicutes и Bacteroidetes [45].
В дополнение к этому была выдвинута теория о том, что ректальные мазки могут быть информативными при выявлении связанных с аппендицитом изменений в микробиоме [46]. В систематическом обзоре 11 поперечных исследований с использованием методов секвенирования нового поколения характеризовали микробиоту аппендикса при остром воспалении и без него. J. Antonsen et al. пришли к выводу, что в сравнении с ректальными мазками количество Fusobacterium в микробиоте аппендикса увеличивается, а α-разнообразие снижается (табл.). Примечательным открытием является то, что гистологически нормальные образцы аппендэктомии содержали небольшое количество Fusobacterium, которые обычно не наблюдались в образцах здоровых фекалий [47]. Это еще раз указывает на то, что аппендикс представляет собой уникальную микробную нишу, отличную от толстой кишки, которая поддерживает рост Fusobacterium. Предполагается, что при наличии специфических генетических факторов и факторов окружающей среды Fusobacterium популяции расширяются и вносят свой вклад в патогенез острого апендицита [48].
Таблица. Cравнение процентного содержания бактерий кишечника и червеобразного отростка [49]
| Группы бактерий | Аппендикс | Кишечник | Различие в составе |
| Firmicutes | 30–75 % | 35% | Схожий |
| Bacteroidetes | 4–12 % | 25% | Снижение |
| Actinobacteria | 3–11 % | 9% | Схожий |
| Proteobacteria | 37–46 % | 1% | Преобладание |
| Fusobacteria | 1–29 % | 0% | Преобладание |
Для более точного сравнения C.M. Guinane et al. использовали образец фекалий и сравнивали микробный состав с соответствующим образцом аппендикса на уровне типа, семейства и рода. На уровне типа образец стула содержал Firmicutes, Bacteroidetes, Proteobacteria и Actinobacteria. Однако в образце аппендикса того же пациента в дополнение к вышеупомянутым 4 типам была значительная доля последовательностей из типа Fusobacteria, а низкий процент прочтений был отнесен к типам Deferribacteres, Verrucomicrobia и Viridiplantae. Изучение субпопуляций ясно показало, что в образце аппендикса больше разнообразия, чем в образце кала [36]. Скорее всего, здесь играет роль несколько факторов. Потенциальным объяснением является различие образцов. Аппендикс обычно состоит из целых участков и включает ассоциированные со слизистой оболочкой инвазивные бактерии, в то время как ректальные мазки показывают только образцы внутрипросветных бактерий. Кроме того, аппендикс содержит местную микробиоту в месте воспаления, защищенном от фекального потока, в то время как прямая кишка анатомически удалена [50].
Особый интерес вызывает численность Fusobacterium nucleatum – орального возбудителя. Во многих исследованиях сообщается, что его увеличение напрямую связано с тяжестью заболевания [51, 52]. S.M.L. The et al. нашли Fusobacterium nucleatum примерно у трети всех пациентов в их исследовании. Тенденция к увеличению была при осложненном аппендиците, и это был не единственный оральный возбудитель. Опираясь на ранние исследования, они сообщили о повышенном присутствии Parvimonas micra. Совокупность этих результатов может указывать на потенциальную роль оральных патогенов в патогенезе острого апендицита [53].
Микробиом полости рта состоит из более чем 770 специфических бактерий, в основном это представители типов Firmicutes, Fusobacteria, Proteobacteria и Actinobacteria, тогда как в микробиоме кишечника в основном преобладают типы Bacteriodetes и Firmicutes [54]. В связи с этим были предприняты попытки изучить бактерии ротовой полости, которые обычно обнаруживаются в аппендиксе и реже – в кишечнике человека. С этим интересом связан тот факт, что миграция оральных патогенов, таких как Fusobacterium nucleatum, в нижний отдел желудочно-кишечного тракта может стать причиной воспаления, поскольку этой миграции не препятствует кислая среда желудка [55]. Было выдвинуто предположение, что микробиота полости рта у детей с аппендицитом может отличаться от таковой у детей без него. Чтобы проверить эту гипотезу, исследовали слюну у 22 пациентов с острым апендицитом и образцы слюны у 12 пациентов, перенесших холецистэктомию без аппендэктомии. α-разнообразие было сходным во всех группах выборки, за исключением пациентов после интервальной аппендэктомии, у которых было снижено разнообразие бактерий слюны. Независимо от этого, Fusobacteria, особенно Fusobacterium nucleatum, Fusobacterium necrophorum и Fusobacterium varium, были намного выше в образцах острого аппендицита. Более того, исследователи обнаружили, что образцы при остром аппендиците были лишены последовательностей некоторых видов, таких как Bacteroides [56]. Т. Hattori et al. показали, что Escherichia coli и Bacteroides часто выделяли из просвета аппендикса, однако их частота была одинаковой у пациентов с острым аппендицитом или без него [57]. Противоречивые результаты были получены в другом исследовании, в котором анализировалась последовательность генов микробиоты в просветной жидкости у 22 детей, перенесших аппендэктомию, где образцы с аппендицитом также содержали повышенное количество видов Fusobacteria, но обилие Bacteroides spp. заметно снижалось по сравнению с образцами без аппендицита. В дополнение к этому было выявлено присутствие других видов, таких как Porphyromonas, Parvimonas и Gemella [58]. S.J. Oh et al. выявили значительные различия в микробиоме аппендикса между острым аппендицитом и случайно удаленным. Значительная разница отмечалась в типах Bacteroidetes и Proteobacteria. Были также значительные различия между группами внутри филума Proteobacteria. К ним относятся повышенное разнообразие семейств Burkholderiaceae, Moraxellaceae и Campylobacteraceae и неизвестного рода из семейства Burkholderiaceae, а также родов Acinetobacter и Campylobacter. Уровни Campilobacter jejuni были повышены в тканях аппендикса у субъектов с острым аппендицитом по сравнению с контрольной группой со здоровыми аппендиксами [59]. Неожиданным открытием стало высокое обилие Fusobacteria в аппендиксе у 4 из 8 пациентов с интервальной аппендэктомией, у которых мазки были взяты через 2–3 мес. Удивительно, но микробиота аппендикса в этих случаях сильно напоминала образцы больных аппендицитом, перенесших срочную операцию. Это открытие подтверждает представление об аппендиксе как о «резервуаре» кишечных микробов во время острых нарушений и антибиотикотерапии. Клиническая значимость этого наблюдения неясна, но существует вероятность того, что пациенты с персистирующим воспалением популяции Fusobacteria после антибактериальной терапии первой линии могут подвергаться риску последующего рецидива заболевания [60].
Апендэктомия и язвенный колит
Влияние аппендэктомии на развитие язвенного колита (ЯК) и болезни Крона (БК) является предметом дискуссий на протяжении более 30 лет. До сих пор нет доказательств защитной или повреждающей роли червеобразного отростка при этих заболеваниях, а в некоторых исследованиях даже сообщается о полном отсутствии какого либо влияния [61]. Первый отчет, предполагающий корреляцию между аппендэктомией и ВЗК, был опубликован в 1987 г. В этом крупном исследовании «случай – контроль» у пациентов с ЯК была обнаружена значительно более низкая частота аппендэктомии по сравнению со здоровым контролем [62]. Интересно то, что более поздние исследования обращают внимание на тот факт, что снижение частоты ЯК после аппендэктомии наблюдалось преимущественно у пациентов в возрасте до 20 лет [63]. В настоящее время результаты сравнения показывают достаточно противоречивые данные [64].
Самое недавнее исследование, в котором был проведен скрининг шведской национальной когорты из более чем 63 000 пациентов с ЯК, показало, что аппендэктомия в молодом возрасте, до развития заболевания, связана с более низким риском колэктомии. Напротив, удаление червеобразного отростка по поводу аппендицита после развития язвенного колита связано с более тяжелым течением заболевания и более высокой частотой колэктомии [65]. В эксперименте на мышах была показана взаимосвязь развития ВЗК и аппендэктомии. Аппендэктомия без аппендицита повышала частоту дисплазии толстой кишки и повышала риск колоректальной неоплазии с последующей колэктомией. Однако аппендэктомия по поводу аппендицита улучшала течение ВЗК, снижалась частота развития и осложнений [66]. В еще одной «мышиной» модели S. Welsh et al. показывают, что аппендэктомия до постановки диагноза «ЯК» снижает риск колэктомии в будущем, но значимость теряется, когда аппендэктомия выполняется после начала заболевания. Большинство (от 71 до 100%) пациентов с рефрактерным ЯК избегают колэктомии после терапевтической аппендэктомии при 3-летнем наблюдении [67]. Таким образом, кажется, что аппендэктомия, выполненная по поводу аппендицита в молодом возрасте и только в этих конкретных условиях, защищает от развития ЯК [68].
Поскольку микробы и иммунная система очень тесно связаны в кишечнике, трудно полностью разделить эти два фактора при обсуждении патогенеза ВЗК [69]. Некоторые патогены, связанные с ВЗК, включают Mycobacterium avium, Clostridium difficile, Escherichia coli, Listeria monocytogenes, Campilobacteraceae и др. Интересно, что у пациентов с ЯК снижается количество бокаловидных клеток, продуцирующих муцин, что приводит к истончению слизистого слоя толстой кишки и нарушению слизистой оболочки с изменениями микробного состава даже в не вовлеченном терминальном отделе подвздошной кишки [70]. В результате бактерии могут проникать в эпителиальные клетки и стимулировать иммунитет клеток хозяев у генетически восприимчивых людей [71]. Кроме того, J.P. Motta et al. показали, что кишечные биопленки разрушаются при язвенном колите (возможно, это связано с более тонким слизистым слоем, наблюдаемым в толстой кишке). Это может привести к рассеиванию патобионтов, которые затем могут проникнуть в эпителиальные клетки кишечника и вызвать воспаление толстой кишки. Предполагается, что как раз именно аппендикс может заселять толстую кишку патобионтами (вместо комменсалов), подпитывая воспаление, а его удаление может предотвратить расселение патобионтов [72]. Помимо возможной причинно-следственной связи с Fusobacterium varium, бактерии, которые сильно коррелируют с началом ЯК, еще не выделены [73]. Хотя дисбактериоз часто наблюдается у пациентов с ЯК, этот дисбиоз варьирует у разных людей [74].
В противовес этому, если рассматривать аппендикс как лимфоидный орган, различные типы иммунных клеток, в т. ч. антигенпрезентирующие клетки (дендритные клетки и макрофаги), Т-хелперы (Th), регуляторные Т-клетки (Treg) и естественные Т-киллеры (NKT), играют важную роль в патогенезе язвенного колита посредством индукции, регуляции и подавления воспаления. В этот воспалительный процесс вовлечены провоспалительные цитокины, такие как фактор некроза опухоли (TNF)-α, интерлейкин (IL)-6, IL-9, IL-13 и IL-33. Активированные CD4+Т-клетки, продуцирующие медиаторы воспаления и цитокины, играют решающую роль в патогенезе язвенного колита. Действительно, считалось, что клетки Th2 и их цитокины, в частности IL-4, влияют на развитие язвенного колита [75]. Учитывая очевидную роль аппендикса как лимфоидного органа в поддержании микробиоты, можно ожидать, что его удаление будет иметь пагубные последствия [76].
Заключение
Данный литературный обзор
обобщает ранее полученные данные о микробиоте червеобразного отростка и
представляет доказательства различий бактериальных сообществ между больными и
здоровыми аппендиксами. В отечественной литературе исследования микробиоты
аппендикса и ее вариации при различных заболеваниях (острый аппендицит, ВЗК) не
являются основополагающими и остаются недостаточно изученными. Учитывая
современные зарубежные данные об участии аппендикса во множестве
физиологических и патологических процессах, представляется необходимым сосредоточить
будущие исследования на значении и разнообразии микробиома в аппендиксе при
разных клинических формах.
Список литературы / References
- Jumah S, Wester T. Non operative management facute appendicitis in children. Pediatr Surg Int. 2023;39(1):11. https://doi.org/10.1007/s00383-022-05284-y.
- Лысов АЕ, Гаглоев ВМ, Павлова ТВ, Сниткин НА, Тулинов АИ, Тома АН, Черников АН. Опыт лапароскопической аппендэктомии при остром аппендиците у детей. Актуальные проблемы медицины. 2013;154(11):77-79. Режим доступа: https://bsuedu.ru/bsu/science/public/bsu-science-journal/detail.php?IBLOCK_ID=106&SECTION_ID=572&ELEMENT_ID=241554. Lysov AE, Gagloev VM, Pavlova TV, Snitkin NA, Tulinov AI, Toma AN, Chernikov AN. Experience of laparoscopic appendectomy in acute appendicitis in children. Challenges in Modern Medicine. 2013;154(11):77-79. (In Russ.) Available at: https://bsuedu.ru/bsu/science/public/bsu-science-journal/detail.php?IBLOCK_ID=106&SECTION_ID=572&ELEMENT_ID=241554.
- Esposito C, Calvo AI, Castagnetti M, Alicchio F, Suarez C, Giurin I, Settimi A. Open versus laparoscopic appendectomy in the pediatric population: a literature review and analysis of complications. J Laparoendosc Adv Surg Tech A. 2012;22(8):834-839. https://doi.org/10.1089/lap.2011.0492.
- Разумовский АЮ, Дронов АФ, Смирнов АН, Голованов МА. Острый аппендицит у детей: клинические рекомендации. М.; 2013. Режим доступа: https://diseases.medelement.com/disease/острый-аппендицит-у-детейрекомендации-рф/15770.
- Ferris M, Quan S, Kaplan BS, Molodecky N, Ball CG, Chernoff GW et al. The global incidence of appendicitis: a systematic review of population-based studies. Ann Surg. 2017;266(2):237-241. https://doi.org/10.1097/SLA.0000000000002188.
- Gorter RR, Eker HH, Gorter-Stam MA, Abis GS, Acharya A, Ankersmit M еt al. Diagnosis and management of acute appendicitis. EAES consensus development conference 2015. Surg Endosc. 2016;30(11):4668-4690. https://doi.org/10.1007/s00464-016-5245-7.
- Perez KS, Allen SR. Complicated appendicitis and considerations for interval appendectomy. JAAPA. 2018;31(9):35-41. https://doi.org/10.1097/01.JAA.0000544304.30954.40.
- Meljnikov I, Radojcić B, Grebeldinger S, Radojcić N. History of surgical treatment of appendicitis. Med Pregl. 2009;62(9-10):489-492. Available at: https://pubmed.ncbi.nlm.nih.gov/20391748.
- Gorter RR, The SML, Gorter-Stam MAW, Eker HH, Bakx R, van der Lee JH, Heij HA. Systematic review of nonoperative versus operative treatment of uncomplicated appendicitis. J Pediatr Surg. 2017;52(8):1219-1227. https://doi.org/10.1016/j.jpedsurg.2017.04.005.
- Engin O, Muratli A, Ucar AD, Tekin V, Calik B, Tosun A. The importance of fecaliths in the aetiology of acute appendicitis. Chirurgia (Bucur). 2012;107(6):756-760. Available at: https://pubmed.ncbi.nlm.nih.gov/23294954.
- Carr NJ. The pathology of acute appendicitis. Ann Diagn Pathol. 2000;4(1):46-58. https://doi.org/10.1016/s1092-9134(00)90011-x.
- Forbes GB, Lloyd-Davies RW. Calculous disease of the vermiform appendix. Gut. 1966;7(6):583-592. https://doi.org/10.1136/gut.7.6.583.
- Felber J, Gross B, Rahrisch A, Waltersbacher E, Trips E, Schröttner P et al. Bacterial pathogens in pediatric appendicitis: a comprehensive retrospective study. Front Cell Infect Microbiol. 2023;13:1027769. https://doi.org/10.3389/fcimb.2023.1027769.
- Bhaskar K, Clarke S, Moore LSP, Hughes S. Bacterial peritonitis in paediatric appendicitis; microbial epidemiology and antimicrobial management. Ann Clin Microbiol Antimicrob. 2023;22(1):45. https://doi.org/10.1186/s12941-023-00591-1.
- Maita S, Andersson B, Svensson JF, Wester T. Nonoperative treatment for nonperforated appendicitis in children: a systematic review and meta-analysis. Pediatr Surg Int. 2020;36(3):261-269. https://doi.org/10.1007/s00383-019-04610-1.
- Bhangu A, Søreide K, Di Saverio S, Assarsson JH, Drake FT. Acute appendicitis: modern understanding of pathogenesis, diagnosis, and management. Lancet. 2015;386(10000):1278-1287. https://doi.org/10.1016/S0140-6736(15)00275-5.
- Kooо6(1):1-9. https://doi.org/10.1111/cei.12821.
- Mohammad AA. The human vermiform appendix: morphological and anatomical review. Probl Sotsialnoi Gig Zdravookhranenniiai Istor Med. 2023;31(5):990-995. https://doi.org/10.32687/0869-866X-2023-31-5-990-995.
- Wczysla K. Appendix somewhat different - Excerpts from the history, controversies of the present and view to the future. Chirurgie (Heidelb). 2022;93(6):610-621. (In German) https://doi.org/10.1007/s00104-021-01556-w.
- Smith HF, Fisher RE, Everett ML, Thomas AD, Bollinger RR, Parker W. Comparative anatomy and phylogenetic distribution of the mammalian cecal appendix. J Evol Biol. 2009;22(10):1984-1999. https://doi.org/10.1111/j.1420-9101.2009.01809.x.
- Ross MH, Pawlina W. Histology: a text and atlas with correlated cell and molecular biology. Baltimore: Lippincott Williams & Wilkins; 2010.
- Senda T, Dogra P, Granot T, Furuhashi K, Snyder ME, Carpenter DJ et al. Microanatomical dissection of human intestinal T-cell immunity reveals site-specific changes in gut-associated lymphoid tissues over life. Mucosal Immunol. 2019;12(2):378-389. https://doi.org/10.1038/s41385-018-0110-8.
- Kooij IA, Sahami S, Meijer SL, Buskens CJ, Te Velde AA. The immunology of the vermiform appendix: a review of the literature. Clin Exp Immunol. 2016;186(1):1-9. https://doi.org/10.1111/cei.12821.
- Ishimoto Y, Tomiyama-Miyaji C, Watanabe H, Yokoyama H, Ebe K, Tsubata S et al. Age-dependent variation in the proportion and number of intestinal lymphocyte subsets, especially natural killer T cells, double-positive CD4+ CD8+ cells and B220+ T cells, in mice. Immunology. 2004;113(3):371-377. https://doi.org/10.1111/j.1365-2567.2004.01961.x.
- Hanson NB, Lanning DK. Microbial induction of B and T cell areas in rabbit appendix. Dev Comp Immunol. 2008;32(8):980-991. https://doi.org/10.1016/j.dci.2008.01.013.
- Armstrong H, Alipour M, Valcheva R, Bording-Jorgensen M, Jovel J, Zaidi D et al. Host immunoglobulin G selectively identifies pathobionts in pediatric inflammatory bowel diseases. Microbiome. 2019;7(1):1. https://doi.org/10.1186/s40168-018-0604-3.
- Li Y, Liu J, Liu G, Pan Z, Zhang M, Ma Y et al. Murine Appendectomy Model of Chronic Colitis Associated Colorectal Cancer by Precise Localization of Caecal Patch. J Vis Exp. 2019;(150):e59921. https://doi.org/10.3791/59921.
- Macfarlane S. Microbial biofilm communities in the gastrointestinal tract. J Clin Gastroenterol. 2008;42(3):142-143. https://doi.org/10.1097/MCG.0b013e31816207df.
- Johansson ME, Phillipson M, Petersson J, Velcich A, Holm L, Hansson GC. The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria. Proc Natl Acad Sci U S A. 2008;105(39):15064-150649. https://doi.org/10.1073/pnas.0803124105.
- Randal Bollinger R, Barbas AS, Bush EL, Lin SS, Parker W. Biofilms in the large bowel suggest an apparent function of the human vermiform appendix. J Theor Biol. 2007;249(4):826-831. https://doi.org/10.1016/j.jtbi.2007.08.032.
- Palestrant D, Holzknecht ZE, Collins BH, Parker W, Miller SE, Bollinger RR. Microbial biofilms in the gut: visualization by electron microscopy and by acridine orange staining. Ultrastruct Pathol. 2004;28(1):23-27. https://doi.org/10.1080/01913120490275196.
- Abelson M, McLaughlin J. Of biomes, biofilm and the ocular surface. Rev Opthalmol. 2012;(19):52-54. Available at: https://www.reviewofophthalmology.com/article/of-biomes-biofilm-and-the-ocular-surface.
- Murphy K, Travers P, Janeway C, Walport M. J aneway’s immunobiology. 8th ed. New York: Garland Science; 2012. 868 p.
- Laurin M, Everett ML, Parker W. The cecal appendix: one more immune component with a function disturbed by post-industrial culture. Anat Rec (Hoboken). 2011;294(4):567-579. https://doi.org/10.1002/ar.21357.
- Karl JP, Hatch AM, Arcidiacono SM, Pearce SC, Pantoja-Feliciano IG, Doherty LA, Soares JW. Effects of Psychological, Environmental and Physical Stressors on the Gut Microbiota. Front Microbiol. 2018;9:2013. https://doi.org/10.3389/fmicb.2018.02013.
- Guinane CM, Tadrous A, Fouhy F, Ryan CA, Dempsey EM, Murphy B et al. Microbial composition of human appendices from patients following appendectomy. mBio. 2013;4(1):e00366-12. https://doi.org/10.1128/mBio.00366-12.
- Heindl SE, Tsouklidis N. Appendectomy as a Potential Predisposing Factor for the Development of Recurrent and Fulminant Clostridium Difficile. Cureus. 2020;12(8):e10091. https://doi.org/10.7759/cureus.10091.
- Laurin M, Everett ML, Parker W. The cecal appendix: one more immune component with a function disturbed by post-industrial culture. Anat Rec (Hoboken). 2011;294(4):567-579. https://doi.org/10.1002/ar.21357.
- Carr NJ. The pathology of acute appendicitis. Ann Diagn Pathol. 2000;4(1):46-58. https://doi.org/10.1016/s1092-9134(00)90011-x.
- de Costa A. The appendix-mucosal immunity and tolerance in the gut: consequences for the syndromes of appendicitis and its epidemiology. ANZ J Surg. 2022;92(4):653-660. https://doi.org/10.1111/ans.17522.
- Antonsen J, Winther-Jensen M, Krogsbøll LT, Jess T, Jorgensen LN, Allin KH. Non-culture-based studies of the appendiceal microbiota: a systematic review. Future Microbiol. 2023;18:205-216. https://doi.org/10.2217/fmb-2022-0194.
- Kakar M, Reinis A, Kroica J, Engelis A, Broks R, Asare L et al. Microbiota Assessment of Pediatric Simple and Complex Acute Appendicitis. Medicina (Kaunas). 2022;58(9):1144. https://doi.org/10.3390/medicina58091144.
- Vanhatalo S, Munukka E, Kallonen T, Sippola S, Grönroos J, Haijanen J et al. Appendiceal microbiome in uncomplicated and complicated acute appendicitis: A prospective cohort study. PLoS ONE. 2022;17(10):e0276007. https://doi.org/10.1371/journal.pone.0276007.
- Munakata S, Tohya M, Matsuzawa H, Tsuchiya Y, Amemiya K, Hagiwara T et al. Analysis of appendectomy samples identified dysbiosis in acute appendicitis. Biosci Microbiota Food Health. 2021;40(2):92-97. https://doi.org/10.12938/bmfh.2020-051.
- Bi Y, Yang Q, Li J, Zhao X, Yan B, Li X, Cui H. The Gut Microbiota and Inflammatory Factors in Pediatric Appendicitis. Dis Markers. 2022;2022:1059445. https://doi.org/10.1155/2022/1059445.
- Jackson HT, Mongodin EF, Davenport KP, Fraser CM, Sandler AD, Zeichner SL. Culture-independent evaluation of the appendix and rectum microbiomes in children with and without appendicitis. PLoS ONE. 2014;9(4):e95414. https://doi.org/10.1371/journal.pone.0095414.
- Antonsen J, Winther-Jensen M, Krogsbøll LT, Jess T, Jorgensen LN, Allin KH. Non-culture-based studies of the appendiceal microbiota: a systematic review. Future Microbiol. 2023;18:205-216. https://doi.org/10.2217/fmb2022-0194.
- Salö M, Marungruang N, Roth B, Sundberg T, Stenström P, Arnbjörnsson E et al. Evaluation of the microbiome in children’s appendicitis. Int J Colorectal Dis. 2017;32(1):19-28. https://doi.org/10.1007/s00384-016-2639-x.
- Salö M, Marungruang N, Roth B, Sundberg T, Stenström P, Arnbjörnsson E et al. Evaluation of the microbiome in children’s appendicitis. Int J Colorectal Dis. 2017;32(1):19-28. https://doi.org/10.1007/s00384-016-2639-x.
- he SML, de Meij TGJ, Budding AE, Bakx R, van der Lee JH, Poort L et аl. The potential of rectal swabs to differentiate simple and complex appendicitis in children with a microbiota-based test. Eur J Pediatr. 2022;181(12): 4221-4226. https://doi.org/10.1007/s00431-022-04627-0.
- Swidsinski A, Dörffel Y, Loening-Baucke V, Theissig F, Rückert JC, Ismail M et al. Acute appendicitis is characterised by local invasion with Fusobacterium nucleatum/necrophorum. Gut. 2011;60(1):34-40. https://doi.org/10.1136/gut.2009.191320.
- Rauthan K, Joshi S, Kumar L, Goel D, Kumar S. Functional annotation of uncharacterized proteins from Fusobacterium nucleatum: identification of virulence factors. Genomics Inform. 2023;21(2):e21. https://doi.org/10.5808/gi.22065.
- The SML, Bakx R, Budding AE, de Meij TGJ, van der Lee JH, Bunders MJ et al. Microbiota of Children With Complex Appendicitis: Different Composition and Diversity of The Microbiota in Children With Complex Compared With Simple Appendicitis. Pediatr Infect Dis J. 2019;38(10):1054-1060. https://doi.org/10.1097/INF.0000000000002434.
- Kitamoto S, Nagao-Kitamoto H, Hein R, Schmidt TM, Kamada N. The Bacterial Connection between the Oral Cavity and the Gut Diseases. J Dent Res. 2020;99(9):1021-1029. https://doi.org/10.1177/0022034520924633.
- Blod C, Schlichting N, Schülin S, Suttkus A, Peukert N, Stingu CS et al. The oral microbiome-the relevant reservoir for acute pediatric appendicitis? Int J Colorectal Dis. 2018;33(2):209-218. https://doi.org/10.1007/s00384-017-2948-8.
- Rogers MB, Brower-Sinning R, Firek B, Zhong D, Morowitz MJ. Acute Appendicitis in Children Is Associated With a Local Expansion of Fusobacteria. Clin Infect Dis. 2016;63(1):71-78. https://doi.org/10.1093/cid/ciw208.
- Hattori T, Yuasa N, Ikegami S, Nishiyama H, Takeuchi E, Miyake H et al. Culture-based bacterial evaluation of the appendix lumen in patients with and without acute appendicitis. J Infect Chemother. 2019;25(9):708-713. https://doi.org/10.1016/j.jiac.2019.03.021.
- Zhong D, Brower-Sinning R, Firek B, Morowitz MJ. Acute appendicitis in children is associated with an abundance of bacteria from the phylum Fusobacteria. J Pediatr Surg. 2014;49(3):441-446. https://doi.org/10.1016/j.jpedsurg.2013.06.026.
- Oh SJ, Pimentel M, Leite GGS, Celly S, Villanueva-Millan MJ, Lacsina I et al. Acute appendicitis is associated with appendiceal microbiome changes including elevated Campylobacter jejuni levels. BMJ Open Gastroenterol. 2020;7(1):e000412. https://doi.org/10.1136/bmjgast-2020-000412.
- Rogers MB, Brower-Sinning R, Firek B, Zhong D, Morowitz MJ. Acute Appendicitis in Children Is Associated With a Local Expansion of Fusobacteria. Clin Infect Dis. 2016;63(1):71-78. https://doi.org/10.1093/cid/ciw208.
- Ng SC, Tang W, Leong RW, Chen M, Ko Y, Studd C et al. Asia-Pacific Crohn’s and Colitis Epidemiology Study ACCESS Group. Environmental risk factors in inflammatory bowel disease: a population-based case-control study in AsiaPacific. Gut. 2015;64(7):1063-1071. https://doi.org/10.1136/gutjnl-2014-307410.
- Gilat T, Hacohen D, Lilos P, Langman MJ. Childhood factors in ulcerative colitis and Crohn’s disease. An international cooperative study. Scand J Gastroenterol. 1987;22(8):1009-1024. https://doi.org/10.3109/00365528708991950.
- de Saussure P, Clerson P, Prost PL, Truong Tan N, Bouhnik Y, Gil-Rch. Appendectomy, smoking habits and the risk of developing ulcerative colitis: a case control study in private practice setting. Gastroenterol Clin Biol. 2007;31(5):493-497. https://doi.org/10.1016/s0399-8320(07)89417-6.
- Deng P, Wu J. Meta-analysis of the association between appendiceal orifice inflammation and appendectomy and ulcerative colitis. Rev Esp Enferm Dig. 2016;108(7):401-410. https://doi.org/10.17235/reed.2016.4176/2015.
- Myrelid P, Landerholm K, Nordenvall C, Pinkney TD, Andersson RE. Appendectomy and the Risk of Colectomy in Ulcerative Colitis: A National Cohort Study. Am J Gastroenterol. 2017;112(8):1311-1319. https://doi.org/10.1038/ajg.2017.183.
- Harnoy Y, Bouhnik Y, Gault N, Maggiori L, Sulpice L, Cazals-Hatem D et al. Effect of appendicectomy on colonic inflammation and neoplasia in experimental ulcerative colitis. Br J Surg. 2016;103(11):1530-1538. https://doi.org/10.1002/bjs.10209.
- Welsh S, Sam Z, Seenan JP, Nicholson GA. The Role of Appendicectomy in Ulcerative Colitis: Systematic Review and Meta-Analysis. Inflamm Bowel Dis. 2023;29(4):633-646. https://doi.org/10.1093/ibd/izac127.
- Sahami S, Kooij IA, Meijer SL, Van den Brink GR, Buskens CJ, Te Velde AA. The Link between the Appendix and Ulcerative Colitis: Clinical Relevance and Potential Immunological Mechanisms. Am J Gastroenterol. 2016;111(2):163-169. https://doi.org/10.1038/ajg.2015.301.
- Peloquin JM, Nguyen DD. The microbiota and inflammatory bowel disease: insights from animal models. Anaerobe. 2013;24:102-106. https://doi.org/10.1016/j.anaerobe.2013.04.006.
- Alipour M, Zaidi D, Valcheva R, Jovel J, Martínez I, Sergi C et al. Mucosal Barrier Depletion and Loss of Bacterial Diversity are Primary Abnormalities in Paediatric Ulcerative Colitis. J Crohns Colitis. 2016;10(4):462-471. https://doi.org/10.1093/ecco-jcc/jjv223.
- Park JH, Peyrin-Biroulet L, Eisenhut M, Shin JI. IBD immunopathogenesis: A comprehensive review of inflammatory molecules. Autoimmun Rev. 2017;16(4):416-426. https://doi.org/10.1016/j.autrev.2017.02.013.
- Motta JP, Allain T, Green-Harrison LE, Groves RA, Feener T, Ramay H et al. Iron Sequestration in Microbiota Biofilms As A Novel Strategy for Treating Inflammatory Bowel Disease. Inflamm Bowel Dis. 2018;24(7):1493-1502. https://doi.org/10.1093/ibd/izy116.
- Ohkusa T, Sato N, Ogihara T, Morita K, Ogawa M, Okayasu I. Fusobacterium varium localized in the colonic mucosa of patients with ulcerative colitis stimulates species-specific antibody. J Gastroenterol Hepatol. 2002;17(8):849-853. https://doi.org/10.1046/j.1440-1746.2002.02834.x.
- Nagalingam NA, Lynch SV. Role of the microbiota in inflammatory bowel diseases. Inflamm Bowel Dis. 2012;18(5):968-984. https://doi.org/10.1002/ibd.21866.
- Tatiya-Aphiradee N, Chatuphonprasert W, Jarukamjorn K. Immune response and inflammatory pathway of ulcerative colitis. J Basic Clin Physiol Pharmacol. 2018;30(1):1-10. https://doi.org/10.1515/jbcpp-2018-0036.
- Andreu-Ballester JC, Pérez-Griera J, Ballester F, Colomer-Rubio E, Ortiz-Tarín I, Peñarroja Otero C. Secretory immunoglobulin A (sIgA) deficiency in serum of patients with GALTectomy (appendectomy and tonsillectomy). Clin Immunol. 2007;123(3):289-297. https://doi.org/10.1016/j.clim.2007.02.004.








