
В.И. ПОПАДЮК, д.м.н., профессор, А.И. ЧЕРНОЛЕВ, к.м.н., И.А. КОРШУНОВА, к.м.н., Российский университет дружбы народов, Москва
Патология полости носа и околоносовых пазух воспалительного характера является одной из самых актуальных в современной оториноларингологии. Среди пациентов, находящихся на стационарном лечении в оториноларингологических отделениях, воспалительные заболевания околоносовых пазух составляют до 36%. Современные макролиды (прежде всего кларитромицин и азитромицин) относятся к числу наиболее часто применяемых в амбулаторной практике антибиотиков. Возрождение интереса к макролидным антибиотикам было обусловлено возросшим клиническим значением в инфекционной патологии внутриклеточных патогенов, в отношении которых макролиды демонстрировали беспрецедентную активность.
Риносинуситом называют воспаление слизистой оболочки полости носа и околоносовых пазух [1]. Основными возбудителями острого бактериального риносинусита считаются Streptococcus pneumoniae и Haemophilus influenzae. Среди прочих возбудителей называют Moraxella catarrhalis, Staphylococcus aureus, Streptococcus pyogenes, Streptococcus viridans и др. Основными анаэробными возбудителями риносинусита являются анаэробные стрептококки [1, 6, 7]. Однако спектр возбудителей острого бактериального риносинусита может существенно варьировать в зависимости от географических, социально-экономических и прочих условий. Перечень возбудителей внутрибольничных, развившихся на фоне иммунодефицитных состояний и одонтогенных риносинуситов, наряду с упомянутыми выше бактериями, включает Staphylococcus epidermidis, Proteus, а также сапрофитные бактерии и грибковую микрофлору. В последние годы обсуждается роль хламидий и другой атипичной микрофлоры в этиологии риносинусита [2—5].
Пусковым моментом в развитии острого бактериального риносинусита обычно бывает ОРВИ. Выявлено, что почти у 90% больных ОРВИ в околоносовых пазухах выявляются изменения в виде отека слизистой оболочки и застоя секрета. Однако лишь у 1--2% таких больных развивается острый бактериальный риносинусит.
В развитии хронического риносинусита, помимо нарушений мукоцилиарного транспорта, важную роль играют аномалии строения внутриносовых структур и решетчатого лабиринта, блокирующие проходимость естественных отверстий околоносовых пазух и нарушающие механизмы очищения пазух [1, 6, 7]. Наличие двух или более соустий верхнечелюстных пазух также создает условия для заброса уже побывавшей в полости носа и инфицированной слизи обратно в пазуху. В условиях хронического воспаления в слизистой оболочке происходит очаговая или диффузная метаплазия многорядного цилиндрического эпителия в многослойный, лишенный ресничек и утративший способность удалять со своей поверхности бактерии и вирусы путем активного мукоцилиарного транспорта [1].
В настоящее время для лечения синуситов активно применяются антибиотики группы макролидов. Всего известно более 20 макролидов. Основу химической структуры макролидов составляет макроциклическое лактонное кольцо, связанное с одним или несколькими углеводными остатками. В зависимости от числа атомов углерода в гетероциклической структуре макролидные антибиотики подразделяются на 14-членные (природные -- эритромицин, олеандомицин, полусинтетические -- кларитромицин, рокситромицин, диритромицин), 15-членные (азалиды) -- азитромицин (полусинтетический препарат) и 16-членные -- природные (спирамицин, джозамицин) и полусинтетические (рокитамицин и мидекамицин).
Современные макролиды, прежде всего кларитромицин и азитромицин, относятся к числу наиболее часто применяемых в амбулаторной практике антибиотиков. В США в период с 1992 по 2000 г. было отмечено 4-кратное возрастание частоты назначений кларитромицина на фоне сокращения использования аминопенициллинов и эритромицина [3, 4]. Негативным эффектом широкого использования данной группы антибиотиков является повсеместный рост устойчивости к макролидам у возбудителей внебольничных инфекций [5--7].
Кларитромицин в экспериментах in vitro уступает азитромицину по активности в отношении Haemophilus influenzae, однако in vivo его антибактериальное действие усиливается за счет активного метаболита 14-гидрокси-кларитромицина. Препарат демонстрирует также наилучший эффект при инфекции, вызванной метициллиночувствительными штаммами S. aureus. И наконец, устойчивость кларитромицина в кислой среде эндосом повышает активность препарата в отношении таких внутриклеточных паразитов, как Legionella pneumophila и Chlamydophila pneumoniae. Препарат демонстрирует высокую и сравнимую с другими макролидами активность в отношении Mycoplasma pneumoniae. Грамотрицательные бактерии семейства Enterobacteriaceae, Pseudomonas и Acinetobacter обладают природной устойчивостью ко всем макролидным антибиотикам [6]. Бета-лактамазы не влияют на активность кларитромицина.
Нами было проведено открытое сравнительное рандомизированное клиническое испытание эффективности, переносимости и безопасности лекарственного средства Экозитрин, таблетки, покрытые оболочкой 500 мг, производства ОАО «АВВА РУС» (Россия) и оригинального лекарственного средства Клацид, таблетки, покрытые оболочкой 500 мг, производства Abbott S.r.l. (Италия) у пациентов, страдающих острым бактериальным синуситом и обострением хронического синусита средней степени тяжести в параллельных группах пациентов с активным контролем. Экозитрин, помимо кларитромицина, содержит пребиотик лактулозу. Лактулоза является синтетическим дисахаридом, молекула которого состоит из остатков галактозы и фруктозы. Лактулоза в желудке и верхних отделах кишечника не всасывается и не гидролизуется. Высвобождающаяся из таблеток Экозитрина лактулоза в качестве субстрата ферментируется нормальной микрофлорой толстого кишечника, стимулируя рост бифидобактерий и лактобацилл. В результате гидролиза лактулозы в толстом кишечнике образуются органические кислоты — молочная, уксусная и муравьиная, подавляющие рост патогенных микроорганизмов и уменьшающие вследствие этого продукцию азотсодержащих токсических веществ [9]. Таким образом, лактулоза в составе Экозитрина оказывает протективное действие на нормальную микрофлору кишечника, уменьшает явления интоксикации и нивелирует риск развития побочных эффектов, связанных с дисбиозами. Кроме того, существует ряд данных, позволяющих предполагать участие некоторых пребиотиков (в т. ч. и лактулозы) в повышении иммунного ответа [10].
Лактулоза, входящая в состав Экозитрина, не оказывает влияние на основные фармакокинетические параметры, характеризующие биодоступность кларитромицина.
Целью нашего исследования являлась оценка сравнительной эффективности, переносимости и безопасности лекарственного средства Экозитрин и оригинального лекарственного средства Клацид у пациентов с острым бактериальным синуситом и обострением хронического синусита средней степени тяжести.
В обеих сформированных группах проводилась терапия по одинаковой схеме: внутрь по 500 мг (Экозитрин или Клацид) 2 раза в день через 12 ч в течение 10 дней. Продолжительность участия пациента в испытании не менее 24 дней. Из них: период пребывания в стационаре составлял 10 дней (период лечения) и последующее наблюдение -- 14 дней.
Критериями включения в исследование были:
1) возраст 18--65 лет,
2) клинически, лабораторно и инструментально верифицированный диагноз острого бактериального синусита или обострения хронического синусита средней степени тяжести любой локализации с гнойным или слизисто-гнойным отделяемым,
3) способность пациента выполнять предписания врача и соблюдать необходимые рекомендации,
4) Наличие подписанного информированного согласия пациента.
Количество скринированных пациентов -- 61 (30 человек в основной и 31 -- в контрольной группе). Количество рандомизированных пациентов -- 61 (30 человек в основной и 31 -- в контрольной группе). Включено в анализ эффективности -- 60 (30 человек в основной и 30 -- в контрольной группе). Включено в анализ безопасности -- 61 (30 человек в основной и 31 -- в контрольной группе).
Критерии эффективности были установлены следующие:
- показатель клинической эффективности определялся по оценке клинических симптомов заболевания на момент начала лечения и на момент окончания лечения на основании:
- субъективной оценки пациента: наличие выделений из носа, заложенности носа, умеренной боли (чувства давления, наполнения) в области лица и периорбитальных областях, которая может также проявляться локализованной или диффузной головной болью,
- объективных данных клинического осмотра: наличие лихорадки, признаков воспалительного процесса в ОНП по данным риноскопии;
- динамика уровня лейкоцитов крови, показателей лейкоцитарной формулы, СОЭ, СРБ;
- динамика показателей рентгенографического исследования;
- процент пациентов с клиническим выздоровлением в каждой группе;
- процент пациентов с клинической неэффективностью;
- процент пациентов с клиническим рецидивом либо обострением в каждой группе;
- процент пациентов с неопределенным результатом.
Открытое сравнительное рандомизированное клиническое испытание эффективности и безопасности в параллельных группах пациентов с активным контролем проводилось до достижения 60 законченных случаев лечения пациентов с острым бактериальным синуситом и обострением хронического синусита средней степеней тяжести.
Средний возраст пациентов составил 36,8 ± 14,1 года в группе 1 (Экозитрин) и 35,0 ± 15,0 года в группе 2 (Клацид), р = 0,484. В исследование были включены 12/30 (40,0%) мужчин и 18/30 (60,0%) женщин, которые были рандомизированы в группу 1, и 15/31 (48,4%) мужчин и 16/31 (51,6%) женщин, которые были рандомизированы в группу 2. По представленным данным статистически значимых различий между группами лечения выявлено не было.
Клиническое выздоровление определяли согласно протоколу как полное исчезновение всех субъективных и объективных клинических признаков заболевания (лихорадка, головная боль, болезненность при пальпации, заложенность носа, гнойное отделяемое, изменения лабораторных показателей крови) после завершения антимикробной терапии и в отдаленный период. На рентгенограмме на 10-й день отсутствует затемнение и горизонтальные уровни жидкости в пазухах, может сохраняться пристеночное затемнение.
Клиническую неэффективность определяли как отсутствие улучшения состояния пациента после 72-часового лечения или невозможность продолжать лечение из-за серьезных нежелательных явлений. Рецидив определяли как повторное появление клинической картины заболевания или возникновение новых клинических проявлений синусита в первые 14 дней после завершения лечения.
Неопределенный результат констатировали, если по тем или иным причинам не удавалось интерпретировать результаты лечения как эффективность или неэффективность.
На момент окончания исследования клиническое выздоровление наблюдалось у 24/30 (80%) пациентов в группе 1 и у 26/30 (86,7%) пациентов в группе 2. Неопределенный результат наблюдался у 6/30 (20%) пациентов в группе 1 и у 4/30 (13,3%) пациентов в группе 2. Случаев клинической неэффективности не наблюдалось. Случаев рецидива заболевания не наблюдалось. Отношение шансов для клинического выздоровления составило 0,62 (95% ДИ от 0,15 до 2,45). Отношение шансов для неопределенного результата составило 1,63 (95% ДИ от 0,41 до 6,47). Статистически значимых различий по эффективности терапии между основной и контрольной группами выявлено не было (табл. 1).
| Таблица 1. Оценка эффективности | ||||
|
Параметр |
Группа 1 Экозитрин (n = 30) |
Группа 2 Клацид (n = 30) |
Размер эффекта, ОШ (95% ДИ) |
р-величина |
|
Клиническое выздоровление |
24 (80%) |
26 (86,7%) |
0,62 (от 0,15 до 2,45) | 0,729 |
| Неопределенный результат | 6 (20%) |
4 (13,3%) |
1,63 (от 0,41 до 6,47) |
0,729 |
|
Клиническая неэффективность |
0 (0%) |
0 (0%) | - | - |
Статистически значимые различия по изменению показателей общего анализа крови (ОАК) на последнем визите по отношению к первому в группе 1 наблюдались по показателям: СОЭ (р = 0,001), лейкоциты (р = 0,002), нейтрофилы палочкоядерные (р = 0,012). Статистически значимые различия по изменению показателей ОАК на последнем визите по отношению к первому в группе 2 наблюдались по показателям: СОЭ (р < 0,001), моноциты (р < 0,001), нейтрофилы сегментоядерные (р = 0,026). Полученные результаты можно объяснить положительной динамикой состояния пациентов и нормализацией значений показателей ОАК во время лечения. Статистически значимые различия по изменению показателей ОАК на последнем визите по отношению к первому между группами 1 и 2 наблюдались по показателю процента моноцитов (р = 0,003), по остальным показателям ОАК статистически значимые различия отсутствовали (табл. 2).

Эти изменения, возможно, связаны с эффектами лактулозы, входящей в состав препарата Экозитрин, поскольку, как уже упоминалось, существует ряд данных об иммуномодулирующем действии лактулозы. Так, большой интерес представляют данные о стимуляции лактулозой В-лимфоцитов MALT-системы (отдельные клеточные лимфоидные элементы, ассоциированные со слизистой оболочкой), в результате чего повышается продукция секреторного IgA, в то же время ингибируется синтез ФНО-α (фактор некроза опухоли-альфа) макрофагами и Т-лимфоцитами. Последнее может быть связано с подавлением механизмов транслокации бактерий, а также с упомянутым выше сокращением количества Еnterobacteriaceae, что уменьшает образование внутрипросветного и системного эндотоксина [11—15]. Противовоспалительные эффекты лактулозы были исследованы и на некоторых моделях животных с интестинальным воспалением. У мыши с генетически обусловленным дефицитом IL-10 спонтанно развивается колит. Сразу после рождения модифицированные мыши имеют пониженный уровень лактобацилл в толстом кишечнике. Пероральное введение лактулозы приводило к нормализации количества лактобацилл в фекалиях и предупреждало развитие колита [16]. Изучения на животных и данные, полученные в клеточной культуре in vitro, подтвердили возможность определенных пребиотиков (в т. ч. и лактулозы) препятствовать воспалительным и злокачественным процессам в толстом кишечнике [17]. Предполагается, что использование пребиотиков (лактулозы), способствует стимуляции синтеза короткоцепочечных жирных кислот (кишечной формы ассоциированной с лимфоидной тканью) которые могут оказывать влияние на иммунную модуляцию благодаря способности увеличивать продукцию IL-10 и TGF-β1, которые являются противовоспалительными цитокинами, играющими важную роль в уменьшении аллерген-индуцируемых ответов [17]. Недавние исследования на крысах также показали, что пробиотики увеличивают выработку кишечных противовоспалительных цитокинов (таких, как IL-10 и TGF-β1), уменьшая при этом выработку провоспалительных цитокинов, а пребиотики (лактулоза) могут способствовать усилению данного эффекта [18]. В ряде клинических исследований было показано, что дети, получавшие пребиотики, по сравнению с плацебо, имели меньшее количество различных диагнозов и эпизодов инфекции верхних отделов респираторного тракта и меньше случаев назначения антибиотков [19, 20]. Данные исследования свидетельствуют о положительном влиянии пребиотических продуктов (лактулозы) на иммунную систему.
Нельзя исключить, что эффекты лактулозы суммируются с иммуномодулирующим действием кларитромицина. В экспериментальных моделях [21] было показано, что при внутривенном применении сывороточные концентрации кларитромицина близки к 10 мкг/мл, что является существенной предпосылкой подавления ядерного фактора каппа B (NFkB) in vitro , который регулирует гены провоспалительных цитокинов и экспрессию фактора некроза опухоли (TNF-α). По сравнению с группой контроля значительно снижается содержание сывороточного TNF-α и оксидантный статус у животных, получавших кларитромицин. При этом ранний апоптоз моноцитов крови связан с благоприятным исходом.
Выявленные в нашем исследовании изменения содержания моноцитов представляют научный и клинический интерес и требуют дальнейших исследований.
Статистически значимых различий между группами 1 и 2 по показателю СРБ на первом и последнем не наблюдалось. В обеих группах наблюдалось статистически значимое снижение уровня СРБ на последнем визите по отношению к первому (р < 0,001).
Статистически значимых различий между группами 1 и 2 по показателям рентгенологического исследования (наличие горизонтального уровня жидкости или пристеночного затемнения в околоносовых пазухах) на первом визите и последнем не наблюдалось. В обеих группах наблюдалось статистически значимое различие по показателям «Наличие горизонтального уровня жидкости в околоносовых пазухах» (р = 0,003 в группе 1) и «Наличие пристеночного затемнения в околоносовых пазухах» (р < 0,001 и р = 0,015 соответственно) на последнем визите по отношению к первому.
Длительность воздействия препарата
Полный курс применения исследуемого препарата и препарата сравнения по протоколу составил 10 дней. За период исследования кумулятивная доза препарата Экозитрин составила 9,9±0,28 г, кумулятивная доза препарата Клацид составила 9,7 ± 0,70 г. Более детальная информация по кумулятивной дозе препаратов исследования представлена в таблице 3.
| Таблица 3. Препараты исследования. Кумулятивная доза | ||
|
Категория |
Группа 1 Экозитрин (n = 30) |
Группа 2 Клацид (n = 31) |
|
N |
30 | 31 |
|
Среднее, г |
9,90 |
9,70 |
|
Медиана, г |
10,0 |
10,0 |
|
Минимум, г |
9,00 |
7,00 |
|
Максимум, г |
10,5 | 10,5 |
| 25 процентиль, г | 10,0 | 9,50 |
|
75 процентиль, г |
10,0 | 10,0 |
|
Ст. откл., г |
0,28 |
0,70 |
За время исследования изменения дозы или перерыва в назначении препарата в группе Экозитрина не отмечено, в группе Клацида один пациент (3,2%) прекратил прием препарата по причине появления диспептических явлений после 7-го дня терапии.
Таким образом, статистически значимых различий по переносимости препарата, по нашему мнению, между основной и контрольной группами выявлено не было. Подробная информация представлена в таблице 4. Хорошая переносимость была отмечена у 17/30 (56,7%) пациентов в группе 1 и у 15/31 (48,4%) пациентов во группе 2. Удовлетворительная переносимость была отмечена у 13/30 (43,3%) пациентов в группе 1 и у 15/31 (48,4%) пациентов в группе 2. Неудовлетворительная переносимость была отмечена у 1 человека (3,2%) в группе 2.
| Таблица 4. Общее заключение исследователя о переносимости препарата | |||
|
Параметр |
Группа 1 Экозитрин (n = 30) |
Группа 2 Клацид (n = 31) |
р-величина |
| Хорошая | 17 (56,7%) | 15 (48,4%) | 0,517 |
|
Удовлетворительная |
13 (43,3%) |
15 (48,4%) | 0,692 |
|
Неудовлетворительная |
0 (0%) | 1 (3,2%) | 1 (3,2%) |
В ходе исследования одно нежелательное явление было зарегистрировано в группе Экозитрина -- у 13/30 (43,3%) пациентов, в группе Клацида -- у 16/31 (51,6%) пациентов. Чаще всего нежелательные явления, зарегистрированные в ходе исследования, были связаны с изменениями лабораторных показателей. В группе 1 данные нежелательные явления отмечались у 7/30 (23,3%) пациентов и у 8/31 (25,8%) пациентов в группе Клацида. Кроме того, были зарегистрированы нарушения со стороны желудочно-кишечного тракта, крови и лимфатической системы, почек и мочевыводящих путей, сердца. Следует отметит
ь, что у пациентов, получавших Экозитрин, нежелательные явления со стороны желудочно-кишечного тракта наблюдались в 4 раза реже. Так, нежелательные явления в основной группе были зарегистрированы только у 2 пациентов (6,7%), в то время как в группе пациентов, получавших Клацид -- у 8 человек (25,8%). Этот факт может свидетельствовать о более высоком профиле безопасности Экозитрина в сравнении с Клацидом в отношении развития симптомов дисбактериоза кишечника в условиях курсового приема антибиотиков (табл. 5, рис. 1). Из нежелательных явлений большинство имело легкую степень тяжести. Большая часть нежелательных явлений имела как минимум возможную связь с исследуемым препаратом.
| Таблица 5. Количество пациентов, получавших Экозитрин/Клацид, у которых наблюдались нежелательные явления со стороны ЖКТ | ||
|
Группа 1 Экозитрин (n = 30) x/N (%) пациентов |
Группа 2 Клацид (n = 31) x/N (%) пациентов |
|
| Визит 1 |
0/30 (0%) |
0/31 (0%) |
| Визит 2 |
2/30 (6,7%) |
7/31 (22,6%) |
|
Визит 3 |
2/30 (6,7%) |
5/31 (16,1%) |
|
Визит 4 |
0/30 (0%) |
2/30 (6,7%) |
|
Визит последующего наблюдения |
0/30 (0%) |
2/30 (6,7%) |
|
Всего |
2/30 (6,7%) |
8/31 (25,8%) |
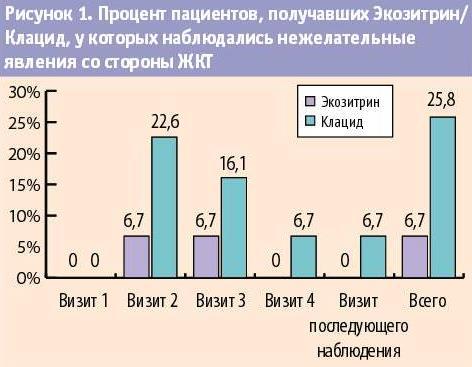
Эффективность исследуемого препарата Экозитрин сопоставима с эффективностью препарата Клацид у пациентов с острым бактериальным синуситом и обострением хронического синусита средней степени тяжести. Полученные данные позволяют сделать вывод об удовлетворительном профиле безопасности и переносимости препарата Экозитрин в сравнении с препаратом Клацид. Более того, результаты исследования дают основания говорить о более высоком профиле безопасности Экозитрина в сравнении с Клацидом в отношении развития симптомов дисбактериоза кишечника в условиях курсового приема антибиотиков.
Экозитрин относится к экоантибиотикам -- инновационным средствам, позволяющим минимизировать нежелательные лекарственные реакции, отмечаемые при приеме противомикробных средств. Экоантибиотики содержат традиционные антибиотики в сочетании с самым эффективным на сегодняшний день пребиотиком -- лактулозой ангидро (используется в пребиотических дозировках и не влияет на моторику ЖКТ), которая избирательно ускоряет рост и активность бифидобактерий. Лактулоза представляет собой питательный субстрат немикробного происхождения для колонизации, стимуляции и роста нормальной кишечной флоры. Применение Экозитрина — препарата с повышенным профилем безопасности и сравнимой эффективностью может повысить приверженность пациентов к лечению.
Литература
1. Пальчун В.Т., Крюков А.И. Оториноларингология: Руководство для врачей. М.: Медицина, 2001: 616.
2. Bryskier A, Butzler J-P. Macrolides. In: R.G.Finch, D.Greenwood, S.R.Norrby, R.J.Whitley, editors. Antibiotic and Chemotherapy. Anti-infective agents and their use in therapy. Churchill Livingstone, 8th edition. 2003: 310–25.
3. Chey WD, Wong BCY. American College of Gastroenterology Guideline on the Management of Helicobacter pylori Infection. Am J Gastroenterol, 2007, 102: 1808-25.
4. Neu HC. The development of macrolides: clarithromycin in perspective. J. Antimicrob Chemother., 1991, 27 (Suppl A): 1–9.
5. Mazzei T, Mini E, Novelli A, Periti P. Chemistry and mode of action of macrolides. J. Antimicrob Chemother, 1993, 31 (Suppl C): 1–9.
6. Leclercq R. Mechanisms of resistance to macrolides and lincosamides: nature of the resistance elements and their clinical implications. Clin Infect Dis 2002, 34: 482–92.
7. Edelstein PH. Pneumococcal resistance to macrolides, lincosamides, ketolides, and streptogramin B agents: molecular mechanisms and resistance phenotypes. Clin Infect Dis 2004, 38 (Suppl. 4): 322–7.
8. Kozlov RS, Bogdanovitch TM, Appelbaum PC et al. Antistreptococcal activity of telithromycin compared with seven other drugs in relation to macrolide resistance mechanisms in Russia. Antimicrob Agents Chemother 2002, 46: 2963–8.
9. Дюфалак (лактулоза). Научная монография. М., 2001.
10.Практические рекомендации Всемирной Гастроэнтерологической организации (WGO). Пробиотики и пребиотики, 2008.
11. Grewe JWM, Gouma DJ, Buurman WA: Complications in obstructive jaundice: Role of endotoxins. Scand J Gastroenterol 1992, 27(Suppl 194): 8–12.
12. van Leeuwen PAM, Hong RW, Rounds JD, Wilmore DW, Wesdorp RIC: Hepatic failure and coma following liver resection is reversed by manipulation of gut contents: the role of endotoxin. Surgery 1991, 110: 169–75.
13. Huchzermeyer H, Schumann C: Lactulose – a multifaceted substance. Z Gastroenterol 1997, 35: 945–55.
14. Kudoh K, Shimizu J, Wada M et al.: Effect of indigestable saccharides on B lymphocyte response of intestinal mucosa and cecal fermentation in rats. J Nutr Sci Vitaminol 1998, 44: 103–12.
15. Pain JA, Cahill CJ, Gilbert JM, Johnson CD, Trapnell JE, Bailey ME: Prevention of postoperative renal dysfunction in patients with obstructive jaundice: a multicentre study of bile salts and lactulose. Br J Surg 1991, 78: 467–9.
16. Madsen KL, Doyle JS, Jewell LD, Tavernini MM & Fedorak RN. Lactobacillus species prevents colitis in interleukin 10 gene–deficient mice. Gastroenterology. 1999. 116, 1107–1114.
17. Fleige1 S, Preisinger W, Meyer1 HHD, Pfaffl1 MW. Lactulose: effect on apoptotic- and immunological-markers in the gastro-intestinal tract of pre-ruminant calves. Veterinarni Medicina. 52, 2007 (10): 437–444.
18. Ewaschuk JB, Dieleman LA. Probiotics and prebiotics in chronic inflammatory bowel diseases. World Journal of Gastroenterology. 2006. 12, 5941–5950.
19. Bruzzese E, Volpicelli M, Squeglia V, et al. A formula containing galacto- and fructo-oligosaccharides prevents intestinal and extra-intestinal infections: an observational study. Clin Nutr. 2009. 28, 156–161.
20. Arslanoglu S, Moro GE & Boehm G. Early supplementation of prebiotic oligosaccharides protects formula-fed infants against infections during the first 6 months of life. J. Nutr., 2007, 137: 2420-2424.
21. Evangelos J. Giamarellos-Bourboulis, Theodoros Adamis et al., Clarithromycin is an effective immunomodulator when administered late in experimental pyelonephritis by multidrug-resistant Pseudomonas aeruginosa. BMC Infectious Diseases, 2006, 6: 31-39.
Источник: Медицинский совет, № 15, 2014








