
Журнал "Медицинский совет" №17/2024
DOI: 10.21518/ms2024-498
Т.В. Кирсанова1, https://orcid.org/0000-0002-1470-4311
А.И. Балакирева2, https://orcid.org/0000-0003-0362-580X
Т.А. Федорова1, https://orcid.org/0000-0001-6883-4456
Е.П. Колобов3, https://orcid.org/0009-0000-9798-5640
1 Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова
2 Московский государственный университет имени М.В. Ломоносова
3 Казанский государственный медицинский университет
Введение. Разграничение состояний, сопровождающихся развитием тромботической микроангиопатии (ТМА) в акушерстве, до сих пор представляется довольно сложной задачей. В настоящее время считается, что ключом к дифференциальной диагностике является влияние родоразрешения на регресс симптомов ТМА: если после родоразрешения гемолиз и тромбоцитопения регрессируют, то можно говорить о HELLP-синдроме. Если нет, то следует думать об аГУС. аГУС – крайне редкое заболевание, характеризующееся развитием ТМА с преимущественным острым повреждением почек. Однако задача диагностики усложняется еще и возможным наслоением одного процесса на другой: так, HELLP-синдром может стать триггером для развития аГУС, но кто из пациенток в большей степени подвержен этой трансформации, неясно.
Цель. Определить клинические и лабораторные критерии, которые могут быть использованы в ранней диагностике аГУС сразу после родоразрешения.
Материалы и методы. В исследование было включено 230 пациенток, из которых 71 женщине был поставлен диагноз «аГУС», 124 – «HELLP-синдром», а 35 пациенток без признаков ТМА были включены в контрольную группу. Были оценены и сопоставлены основные клинико-анамнестические и лабораторные данные.
Результаты. Женщины с HELLP-синдромом и аГУС были сопоставимы по возрасту, частоте оперативного родоразрешения и гестационному возрасту на момент родов, а также неблагоприятным перинатальным исходам. Пиковые значения сывороточного креатинина и ЛДГ после родов были наиболее полезными для раннего предположения о развитии аГУС. Уровень сывороточного креатинина более 142 мкмоль/л и ЛДГ более 1391 ЕД/л ассоциированы с трансформацией HELLP-синдрома в аГУС.
Заключение. Мы пришли к выводу, что стандартные лабораторные данные, в частности пиковый сывороточный креатинин и ЛДГ, могут быть использованы как помощники в ранней диагностике аГУС.
Для цитирования: Кирсанова ТВ, Балакирева АИ, Федорова ТА, Колобов ЕЛ. Подходы к ранней диагностике атипичного гемолитико-уремического синдрома после родоразрешения. Медицинский Совет. 2024;(17):104-112. https://doi.org/10.21518/ms2024-498
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Approaches to early detection of atypical hemolytic-uremic syndrome after childbirth
Tatiana V. Kirsanova1, https://orcid.org/0000-0002-1470-4311
Alina I. Balakireva2, https://orcid.org/0000-0003-0362-580X
Tatiana A. Fedorova1, https://orcid.org/0000-0001-6883-4456
Evgeniy P. Kolobov3, https://orcid.org/0009-0000-9798-5640
1 Kulakov National Medical Research Center of Obstetrics
2 Lomonosov Moscow State University
3 Kazan State Medical University
Introduction. Differentiating conditions accompanied by the development of thrombotic microangiopathy (TMA) in obstetrics is still rather challenging. Our present opinion is that the effect of childbirth on the TMA symptom regression is the key to differential diagnosis. If hemolysis and thrombocytopenia regress after childbirth, we can talk about HELLP syndrome. If not, we should think about atypical hemolytic uremic syndrome (aHUS). aHUS is an extremely rare disease characterized by TMA predominantly involving acute kidney injury. However, the diagnostic task can also be difficult due to possible overlapping one process with another: for example, HELLP syndrome can trigger aHUS, but which of the patients is more susceptible to this transformation is unclear.
Aim. To identify clinical and laboratory criteria that can be used to early detect aHUS immediately after childbirth.Materials and methods. A total of 230 patients were enrolled in the study, of whom 71 women were diagnosed with aHUS,124 patients with HELLP syndrome, and 35 patients without signs of TMA were enrolled in the control group. We assessed and compared the main clinical, anamnestic and laboratory findings.
Results. Women with HELLP syndrome and aHUS were comparable in terms of age, frequency of operative delivery and gestational age at delivery, and adverse perinatal outcomes. Peak serum creatinine and LDH values after delivery were the most useful to early predict aHUS. Serum creatinine > 142 μmol/L and LDH > 1391 U/L were associated with the transformation of HELLP syndrome into aHUS.
Conclusion. We concluded that standard laboratory data, most specifically peak serum creatinine and LDH, may be used to aid in the early diagnosis of aHUS.
For citation: Kirsanova TV, Balakireva AI, Fedorova TA, Kolobov EP EP. Approaches to early detection of atypical hemolytic-uremic syndrome after childbirth. Meditsinskiy sovet = Medical Council. 2024;(17):104-112. (In Russ.) https://doi.org/10.21518/ms2024-498
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Введение
Несмотря на появившуюся возможность идентификации различных вариантов тромботической микроангиопатии (ТМА), развивающихся при беременности или в ранний послеродовый период, атипичный гемолитико-уремический синдром (аГУС) остается диагнозом исключения. аГУС представляет собой избыточную активацию системы комплемента с развитием комплементарного шторма и повреждением эндотелия во многих органах и системах, прежде всего в почках [1]. Во время беременности большинство вариантов ТМА развиваются молниеносно и представляют серьезную опасность для жизни [2–7]. Сложность быстрой диагностики в акушерстве заключается и в том, что клинически все ТМА проявляются абсолютно однотипно: тромбоцитопенией потребления и микроангиопатической гемолитической анемией с поражением различных органов, главным образом почек, печени, легких и ЦНС [4, 5, 8, 9].
Поскольку клинико-лабораторный профиль при различных вариантах ТМА в акушерстве схож, и все эти заболевания связаны с высокой перинатальной и материнской смертностью, а при HELLP-синдроме до регресса симптомов ТМА после родов может пройти 48–72 ч, до сих пор обсуждаются подходы ранней диагностики аГУС и быстрого выбора тактики лечения для улучшения прогноза [10].
В 2011 г. произошел прорыв в лечении аГУС: на рынок вышел экулизумаб – препарат из группы моноклональных антител, блокирующий С5-компонент комплемента и тем самым блокирующий формирование мембраноатакующего комплекса. Экулизумаб эффективно подавляет избыточную активацию альтернативного пути и одобрен FDA в качестве терапии первой линии всех вариантов аГУС [11, 12]. В нашей стране с 2019 г. лечение всех пациентов с аГУС проводится биоаналогом экулизумаба, изученным в различных исследованиях и хорошо зарекомендовавшим себя [13–17]. Однако на исключение других вариантов ТМА уходит не менее трех дней, все ориентировочные прикроватные шкалы в акушерстве дают высокий процент погрешности, тогда как промедление с началом терапии недопустимо. Возможно поэтому во многих странах именно плазмообмен используется в качестве неспецифической терапевтической стратегии первого ряда для лечения всех вариантов ТМА в акушерстве сразу после родоразрешения.
Кроме однотипности проявлений, еще одной сложностью всех вариантов ТМА, впервые развившихся при беременности, является невозможность провести дифференциальную диагностику до родоразрешения. Даже если ранее уже был установлен диагноз «аГУС» или «тромботическая тромбоцитопеническая пурпура» (ТТП), рецидив ТМА при беременности не всегда является рецидивом ранее установленной болезни, так как преэклампсия (ПЭ) также может иметь различные проявления ТМА, однако ее патогенез заключается в выработке антиангиогенных субстанций ишемизированной плацентой, поэтому после удаления плаценты проявления ТМА купируются. Обычно при развитии симптомокомплекса ТМА во время беременности диагностируется HELLP-синдром – осложненное течение тяжелой преэклампсии. Единственным радикальным методом лечения HELLP-синдрома как варианта ПЭ является родоразрешение, после которого большинство женщин выздоравливает в течение 2–3 дней [18].
Однако у некоторых женщин наблюдается тяжелая ТМА, которая прогрессирует после родов, и в таких случаях после исключения других вариантов ТМА диагноз пересматривается на аГУС [19, 20]. Считается, что во время беременности развивается до 20% всех случаев аГУС [1, 19, 20].
Как уже было отмечено, клинические признаки aГУС, связанного с беременностью, совпадают с таковыми при HELLP-синдроме, но aГУС характеризуется плохим прогнозом и крайне тяжелым течением. Хотя аГУС и является орфанным заболеванием с предполагаемой заболеваемостью 0,23/ год на миллион человек, крайне важно быстро заподозрить его, поскольку лечение аГУС отличается от терапии HELLP-синдрома. Без антикомплементарной терапии при аГУС существует крайне высокий риск прогрессии до терминальной почечной недостаточности и даже смерти. Кроме того, при формировании терминальной почечной недостаточности и планировании трансплантации почки пациентки имеют высокий риск рецидива аГУС и потери аллотрансплантата.
В 2021 г. опубликована статья R.M. Burwick et al. [21], в которой была произведена попытка выделить лабораторные предикторы перехода HELLP-синдрома в аГУС на основании изучения 46 опубликованных мировых случаев аГУС и 45 «собственных» случаев HELLP-синдрома. Оказалось, что пиковые значения сывороточного креатинина и ЛДГ после родов были наиболее чувствительны при трансформации HELLP-синдрома в аГУС с площадью под кривой 0,996 (95% ДИ 0,99–1,0) и 0,91 (95% ДИ 0,83–0,98) соответственно. Сывороточный креатинин ≥1,9 мг/дл, ЛДГ ≥1832 ЕД/л или сывороточный креатинин ≥1,9 мг/дл в сочетании с ЛДГ ≥600 ЕД/л были оптимальными порогами для диагностики аГУС.
Авторы пришли к выводу, что креатинин и ЛДГ могут быть использованы в качестве дополнительных помогающих критериев для дифференциации аГУС и HELLP-синдрома уже в раннем послеродовом периоде.
Мы решили выполнить аналогичное исследование и поискать общие лабораторные предикторы трансформации HELLP-синдрома в аГУС. Таким образом, целью исследования стало определение клинических и лабораторных показателей, которые могут быть использованы в ранней диагностике аГУС сразу после родоразрешения
Материалы и методы
В многоцентровое наблюдательное исследование включено 230 беременных, рожениц или родильниц в возрасте от 17 до 45 лет (30,5 ± 4,6), которые с 2012 по 2023 г. наблюдались и получали лечение или в ФГБУ НМИЦ АГП им. В.И. Кулакова, или в перинатальных центрах Российской Федерации (регистр катастрофических акушерских состояний) с последующим переводом в ряде случаев в ФГБУ НМИЦ АГП. Пациентки были разделены на следующие группы:
В первую группу была включена 71 пациентка с аГУС в возрасте от 17 до 42 лет (29,40 ± 6,72 года). Диагноз «аГУС» устанавливался на основании возникновения или прогрессии признаков ТМА после родоразрешения с исключением инфекционного процесса, отрицательными значениями антифосфолипидных антител и АНФ и при уровне ADAMTS-13 более 10% (для исключения ТТП). Всем пациенткам выполнялось исследование стула на STEC (шига-токсин-продуцирующую E. coli), что исключало развитие типичного ГУС.
Во вторую группу было включено 124 пациентки с HELLP-синдромом в возрасте от 19 до 46 лет, средний возраст 33,27 ± 5,01 года. HELLP-синдром был установлен согласно критериям Tennessee: тромбоциты менее 100 × 109 кл/мл*, АСТ или АЛТ более 70 ЕД/л, ЛДГ более 600 ЕД/л. В исследование были включены пациентки с полным и частичным HELLP-синдромом. Суммарно в исследование вошло 22 пациентки с парциальным HELLP-синдромом: без тромбоцитопении – 13 пациенток (11,29%), без цитолиза – 9 пациенток (7,25%).
Согласно классификации Mississippi, которая разделяет HELLP-синдром в зависимости от тяжести тромбоцитопении на три группы, I классу соответствовало 32 пациентки (25,81%), у них минимальные значения тромбоцитов варьировали до 50 × 109 /л; II классу (тромбоцитопения 50–100 × 109 /л) – 44 пациентки (35,48%), значения тромбоцитов от 51 до 99 × 109 /л; III классу (тромбоцитопения 100–150 × 10 9 /л) – 26 пациенток (20,96%), значения тромбоцитов от 104 до 150 × 10 9 /л.
Третья группа была отобрана после родоразрешения и представляла собой контрольную выборку, куда было включено 35 женщин от 23 до 38 лет (средний возраст 31,86 ± 4,96 года) с нормально протекавшей беременностью и послеродовым периодом без признаков ТМА. Столь малая группа контроля объясняется тем, что в нее отбирались пациентки не только без клинико-лабораторных признаков ПЭ, но и с нормальным уровнем соотношения про- и антиангиогенных сусбанций (sFlt/PlGF), дисбаланс которых является основным субстратом преэклампсии. Столь педантичный отбор позволил нам набрать небольшую группу пациенток, у которых ПЭ не может дебютировать после родоразрешения.
У всех пациенток оценивался возраст, акушерский анамнез, а также рутинный лабораторный набор: общий анализ крови, креатинин сыворотки (СКр), АЛТ, АСТ, ЛДГ, шизоциты.
Статистический анализ
Все данные вносились в электронные таблицы в программе Microsoft Excel. Статистическая обработка выполнялась с помощью программного пакета SPSS Statistics. Учитывая, что все полученные нами выборки являлись непараметрическими, для описания количественных данных рассчитывались медиана, 25-й и 75-й квартили; для определения статистической значимости различий применялся критерий Манна − Уитни; для оценки специфичности и чувствительности использовался ROC-анализ. Различия между группами сравнивались с использованием непарного t-критерия, критерия суммы рангов Вилкоксона или критерия χ2. Статистическая значимость определялась по p < 0,01 с учетом множественных сравнений. Были определены показатели чувствительности и специфичности для диагностики аГУС, связанного с беременностью, и максимальное значение для статистики Youden J (J = чувствительность + специфичность − 1) использовалось для определения оптимальной точки отсечения для отдельных лабораторных параметров.
Результаты
В исследовании R.M. Burwick et al. [21] пациентки с HELLP-синдромом были старше. В нашем исследовании статистически значимых различий в возрасте беременных обнаружено не было. Интересно, что несовершеннолетние пациентки были только в первой группе. Распределение женщин по возрасту представлено в табл. 1.
Таблица 1. Распределение обследованных пациенток по возрасту
| Возраст, лет |
Группа 1 аГУС n = 71 |
Группа 2 HELLP-синдром n = 124 |
Группа 3 Контроль n = 35 |
| Средний возраст | 29,69 ± 6,67 | 33,27 ± 5,01 | 31,86 ± 4,96 |
| <18 | 2 (2,8%) | 0 (0%) | 0 (0%) |
| 18–31 | 48 (67,7%) | 46 (37,1%) | 21 (60,0%) |
| >31 | 21 (29,5%) | 78 (62,9%) | 14 (40,0%) |
В связи с тем что в ряде работ говорится о том, что аГУС чаще развивается при второй и далее беременности, а HELLP-синдром – при первой, мы проанализировали акушерский анамнез (табл. 2).
Таблица 2. Репродуктивный анамнез пациенток
| Название |
Группа 1 аГУС |
Группа 2 HELLP-синдром |
Группа 3 Контроль |
| Первобеременные | 28 (39,4%) | 63 (50,8%) | 19 (54,3%) |
| Повторнобеременные | 35 (49,3%) | 59 (47,5%) | 16 (45,7%) |
| Первородящие | 6 (8, 5%) | 18 (14,5%) | 3 (18,7%) |
| Повторнородящие | 29 (40,8%) | 41 (33,1%) | 13 (81,3%) |
| Репродуктивные потери в анамнезе | 11 (15,5%) | 34 (27,4%) | 4 (11,4%) |
Среди пациенток с HELLP-синдромом было больше первобеременных, а также пациенток с репродуктивными потерями в анамнезе.
Средние сроки родоразрешения в первой группе составили 31,55 ± 1,56 нед.
Пациентки из этой группы были родоразрешены преимущественно путем КС (64,79%) в связи с медицинскими показаниями для планового или экстренного оперативного родоразрешения (такие как тяжелая преэклампсия, ухудшение состояния плода в связи с острой гипоксией, излитие околоплодных вод при неготовности родовых путей, несостоятельность рубца на матке, тазовое предлежание плода и др.). 35,21% пациенток из первой группы были родоразрешены через естественные родовые пути, в 3 случаях (12,00%) роды были индуцированы после диагностированной антенатальной гибели плода.
Во второй группе средний срок родоразрешения составил 31,48 ± 1,02 нед. 15 из 124 женщин (12,09%) с HELLP-синдромом были родоразрешены через естественные родовые пути. 87,91% пациенток с HELLP-синдромом были родоразрешены экстренно путем КС в связи с нарастанием тяжести ПЭ.
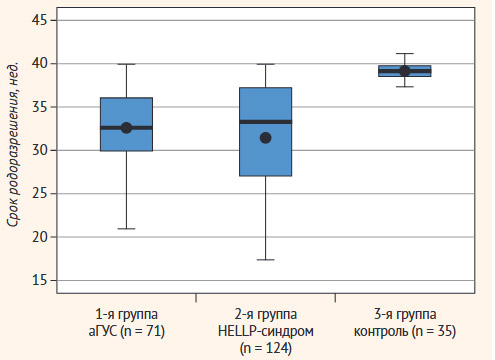
В третьей группе 74,28% (26 из 35) женщин были родоразрешены через естественные родовые пути, а 25,72% (9 из 35) женщин было выполнено плановое КС по следующим акушерским показаниям: тазовое предлежание, узкий таз, множественная миома матки или рубец на матке. Средний срок родоразрешения в этой группе составил 39,05 ± 0,29 нед. Средние сроки родоразрешения представлены на рис. 1.
Статистически значимых отличий в сроках родоразрешения среди пациенток первой и второй групп выявлено не было.
Рисунок 1. Сроки родоразрешения у пациенток с признаками ТМА и контрольной группы
Многоплодные беременности отмечались только в первой и второй группах пациенток. У 16 из 124 пациенток (12,90%) с HELLP-синдромом была подтверждена многоплодная беременность, одна из них тремя плодами (один новорожденный из тройни погиб в ОРИТ в связи с недоношенностью и развитием инфекционных осложнений). В одном случае была диагностирована антенатальная гибель одного их двух плодов. В группе с аГУС у двух пациенток (2,82%) беременность дихориальной диамниатической двойней закончилась живорождением.
В первой группе процент мертворожденности составил 26,76%. У 14 из 71 роженицы была диагностирована антенатальная гибель плода (19,71%) вследствие гипоксии. 5 младенцев (7,04%) погибли в раннем послеродовом периоде в связи с высокой степенью недоношенности.
При оценке исхода родов у пациенток во второй группе процент мертворожденности составил 15,32% (19 из 124) в связи с антенатальной гибелью плода вследствие гипоксии. 11 (8,87%) младенцев у пациенток с HELLP-синдромом погибли в раннем послеродовом периоде (1–7-й день после родоразрешения) в связи с высокой степенью недоношенности, наличием врожденной пневмонии или энтероколита. 5 (4,03%) младенцев погибли в течение 2-х месяцев после родов в ОРИТ в связи с наличием врожденной пневмонии.
Перинатальные исходы были сопоставимы в первой и второй группе.
В группе контроля все младенцы были рождены живыми.
Снижение антропометрических параметров новорожденных и показателей по шкале Апгар было отмечено во всех группах пациенток с ТМА. Худшие показатели были зафиксированы в группе пациенток с аГУС, где рост и вес ребенка были ниже, чем в группе с HELLP-синдромом: вес ребенка при аГУС составил 2338,00 ± 221,46 г, а при HELLP-синдроме – 2947,00 ± 173,95 г, тогда как в группе контроля – 3376,00 ± 158,35 г (р1,2 < 0,001, р1,3 < 0,001, р2,3 < 0,001). Рост при аГУС 45,43 ± 2,29 см, при HELLP-синдроме – 45,00 ± 1,48 см, контрольная группа – 51,10 ± 0,72 см (р1,2 < 0,005, р1,3 < 0,005, р2,3 < 0,001).
Оценка по Апгар на 1-й и 5-й минуте соответственно в группе аГУС составила 6,27 ± 0,39 и 7,45 ± 0,32, в группе с HELLP-синдромом – 6,51 ± 0,31 и 7,48 ± 0,24, тогда как в группе контроля – 8,00 ± 0,07 и 9,00 ± 0,11.
13 пациенток из первой группы имели крайне тяжелое течение ТМА и умерли. Во второй группе и группе контроля все пациентки живы.
Предшествующая ПЭ в данную беременность была выявлена у 26 женщин (36,62%) из группы пациенток с аГУС и у 124 пациенток (100%) в группе с HELLP-синдромом.
Лабораторные показатели представлены в табл. 3.
Анемия и тромбоцитопения различной степени выраженности были отмечены в обеих группах с ТМА. Тяжесть анемии была максимальной в первой группе пациенток (медиана 63,5 [55,0; 73,0] г/л), минимальный уровень гемоглобина составил 25 г/л. Во второй группе была зафиксирована анемия средней степени тяжести – медиана 90,0 [75,2; 103,5] г/л. Распределение количества эритроцитов соответствовало уровню гемоглобина. Минимальные значения были получены в первой группе – 2,5 [2,1; 2,9] × 1012 кл/мл. Самые низкие показатели количества тромбоцитов также были зафиксированы в первой группе пациенток – 36,5 [21,0; 55,5] × 109 кл/мл. Во второй группе медиана значений тромбоцитов составила 80,0 [46,0; 113,2] × 109 кл/мл.
Таблица 3. Лабораторные показатели обследованных пациенток, Me [Q1; Q3]
| Название | Гр.1. аГУС; n = 71 | Гр.2. HELLP-синдром; n = 124 | Гр.3. Контроль; n = 35 | p-value |
|
Эритроциты, 3,22–4,37 × 1012 кл/мл |
2,5 [2,1; 2,9] | 3,6 [3,0; 4,1] | 4,0 [3,7; 4,2] | р1,2; 1,3 < 0,001 |
|
Гемоглобин, 110–136 г/л |
63,5 [55,0; 73,0] | 90,0 [75,2; 103,5] | 119,0 [112,0; 129,5] | р1,2; 1,3; 2,3 < 0,001 |
|
Шизоциты |
2,20 ± 0,80% | 1,03 ± 0,38% | 0,0 | р1,2; 1,3; 2,3 < 0,001 |
|
Гематокрит, 0,2840,387% |
0,198 [0,170; 0,218] | 0,277 [0,236; 0,317] | 0,366 [0,336; 0,382] | р1,2; 1,3; 2,3 < 0,001 |
|
Тромбоциты, 150–348 × 109 кл/мл |
36,5 [21,0; 55,5] | 80,0 [46,0; 113,2] | 215,0 [176,5; 267,0] | р1,2; 1,3; 2,3 < 0,001 |
|
ЛДГ, 150–400, Ед/л |
2377,0 [1105,7; 3522,9] | 1193,2 [653,9; 1331,0] | 188,0 [106,5; 267,0] | р1,2; 1,3; 2,3 < 0,001 |
|
Фибриноген, 2,5–5,5 г/л |
2,8 [1,9; 3,8] | 4,9 [3,3; 6,5] | 5,4 [4,7; 6,0] | р1,2; 1,3 < 0,001 |
|
Д-димер, 10–1550 нг/л |
9100,0 [5497,0; 15614,0] | 4497,0 [2618,5; 7250,5] | 1505,0 [1174,0; 2001,5] | р1,3; 2,3 < 0,001 |
|
Общий билирубин, 3,4–21,0 мкмоль/л |
21,5 [13,4; 36,8] | 9,5 [6,5; 18,1] | 9,6 [6,7; 11,2] | р1,2; 1,3 < 0,001 |
|
АСТ, 0–40,00 |
174,5 [61,7; 351,9] | 134,4 [79,9; 304,7] | 23,0 [17,7; 28,1] | р1,3; 2,3 < 0,001 |
|
АЛТ, 0–40,00 Ед/л |
163,2 [82,5; 330,1] | 111,6 [31,7; 217,8] | 17,8 [11,0; 25,4] | р1,3; 2,3 < 0,001 |
|
Мочевина, 1,3–5,2 ммоль/л |
15,9 [10,6; 22,7] | 6,0 [4,5; 7,7] | 3,9 [3,2; 4,4] | р1,2; 1,3; 2,3 < 0,001 |
|
Креатинин, 53,0–90,0 мкмоль/л |
333,9 [209,0; 500,0] | 104,3 [87,6; 118,7] | 69,1 [60,7; 78,1] | р1,2; 1,3; 2,3 < 0,001 |
Стоит отметить, что в подсчете среднего уровня шизоцитов в первой группе, в которой был отмечен значимый шизоцитоз, не учитывался анализ на шизоциты у 8 пациенток с аГУС, который выполнялся в качественном формате: результат был отмечен как положительный. Несмотря на это, во второй группе средние значения уровня шизоцитов были значимо ниже, чем в первой, тогда как ни у кого из группы контроля шизоцитов не было. Повышение ЛДГ различной степени выраженности было отмечено у всех пациенток из первой и второй групп. В группе с аГУС его медиана составила 2377,0 [1105,7; 3522,9] Ед/л, в группе с HELLP-синдромом – 1193,2 [653,9; 1331,0] Ед/л (р < 0,001).
При анализе корреляций во всех группах пациенток с ТМА выявлена положительная связь между гемоглобином и количеством тромбоцитов (rs = 0,56; p < 0,001). Также была выявлена обратная связь между уровнем шизоцитов и количеством эритроцитов (rs = –0,50; p < 0,001) в первой группе, во второй группе пациенток с количеством тромбоцитов (rs = –0,29; p < 0,001), а также гемоглобином (rs = –0,33; p < 0,05).
Обращает на себя внимание выявленная отрицательная связь с высоким уровнем достоверности общего билирубина с количеством тромбоцитов: в первой группе rs = –0,29; p < 0,01, во второй rs = –0,40; p < 0,001. Также в первой и второй группах была отмечена схожая связь между общим билирубином и АСТ/АЛТ (rs = 0,41; p < 0,001).
Во второй группе пациенток была выявлена прямая связь между уровнем общего билирубина и ЛДГ (rs = –0,42; p < 0,001). При анализе корреляций ЛДГ в первых трех группах была выявлена аналогичная обратная связь с уровнем гемоглобина (rs = 0,71; p < 0,05), а также обнаружена достоверная связь ЛДГ с тромбоцитами во второй группе (rs = 0,41; p < 0,001).
При анализе коагулограммы было выявлено, что уровень фибриногена у всех пациенток был в референсном интервале, однако в первой группе пациенток результат стремился к снижению (медиана 2,8 [1,9; 3,8] г/л). По результатам проведенного исследования гемостазиограммы максимальное повышение уровня Д-димера было выявлено в первой группе пациенток, что, по-видимому, свидетельствует о более выраженной активации внутрисосудистого свертывания по сравнению с третьей группой, где средние значения уровня Д-димера не превышали норму. При анализе почечной функции была выявлена прямая связь между Д-димером и и креатинином в первой (аГУС) и второй (HELLP-синдром) группах (rs = 0,50; p < 0,01 и rs = 0,41; p < 0,05 соответственно).
У пациенток из первой группы было отмечено повышение уровня билирубина (21,5 [13,4; 36,8] мкмоль/л, максимально до 332 мкмоль/л). Стоит отметить, что полученные средние значения билирубина у пациенток из второй и третьей групп не выходят за референсные значения нормы, хотя была отмечена тенденция к их нарастанию. Во второй группе у 2 пациенток было зафиксировано повышение общего билирубина до 150 мкмоль/л.
Все пациентки с аГУС имели острое повреждение почек (ОПП) различной степени выраженности. При этом 96% (68 из 71) пациенток с диагнозом «аГУС» потребовались сеансы заместительной почечной терапии. Медиана значений креатинина была значимо выше, чем в других группах, и составила 333,9 [209,0; 500,0] мкмоль/л. Максимальное значение креатинина у пациентки с аГУС составило 1 078 мкмоль/л.
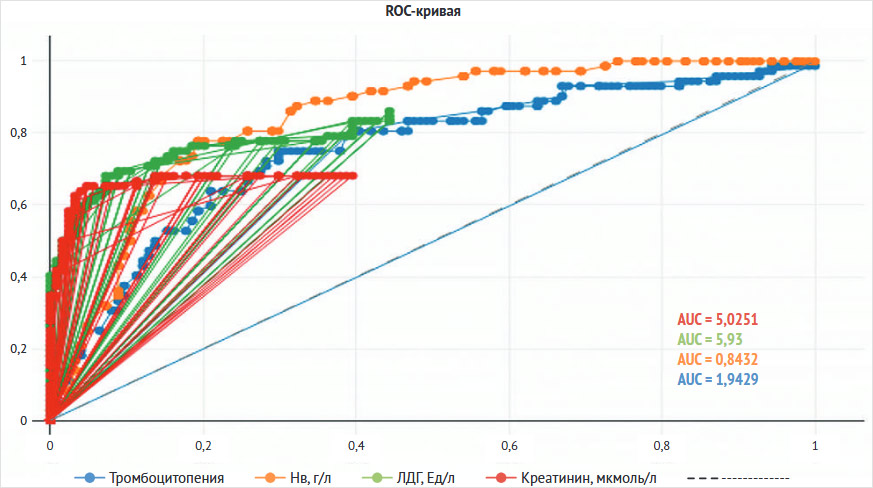
При проведении ROC-анализа было обнаружено, что значения гемоглобина, количества тромбоцитов, креатинина и ЛДГ, по-видимому, можно использовать для прогнозирования развития аГУС, а вот значения АЛТ, АСТ нет (рис. 2).
Рисунок 2. Информативные лабораторные показатели для диагностики атипичного гемолитико-уремического синдрома с использованием ROC-анализа
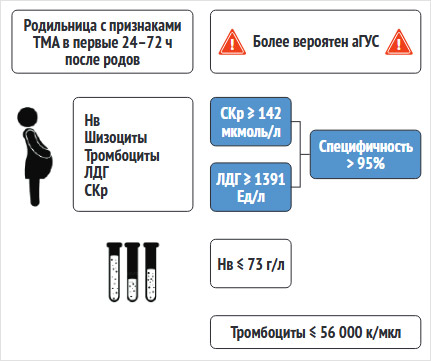
Далее мы попытались определить лабораторные пороговые значения, которые можно было бы использовать для предположения о развитии аГУС в послеродовом периоде. Cut-off для сывороточного креатинина ≥142 мкмоль/л (специфичность 98%, чувствительность 98%), ЛДГ ≥1391 ЕД/л (специфичность 100%, чувствительность 80%), гемоглобин ≤73 г/л (специфичность 987%, чувствительность 90%) и количество тромбоцитов ≤56 000 к/мкл (специфичность 93%, чувствительность 80%). Поскольку пороговые значения сывороточного креатинина и ЛДГ показали наибольшую специфичность (>95%), мы оценили эти маркеры более подробно.
Мы обнаружили, что послеродовые уровни сывороточного креатинина ≥142 мкмоль/л были зарегистрированы у 67 из 71 пациентки с аГУС (в 94% случаев), по сравнению с 12% случаев HELLP-синдрома (15 из 124 пациенток, p < 0,001), а уровни сывороточного ЛДГ ≥1391 Ед/л зарегистрированы у всех пациенток (100%) с аГУС по сравнению с 24% случаев HELLP (p < 0,001) (рис. 3).
Рисунок 3. Инфографика для предположения о развитии атипичного гемолитико-уремического синдрома в раннем послеродовом периоде по лабораторным показателям
Обсуждение
В этом сравнительном исследовании клинико-лабораторных показателей женщин с аГУС и с HELLP-синдромом было обнаружено, что некоторые лабораторные показатели могут использоваться как предикторы развития аГУС. По-видимому, уровни сывороточного креатинина и ЛДГ наиболее полезны для дианостики аГУС, в то время как значения гемоглобина и количества тромбоцитов не сильно отличаются у пациенток с HELLP-синдромом.
Вероятными пороговыми значениями для диагностики аГУС, ассоциированного с беременностью, стал уровень сывороточного креатинина ≥142 мкмоль/л и уровень ЛДГ ≥1391 Ед/л. Именно при таких лабораторных параметрах пациентки с HELLP-синдромом продолжали ухудшаться после родоразрешения.
Наши данные оказались сопоставимы с результатами R.M. Burwick et al. [21]. У наших иностранных коллег порогами для предположения о трансформации HELLP-синдрома в аГУС стали уровень сывороточного креатинина ≥1,9 мг/дл, что соответствует 167,96 мкмоль/л, а также ЛДГ ≥1832 ЕД/л. По-видимому, стандартные лабораторные данные, такие как сывороточный креатинин и ЛДГ, могут быть использованы для предположения о трансформации HELLP-синдрома в аГУС уже в раннем послеродовом периоде
Длительное время считалось, что при аГУС имеется преимущественное поражение почек, тогда как HELLP-синдром характеризуется преимущественным поражением печени и обязательным значимым повышением уровня печеночных ферментов [19, 20].
Наши данные показали, что как при аГУС могут быть повышены уровни печеночных ферментов, так и при HELLP-синдроме – уровень креатинина в сыворотке [22]. Поэтому выраженность цитолиза не должна использоваться для дифференциации этих двух расстройств. Цитолиз не исключает aГУС, поскольку печень также является органом-мишенью при этом заболевании, как и почки [22]. С одной стороны, такое поражение печени, по-видимому, является специфичным именно для акушерского аГУС, поскольку столь значимый цитолиз не регистрируется при аГУС вне беременности. С другой стороны, HELLP-синдром у большинства становится предшественником развития аГУС. По-видимому, именно тяжесть почечной дисфункции при HELLP-синдроме имеет значение при трансформации диагноза.
Уровни гемоглобина и количества тромбоцитов при аГУС в нашем исследовании также были ниже, однако их нельзя использовать из-за низкой специфичности. Все же гематологические проявления ТМА при этих двух состояниях практически идентичны. Напротив, более выраженное повышение уровня креатинина в сыворотке и уровня ЛДГ может указывать на трансформацию в аГУС. В то время как лабораторные отклонения при HELLP-синдроме обычно купируются самостоятельно после родоразрешения, почечная недостаточность при аГУС прогрессирует.
Международная рабочая группа под руководством F. Fakhouri в 2020 г. предложила довольно сложный алгоритм диагностики ТМА, помогающий в диагностике аГУС, с обязательным измерением sFLT1 (растворимая fms-подобная тирозинкиназа 1), PlGF (плацентарный фактор роста), ADAMTS13 (A Disintegrin and Metalloproteinase with Thrombospondin type 1 motive, member 13), протромбинового времени, D-димера, антинуклеарных и антифосфолипидных антител. Мы также руководствовались этими критериями при окончательной верификации диагноза [23].
Вероятно, к такой диагностике можно добавить уровень креатинина и ЛДГ, которые можно считать простыми лабораторными маркерами, помогающими выделить группу риска по развитию аГУС. АГУС, ассоциированный с беременностью, характеризуется агрессивным течением и крайне неблагоприятным прогнозом: смертность при нем достигает 42%, но при этом лавинообразное течение ТМА не позволяет бездействовать до исключения других причин ее развития. Ухудшение ТМА после родов при аГУС также не кажется случайным: во время беременности на поверхности трофобласта в достаточном количестве экспрессированы белки-ингибиторы комплемента, что предотвращает локальную активацию комплемента в плаценте даже при наличии системной активации. Напротив, после родоразрешения, мощный выброс тромбопластина с обширной раневой поверхности, отсутствие «комплемент-ингибирующей» плаценты, попадание в материнский кровоток клеток плода, кровотечение, инфекция могут привести к системной активации альтернативного пути [19, 20, 24]. В любом случае рекомендациями Американского общества по аферезу (ASFA) от 2019 г. плазмообмен рекомендован как для аГУС, так и для других вариантов ТМА в акушерской практике, таких как ТТП, катастрофический антифосфолипидный синдром, а также HELLP-синдром после родоразрешения [25, 26].
Также интересно выявленное нами повышение общего уровня билирубина при аГУС и HELLP- синдроме при сравнении со здоровыми беременными женщинами. На этот же феномен обратили внимание наши турецкие коллеги, изучив течение HELLP-синдрома у 171 беременной. Они даже выделили повышение билирубина наравне с повышением ЛДГ более 1 200 и тромбоцитопенией менее 50 000 в мкл как прогностически неблагоприятный маркер для матери [27]. По-видимому, микроангиопатический гемолиз все же сопровождается повышением билирубина, однако степень выраженности гипербилирубинемии минимальна и не может быть основным диагностическим маркером гемолиза.
Выводы
Выделение групп риска по развитию аГУС позволит улучшить исходы и снизить материнскую летальность. Результаты нашего исследования позволяют подтвердить концепцию, в которой ТМА при беременности с развитием HELLP-синдрома при выраженном поражении почек прогрессирует до аГУС.
Список литературы / References
- Bruel A, Kavanagh D, Noris M, Delmas Y, Wong EKS, Bresin E et al. Hemolytic uremic syndrome in pregnancy and postpartum. Clin J Am Soc Nephrol. 2017;12(8):1237-1247. https://doi.org/10.2215/CJN.00280117.
- George JN, Nester CM. Syndromes of thrombotic microangiopathy. N Engl J Med. 2014;371:654-666. https://doi.org/10.1056/NEJMra1312353.
- Scully M, Hunt BJ, Benjamin S, Liesner R, Rose P, Peyvandi F et al. Guidelines on the diagnosis and management of thrombotic thrombocytopenic purpura and other thrombotic microangiopathies. Br J Haematol. 2012;158(3):323-335. https://doi.org/10.1111/j.1365-2141.2012.09167.x.
- Birkhoelzer S, Belcher A, Peet H. Diagnostic dilemma: Severe thrombotic microangiopathy in pregnancy. J Intensive Care Soc. 2017;18(4):348-351. https://doi.org/10.1177/1751143717715969.
- Shatzel JJ, Taylor JA. Syndromes of thrombotic microangiopathy. Med Clin North Am. 2017;101(2):395-415. https://doi.org/10.1016/j.mcna.2016.09.010.
- Кирсанова ТВ, Виноградова МА. Новое в дифференциальной диагностике различных вариантов тромботических микроангиопатий в акушерстве. Медицинский совет. 2021;(3):98-105. https://doi.org/10.21518/2079-701X-2021-3-98-105.
- Кирсанова ТВ. Сложности дифференциальной диагностики различных вариантов тма: от ургентных до «тихих» форм с жизнеугрожающими последствиями. Клиническая нефрология. 2020;12(3):46-52. https://doi.org/10.18565/nephrology.2020.3.46-52.
- Appel GB. Thrombotic microangiopathies: Similar presentations, different therapies. Cleve Clin J Med. 2017;84(2):114-130. https://doi.org/10.3949/ccjm.84gr.17001.
- Elayoubi J, Donthireddy K, Nemakayala DR. Microangiopathies in pregnancy. BMJ Case Rep. 2018;2018:bcr-2017-221648. https://doi.org/10.1136/bcr-2017-221648.
- Liu Y, Ma X, Zheng J, Liu X, Yan T. Pregnancy outcomes in patients with acute kidney injury during pregnancy: a systematic review and meta-analysis. BMC Pregnancy Childbirth. 2017;17(1):235. https://doi.org/10.1186/s12884-017-1402-9.
- Huerta A, Arjona E, Portoles J, Lopez-Sanchez P, Rabasco C, Espinosa M et al. A retrospective study of pregnancy-associated atypical hemolytic uremic syndrome. Kidney Int. 2018;93(2):450-459. https://doi.org/10.1016/j.kint.2017.06.022.
- Legendre CM, Licht C, Muus P, Greenbaum LA, Babu S, Bedrosian C et al. Terminal complement inhibitor eculizumab in atypical hemolytic-uremic syndrome. N Engl J Med. 2013;368(23):2169-2181. https://doi.org/10.1056/NEJMoa1208981.
- Kulagin AD, Ptushkin VV, Lukina EA, Davydkin IL, Korobkin AV, Shamrai VS et al. Randomized multicenter noninferiority phase III clinical trial of the first biosimilar of eculizumab. Ann Hematol. 2021;100(11):2689-2698. https://doi.org/10.1007/s00277-021-04624-7.
- Kulagin A, Ptushkin V, Lukina E, Gapchenko E, Markova O, Zuev E, Kudlay D. Phase III clinical trial of Elizaria® and Soliris® in adult patients with paroxysmal nocturnal hemoglobinuria: results of comparative analysis of efficacy, safety, and pharmacological data. Blood. 2019;134(Suppl. 1):3748. https://doi.org/10.1182/blood-2019-125693.
- Птушкин ВВ, Кулагин АД, Лукина ЕА, Давыдкин ИЛ, Константинова ТС, Шамрай ВС и др. Результаты открытого многоцентрового клинического исследования Ib фазы по оценке безопасности, фармакокинетики и фармакодинамики первого биоаналога экулизумаба у нелеченых пациентов с пароксизмальной ночной гемоглобинурией в фазе индукции терапии. Терапевтический архив. 2020;92(7):77-84. https://doi.org/10.26442/00403660.2020.07.000818.
- Коротчаева ЮВ, Козловская НЛ, Шифман ЕМ. Сравнительный анализ эффективности препаратов экулизумаба в лечении акушерского атипичного гемолитико-уремического синдрома. Клиническая фармакология и терапия. 2021;30(3):25-30. https://doi.org/10.32756/0869-5490-2021-3-25-30.
- Эмирова ХМ, Орлова ОМ, Музуров АЛ, Генералова ГА, Панкратенко ТЕ, Абасеева ТЮ и др. Опыт применения Элизарии® при атипичном гемолитико-уремическом синдроме. Педиатрия. Журнал имени Г.Н. Сперанского. 2019;98(5):225-229. https://doi.org/10.24110/0031-403X-2019-98-5-225-229.
- Burwick RM, Rincon M, Beeraka SS, Gupta M, Feinberg BB. Evaluation of hemolysis as a severe feature of preeclampsia. Hypertension. 2018;72(2):460-465. https://doi.org/10.1161/HYPERTENSIONAHA.118.11211.
- Gupta M, Feinberg BB, Burwick RM. Thrombotic microangiopathies of pregnancy: differential diagnosis. Pregnancy Hypertens. 2018;12:29-34. https://doi.org/10.1016/j.preghy.2018.02.007.
- Gupta M, Govindappagari S, Burwick RM. Pregnancy-associated atypical hemolytic uremic syndrome: a systematic review. Obstet Gynecol. 2020;135(1):46-58. https://doi.org/10.1097/AOG.0000000000003554.
- Burwick RM, Moyle K, Java A, Gupta M. Differentiating Hemolysis, Elevated Liver Enzymes, and Low Platelet Count Syndrome and Atypical Hemolytic Uremic Syndrome in the Postpartum Period. Hypertension. 2021;78(3):760-768. https://doi.org/10.1161/HYPERTENSIONAHA.121.17311.
- Козловская НЛ, Коротчаева ЮВ, Демьянова КА, Шифман ЕМ. Сравнительная характеристика акушерского и «общепопуляционного» атипичного гемолитико-уремического синдрома у взрослых. Нефрология и диализ. 2022;24(1):52-61. Режим доступа: https://journal.nephro.ru/jour/article/view/56.
- Fakhouri F, Scully M, Provôt F, Blasco M, Coppo P, Noris M et al. Management of thrombotic microangiopathy in pregnancy and postpartum: report from an international working group. Blood. 2020;136(19):2103-2117. https://doi.org/10.1182/blood.2020005221
- Padmanabhan A, Connelly-Smith L, Aqui N, Balogun RA, Klingel R, Meyer E et al. Guidelines on the Use of Therapeutic Apheresis in Clinical Practice - Evidence-Based Approach from the Writing Committee of the American Society for Apheresis: The Eighth Special Issue. J Clin Apher. 2019;34(3):171-354. https://doi.org/10.1002/jca.21705.
- Schwartz J, Padmanabhan A, Aqui N, Balogun RA, Connelly-Smith L, Delaney M et al. Guidelines on the use of therapeutic apheresis in clinical practice-evidence-based approach from the writing committee of the American society for apheresis: The seventh special issue. J Clin Apher. 2016;31(3):149-162. https://doi.org/10.1002/jca.21470.
- Erkılınç S, Eyi EGY. Factors contributing to adverse maternal outcomes in patients with HELLP syndrome. J Matern Fetal Neonatal Med. 2018;31(21):2870-2876. https://doi.org/10.1080/14767058.2017.1359528.








