
Журнал "Медицинский совет" №2/2025
DOI: 10.21518/ms2025-011
Е.В. Свечникова1,2, https://orcid.org/0000-0002-5885-4872, С.Е. Жуфина1, https://orcid.org/0000-0001-5694-2847
1 Поликлиника №1 Управления делами Президента Российской Федерации; 119002, Россия, Москва, переулок Сивцев Вражек, д. 26/28
2 Российский биотехнологический университет; 125080, Россия, Москва, Волоколамское шоссе, д. 11
Одним из нескольких сопутствующих заболеваний, связанных с хроническими воспалительными кожными заболеваниями, а именно с псориазом, является рак. Хотя хроническое воспалительное состояние может вызывать протуморогенные эффекты, ведутся споры о том, играют ли ведущую роль в развитии опухолей препараты, используемые в клинической практике. В последнее время терапевтический арсенал для лечения иммуноопосредованных хронических системных заболеваний значительно расширился за счет появления гетерогенных групп биологических препаратов, влияющих на иммунную систему. Множество споров вызывают вопросы, является ли факт развития злокачественных образований (ЗО) побочным эффектом лечения биологическими препаратами. В статье рассмотрены риски развития ЗО у пациентов с псориазом и их взаимосвязь, подходы к ведению пациентов с диагнозами «псориаз» и «рак», современные представления об иммунологических нарушениях при развитии ЗО, обзор исследований о роли препаратов генно-инженерной биологической терапии (ГИБТ) из различных групп в развитии опухолей различных локализаций. Пациенты с псориазом часто имеют в анамнезе сопутствующие заболевания, что затрудняет подбор необходимого лечения, однако тяжесть кожных проявлений требует системного лечения. Приводим клинический случай из практики о применении ГИБТ ингибитором интерлейкина-17 (ИЛ-17) у пациента с распространенным тяжелым псориазом и раком простаты в анамнезе. Увеличение доклинических данных также показало, что равновесие между ИЛ-12 и ИЛ-23 имеет решающее значение в онкогенезе и что нарушение сигнализации ИЛ-12 и/или ИЛ-23 как способствует, так и подавляет рост опухоли. Хотя механизмы, лежащие в основе этих биологических активностей, до конца не изучены, а интерпретация доклинических исследований участия ИЛ-12 и ИЛ-23 в биологии опухолей неоднозначна, клинические исследования указывают на то, что ингибиторы ИЛ-23 являются препаратами с хорошим профилем безопасности.
Для цитирования: Свечникова ЕВ, Жуфина СЕ. Псориаз и онкология: опыт применения ингибитора ИЛ-17 у пациента с тяжелым псориазом и раком простаты в анамнезе. Медицинский Совет. 2025;(2):50-58. https://doi.org/10.21518/ms2025-011
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Psoriasis and cancer: experience of using IL-17 inhibitor in a patient with severe psoriasis and a history of prostate cancer
Elena V. Svechnikova1,2, https://orcid.org/0000-0002-5885-4872, Svetlana E. Zhufina1, https://orcid.org/0000-0001-5694-2847
1 Polyclinic No. 1 of the Presidential Administration of the Russian Federation; 26/28, Sivtsev Vrazhek Lane, Moscow, 119002, Russia
2 Russian Biotechnological University; 11, Volokolamskoe Shosse, Moscow, 125080, Russia
One of several comorbidities associated with chronic inflammatory skin diseases, namely psoriasis, is cancer. Although a chronic inflammatory state may cause protumorigenic effects, there is debate as to whether drugs used in clinical practice play a leading role in tumor development. Recently, the therapeutic arsenal for the treatment of immune-mediated chronic systemic diseases has expanded significantly due to the emergence of heterogeneous groups of biological drugs that affect the immune system. A lot of controversy raises questions about whether the development of malignant tumors (MNT) is a side effect of treatment with biological drugs. The article discusses the risks of developing cancer in patients with psoriasis and their relationship, approaches to the management of patients diagnosed with psoriasis and cancer, modern ideas about immunological disorders during the development of cancer, a review of studies on the role of genetically engineered biological therapy (GEBT) drugs from various groups in development of tumors of various localizations. Patients with psoriasis often have a history of concomitant diseases, which makes it difficult to select the necessary treatment, however, the severity of skin manifestations requires systemic treatment. We present a clinical case from practice about the use of GIBT with an interleukin-17 inhibitor (IL-17) in a patient with widespread severe psoriasis and a history of prostate cancer. Increased preclinical evidence has also demonstrated that the balance between IL-12 and IL-23 is critical in carcinogenesis and that disruption of IL-12 and/or IL-23 signalling both promotes and suppresses tumour growth. Although the mechanisms underlying these biological activities have not been studied in depth and the interpretation of preclinical studies on the involvement of IL-12 and IL-23 in tumour biology is controversial, the clinical studies indicate that IL-23 inhibitors are drugs with a favourable safety profile.
For citation: Svechnikova EV, Zhufina SЕ. Psoriasis and cancer: experience of using IL-17 inhibitor in a patient with severe psoriasis and a history of prostate cancer. Meditsinskiy sovet = Medical Council. 2025;(2):50-58. (In Russ.) https://doi.org/10.21518/ms2025-011
Conflict of interest: the authors declare no conflict of interest.
Введение
Псориаз — хроническое воспалительное иммуноопосредованное заболевание кожи, которым страдает около 3% населения (125 млн человек во всем мире). Псориатические поражения являются результатом взаимодействия активированных дендритных клеток, Т-клеток и цитокинов, включая интерферон-γ, фактор некроза опухоли α (ФНО-α), интерлейкина-12 (ИЛ), ИЛ-17 и ИЛ-23. Повышенная концентрация провоспалительных цитокинов в сыворотке и в коже у пациентов с псориазом имеет решающее значение в патогенезе в качестве регуляции воспалительного пути Th17 [1]. Исследование патогенеза привело к выявлению новых терапевтических целей. В то время как старые варианты лечения, такие как фототерапия, метотрексат и циклоспорин А, по-прежнему эффективны, биотехнологические препараты существенно улучшают терапевтический арсенал. Успех новых методов лечения заключается в их высокой селективности действия, что позволяет в большинстве случаев достичь значительного улучшения за короткое время и поддерживать стойкую ремиссию с меньшим количеством побочных эффектов по сравнению с традиционными методами лечения. Биологические препараты представляют собой моноклональные антитела, способные избирательно вмешиваться на разных уровнях и с разными способами действия в иммунологические процессы воспаления. На сегодняшний день биологическая терапия псориаза и псориатического артрита представлена следующими классами препаратов: ингибиторы ФНО-α (этанерцепт, инфликсимаб и адалимумаб), ингибиторы ИЛ-12/23 (устекинумаб), ингибиторы ИЛ-17 (секукинумаб, иксекизумаб, нетакимаб и бродалумаб), ингибиторы ИЛ-23 (тилдракизумаб, гуселькумаб и рисанкизумаб) и химически синтезированными препаратами, такими как ингибитор фосфодиэстеразы типа 4 (ФДЭ4) апремиласт и ингибитор семейства Янус-киназ (JAK) тофацитиниб [2–6].
Псориаз и коморбидность
Для пациентов с псориазом и псориатическим артритом характерны такие коморбидные патологии, как сердечно-сосудистые заболевания, сахарный диабет 2-го типа, ожирение, метаболический синдром, заболевания почек, депрессия и др. [4]. Некоторые авторы выдвинули гипотезу о раке как о другом возможном сопутствующем заболевании псориаза. C 2013 г. в систематических обзорах и метаанализах сообщали, что пациенты с псориазом могут иметь повышенный риск некоторых солидных опухолей, лимфом и опухолей кератиноцитов [7]. Более того, некоторые исследования показали, что псориаз и рак имеют один и тот же экспосом. Общая распространенность рака у пациентов с псориазом составила 4,78%, с показателем заболеваемости 11,75 на 1000 человеко-лет и отношением риска (ОР) 1,21. Наблюдался повышенный риск нескольких видов рака, включая рак кератиноцитов (RR, 2,28), лимфомы (RR, 1,56), рак легких (RR, 1,26) и рак мочевого пузыря (RR, 1,12). Не было обнаружено повышенного риска рака у пациентов с псориазом, лечившихся биологическими агентами (RR, 0,97) [8, 9]. Другие исследования показывают, что у пациентов с псориазом также повышен риск развития рака прямой и толстой кишки, почек, гортани, печени, пищевода, полости рта и поджелудочной железы [10, 11]. Потенциальных факторов, способствующих связи между псориазом и раком, много, при этом значительную роль играет воздействие канцерогенов, связанное с образом жизни: курение табака, злоупотребление алкоголем и длительное воздействие солнечного света или ультрафиолетового света, более распространены среди пациентов с псориазом, потенциально способствуя повышенному риску рака губы, горла, легких, мочевого пузыря и немеланомного рака кожи. Кроме того, центральное ожирение и наличие самого псориаза, особенно если он тяжелый или сопровождается псориатическим артритом, вероятно, способствуют хроническому системному воспалению, которое может предрасполагать людей к развитию рака за счет сверхэкспрессии нескольких цитокинов [8–11]. Химические медиаторы воспаления, участвующие в патогенезе псориаза, могут повышать риск возникновения злокачественных новообразований за счет индукции прораковых мутаций, адаптивных реакций, устойчивости к апоптозу и изменений окружающей среды, таких как стимуляция ангиогенеза [2, 4, 5, 11].
Доказательства риска рака кожи у пациентов с хроническими воспалительными кожными заболеваниями, получающих таргетную терапию, по-прежнему скудны и противоречивы. Однако, поскольку эти препараты нацелены на молекулы, которые могут иметь отношение к механизмам иммунологической защиты от рака, были высказаны некоторые опасения относительно их связи с повышенным риском возникновения рака. Увеличение доклинических данных также показало, что равновесие между ИЛ-12 и ИЛ-23 имеет решающее значение в онкогенезе и что нарушение сигнализации ИЛ-12 и/или ИЛ-23 как способствует, так и подавляет рост опухоли. Хотя механизмы, лежащие в основе этих биологических активностей, до конца не изучены, а интерпретация доклинических исследований участия ИЛ-12 и ИЛ-23 в биологии опухолей неоднозначна, клинические исследования указывают на то, что ингибиторы ИЛ-23 являются препаратами с хорошим профилем безопасности [12].
S. Geller et. al. на основании изученных метаанализов с высоким уровнем доказательств пришли к выводу, что существует мало фактов о связи между некожными злокачественными новообразованиями и базисной противовоспалительной терапией псориаза, независимо от истории предшествующего рака. Существуют противоречивые данные относительно риска меланомы у пациентов, лечившихся препаратами анти-ФНО-α. Существует повышенный риск плоскоклеточного рака как для анти-ФНОα-препаратов, так и для небиологических методов лечения, который увеличивается при воздействии PUVA и/или иммуносупрессивном лечении [13].
Оценка исходного риска кожных злокачественных новообразований у пациентов с псориазом является сложной задачей из-за большинства исследований, включающих как леченых, так и нелеченых пациентов, а также из-за таких сопутствующих факторов, как фототерапия и иммуносупрессивная терапия. При рассмотрении риска рака кожи у пациентов с псориазом, проходящих лечение, следует проанализировать множество аспектов: предрасполагающие факторы, продолжительность и время воздействия, кумулятивная доза, взаимодействие с другими канцерогенами, а также латентность. Несмотря на все эти данные, которые следует учитывать, достаточно доказательств, подтверждающих связь между раком кожи и специфическим лечением псориаза, и выяснилось, что риск увеличивается еще больше по отношению к нелеченым пациентам [14]. Более того, известно, что немеланомный рак кожи (НМРК) и меланома чаще возникают у пациентов, перенесших лучевую или иммуносупрессивную терапию, например у пациентов с ятрогенным иммуносупрессивным эффектом после трансплантации солидного органа. По данным Всемирной организации здравоохранения, стандартизированная по возрасту мировая заболеваемость меланомой и НМРК составляет, соответственно, 3,4 и 11 на 100 000 населения. С другой стороны, последние данные, полученные из литературы, показывают, что рак кожи имеет более высокую заболеваемость у пациентов с псориазом, чем в общей популяции, со стандартизированным коэффициентом заболеваемости 3,37 (95% ДИ 1,84–5,66). Более подробно С. Pouplard et al. в метаанализе сообщили о стандартизированном коэффициенте заболеваемости 5,3 для плоскоклеточного рака (SCC) (95% ДИ 2,63–10,71) и 2,00 для базальноклеточного рака (BCC) (95% ДИ 1,83–2,20), тогда как авторы сообщили о схожем риске меланомы у пациентов с псориазом по сравнению с общей популяцией [15, 16].
Наблюдательные исследования сообщили о связи между псориазом и риском рака легких (LUCA). Однако неясно, является ли псориаз причинно связанным с раком легких. Например, на основе когорты UK Biobank M. Хе et al. обнаружили, что псориаз увеличивает риск LUCA примерно на 60% среди европейцев [17]. Данные метаанализа также предполагают, что у пациентов с псориазом риск LUCA был в 1,26 раза выше, чем у тех, у кого псориаз не был диагностирован [11]. Эти результаты указывают на то, что псориаз может играть роль в развитии LUCA. Однако W. Xiuqing et al. провели два независимых анализа Менделеевской рандомизации (MR) с двумя выборками и метаанализ на основе двух независимых оценок MR для оценки причинно-следственной связи между псориазом и LUCA, а также его подтипами, плоскоклеточным раком (LUSC) и аденокарциномой (LUAD). И полученные результаты не подтверждают генетическую связь между псориазом и раком легких и его подтипами [18].
L. Rusiñol et al., оценивая взаимосвязь псориаза и ЗО, провели ретроспективное наблюдательное исследование среди пациентов с псориазом средней и тяжелой степени тяжести и онкологическими заболеваниями, получавших биологическую терапию, которые проходили лечение в период с января 2009 г. по июнь 2022 г. Включили 31 взрослого пациента с псориазом и раком; у 16 диагноз рака предшествовал началу биологического лечения, и 9 из этих пациентов находились в стадии ремиссии. Большинство злокачественных новообразований возникло в мочеполовой системе, за которой следовали рак молочной железы, гематологические, колоректальные и рак щитовидной железы. Чаще всего использовались биологические препараты против IL23p19 (36%), за которыми следовали анти-TNF (32%), анти-IL-17 (16%) и анти-IL-12/23 (16%). У всех пациентов наблюдалось улучшение псориаза после начала биологического лечения. И делают вывод, что биологическое лечение псориаза средней и тяжелой степени следует рассматривать у онкологических пациентов, поскольку оно формально не противопоказано и является безопасным. Более того, применение ингибиторов ИЛ-23 и ИЛ-17 является предпочтительным для таких пациентов [19].
Австралийские и новозеландские ученые связывают повышенный риск рака у пациентов с псориазом с нарушением иммунного надзора, иммуномодулирующим лечением, хроническим воспалением и/или сопутствующими факторами риска. Рост числа случаев солидного рака, включая рак мочевого пузыря, ротоглотки/гортани, печени/желчного пузыря и толстой/прямой кишки, связан с алкоголем и курением. Рак легких и немеланомный рак кожи также увеличиваются у пациентов с псориазом. Риск немеланомного рака кожи увеличивается с возрастом и тяжестью псориаза. Он также выше у мужчин, особенно для плоскоклеточного рака, что может быть следствием предыдущего воздействия ПУВА и/или циклоспорина. Риск кожной Т-клеточной лимфомы существенно выше у пациентов с умеренно-тяжелым или тяжелым псориазом. Биологические методы лечения независимо связаны с небольшим повышением риска рака, но это меньше, чем у циклоспорина, при этом риск спутан с тяжестью заболевания и другими сопутствующими факторами риска. Риск рака от низких доз метотрексата, вероятно, минимален. Напротив, ацитретин, вероятно, защищает от различных солидных и гематологических злокачественных новообразований. Для оценки рисков развития рака при терапии малыми молекулами, такими как апремиласт, требуется больше опыта, хотя на данном этапе их применения никаких сигналов пока не выявлено. Решение о прекращении иммуномодулирующего лечения псориаза после постановки диагноза рака и его возобновлении необходимо рассматривать в контексте конкретного вида рака у пациента. Индивидуальный подход рекомендует учитывать взаимодействия лекарств с терапией, направленной на лечение рака, включая радиотерапию, и оценивать риски развития серьезных инфекций [10, 19].
Особое внимание стоит обратить на возраст пациентов с псориазом, т. к. известно, что у пациентов старше 60 лет повышаются риски развития сопутствующих заболеваний, в т. ч. и онкологических. Так, метаанализ включающий 14 уникальных исследований, в которых приняли участие 4 719 пожилых пользователей биопрепаратов, 13 305 молодых пользователей биопрепаратов и 3 961 пожилой пациент, которые не использовали биопрепараты, подтверждает факт, что пожилой возраст связан со значительным увеличением риска злокачественных новообразований (OR, 3,07; 95% ДИ, 1,98–4,62) по сравнению с более молодым возрастом, однако не было выявлено существенных различий в вероятности злокачественных новообразований (0,54, 95% ДИ, 0,28–1,05) или смерти (OR, 1,52; 95% ДИ, 0,44–5,28) у пожилых пациентов, получавших биологическое лечение, по сравнению с пожилыми пациентами, не принимавшими биологические препараты [20], что подтверждает безопасность применения ГИБТ у пожилых пациентов с иммуноопосредованными заболеваниями.
P. Palakornkitti et al. изучили дерматологические нежелательные явления при применении ГИБТ, в т. ч. риски ЗО кожи для разных групп биологических препаратов. Всего из PubMed было идентифицировано и отобрано 127 подходящих исследований (41 клиническое исследование, 14 наблюдательных исследований, 16 клинических исследований и 56 сообщений о случаях). Из этих исследований 76 были связаны с ингибиторами ФНО-α (25 инфликсимаб, 25 адалимумаб, 26 этанерцепт и 0 цертолизумаб), 16 были привязаны к ингибитору IL-12/23 (16 устекинумаб), 36 были связаны с ингибиторами IL17 (19 секукинумаб, 8 иксекизумаб, 5 бродалумаб и 4 бимекизумаб), а 11 – с ингибиторами IL-23 (5 гуселькумаб, 3 тилдракизумаб, 3 рисанкизумаб). Общее количество изученных пациентов составило 671 для инфликсимаба, 11 226 для адалимумаба, 3 340 для этанерцепта, 4 614 для устекинумаба, 3 153 для секукинумаба, 3 370 для иксекизумаба, 2 620 для бродалумаба, 1 011 для бимекизумаба, 1 171 для гуселькумаба, 532 для тилдракизумаба и 930 для рисанкизумаба.
Поскольку ФНО-α регулирует многие аспекты клеточной функции, включая пролиферацию, активацию, дифференцировку и апоптоз, блокирование ФНО-α может нарушить механизм подавления опухоли за счет ингибирования цитотоксических эффектов ФНО-α. Следовательно, ингибиторы ФНО-α могут вызывать быструю пролиферацию эпителиальных опухолей. Неоднократно в исследованиях по нежелательным эффектам биологических препаратов группы ингибиторов ФНО-α отмечается повышенный риск НМРК, к которому относятся базальноклеточная карцинома и плоскоклеточная карцинома. Аналогичным образом количество меланом, наблюдавшихся у пациентов, получавших ингибиторы ФНО-α, было выше, чем у пациентов, получавших лечение ингибитором ИЛ-12/23, ингибиторами ИЛ-17 и ИЛ-23. Однако существуют некоторые ограничения из-за данных о риске развития рака из включенных исследований, т. к. большинство пациентов со среднетяжелым и тяжелым псориазом ранее сталкивались с иммуносупрессивными методами лечения перед приемом ингибиторов ФНО-α (например, ПУВА-терапия). Для ингибитора ИЛ-12/23 на втором месте по частоте нежелательных дерматологических явлений были новообразования кожи (1,20%). Заболеваемость НМРК у пациентов, получавших устекинумаб, занял третье место после этанерцепта (2,04%) и адалимумаба (1,26%). Наиболее частым типом НМРК была базальноклеточная карцинома, за которой следовал плоскоклеточный рак. Тем не менее прием устекинумаба не был связан с повышенным риском малигнизации. По сравнению с другими биологическими классами ингибиторы ИЛ-17 (секукинумаб, иксекизумаб, бродалумаб, бимекизумаб) имели наименьшую частоту новообразований кожи (0,21%). Не получено определенного доказательства, подтверждающего повышенный риск злокачественных новообразований, связанный с ингибиторами ИЛ-17. Частота новообразований кожи после лечения ингибитором IL-23 (гуселькумаб, тилдракизумаб, ризанкизумаб) составила 0,95%. Доброкачественные новообразования кожи встречались чаще. Зарегистрированные злокачественные новообразования в виде НМРК составили всего 0,38% [20–23].
Подобные исследования активно помогают в практике при выборе подходящего системного препарата для пациента с тяжелым и среднетяжелым псориазом с сопутствующими коморбидными состояниями. Представляем клинический случай лечения пациента с псориазом тяжелого течения и раком простаты ГИБТ ингибитором ИЛ-17.
Клинический случай
Пациент А., 64 года, страдает распространенным вульгарным псориазом в течение 15 лет. Имеет сопутствующие заболевания: «Ишемическая болезнь сердца. Атеросклеротическая болезнь сердца. Гипертоническая болезнь II ст., артериальная гипертензия 1 ст., 2 ст., риск очень высокий. Нарушение ритма сердца: наджелудочковая экстрасистолия. Атерогенная дислипидемия. Пролапс митрального клапана 2 ст. Хроническая ишемия головного мозга 2 ст. Нестенозирующий, гемодинамически незначимый атеросклероз внечерепных отделов брахиоцефальных артерий. Умеренные когнитивные нарушения. Диссомния. Сахарный диабет 2-го типа». Целевой уровень НвА1с нормальный. Из анамнеза известно, что пациент длительно получал топическую терапию псориаза с временным положительным эффектом. С 2020 г. в связи с распространенностью кожного процесса, наличием ониходистрофии, сокращением периодов ремиссий на фоне наружной терапии в течение последних лет пациент был обследован (клинический анализ крови, общий анализ мочи, биохимический анализ крови – глюкоза, АЛТ, АСТ, ГГТ, щелочная фосфатаза, общий билирубин, общий холестерин и липидный профиль, мочевина, креатинин, С-реактивный белок, обследование на инфекции – ВИЧ, гепатиты В, С, сифилис, диаскин-тест, Rg органов грудной клетки, УЗИ органов малого таза и брюшной полости, консультация терапевта) с целью дальнейшего назначения ГИБТ, противопоказаний выявлено не было, и с 16.06.2020 г. начат курс инициации ингибитором ИЛ-17 секукинумабом (Козентикс) в дозе 300 мг (2 подкожные инъекции по 150 мг каждая) на 0, 1, 2 и 3-й нед., в последующем препарат вводился ежемесячно в качестве поддерживающей дозы начиная с 4-й нед.; параллельно получал стандартную наружную терапию (топические глюкокортикостероиды [ТГКС], эмоленты). Терапия в течение 4 мес. с выраженным положительным эффектом, отмечалась ремиссия. ГИБТ секукинумабом была отменена в связи с выявлением рака простаты. Дальнейшее лечение пациент проходил в онкологическом отделении.
Уже в декабре 2020 г. пациент снова обратился к врачу-дерматовенерологу в связи с ухудшением со стороны кожи, был поставлен диагноз «Распространенный вульгарный псориаз, прогрессирующая стадия. Псориатическая ониходистрофия». Ревматологом поликлиники был исключен псориатический артрит. В течение года была проведена наружная стандартная терапия, рекомендован лечебно-охранительный режим, однако под контроль взять заболевание не удалось. После тщательного обследования пациента консилиумом (лечащий врач-дерматовенеролог, заведующая отделением дерматовенерологии и косметологии и врач-онколог) было принято решение о том, что пациенту возможно применение терапии блокатором ИЛ-17 или блокатором ИЛ-23 с осуществлением строгого динамического контроля со стороны онколога/уролога.
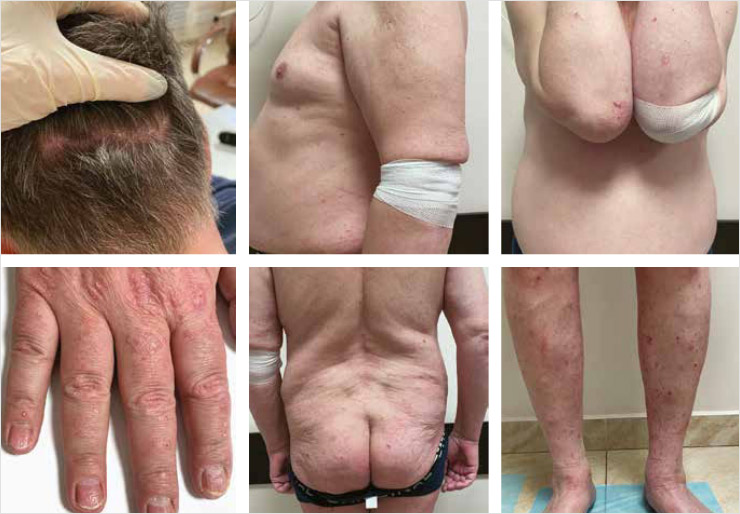
Клиническая картина до начала лечения представлена на рис 1. Патологический кожный процесс носил хронический, распространенный характер, локализовался на коже волосистой части головы, на коже туловища (спины, грудной клетки, передней брюшной стенки, ягодиц), верхних и нижних конечностей, представлен множественными псориатическими папулами до 1 см, сливающимися в бляшки, размером до 5–7 см, ярко-розового цвета, с четкими контурами, выраженной инфильтрацией, серебристо-белыми чешуйками на поверхности, сопровождающимися зудом. В области ногтевых пластин кистей и стоп отмечался подногтевой гиперкератоз, положительный симптом «масляного пятна» и «наперстка» (точечной атрофии), очаги онихолизиса. Значение индексов оценки псориаза: BSA – 73%, PASI – 34,2, NAPSI – 47. Данные индексы отражают поражение 73% площади тела, тяжелое течение заболевания и наличие псориатической ониходистрофии.
Рисунок 1. Клиническая картина до начала лечения препаратом иксекизумаб, февраль 2021 г.
18.02.2022 г. начат курс инициации ингибитором ИЛ-17 иксекизумабом (Талс), 80 мг подкожно по стандартной рекомендованной схеме: в первый день начала лечения препарат вводят в дозе 160 мг (две инъекции по 80 мг каждая), следующее введение осуществляли через 2 нед. (одна инъекция в дозе 80 мг). В последующем препарат вводится 1 раз в 2 нед. в дозе 80 мг через 4, 6, 8, 10 и 12 нед. с момента первого введения. После 12 нед. лечения введение 80 мг (одна инъекция) каждые 4 нед. в качестве поддерживающей терапии.
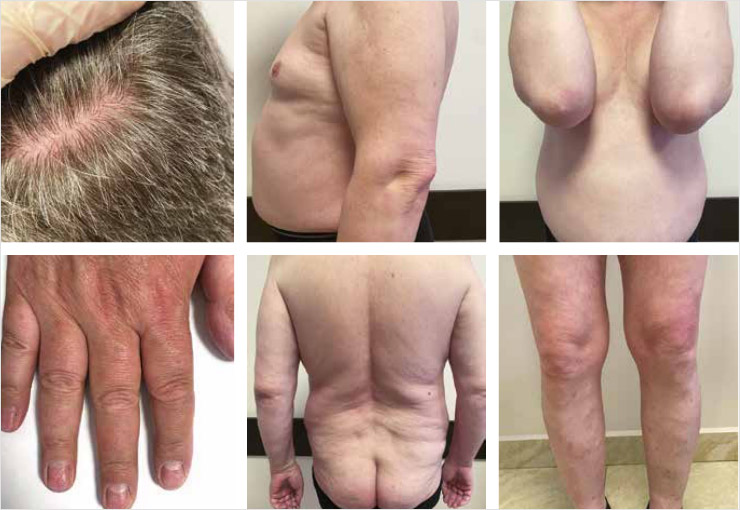
Лечение пациент переносит удовлетворительно, терапия с положительным эффектом. В результате уже к 6-й нед. лечения было достигнуто значительное улучшение, полный регресс высыпаний на коже волосистой части головы, туловища и конечностей (рис. 2), достигнут результат PASI100. Нежелательных явлений и осложнений со стороны сердечно-сосудистой, пищеварительной, эндокринной систем не отмечалось. Стандартный лабораторный контроль без отрицательной динамики. Пациент получает лечение иксекизумабом по настоящее время (2024 г.) под строгим контролем врача-дерматовенеролога, онколога и находится в стадии ремиссии псориаза.
Рисунок 2. Клиническая картина на 6-й нед. лечения иксекизумабом
Обсуждение
Лечение с помощью биологических методов иногда порождает неопределенность, поскольку теоретически они могут оказывать воздействие как на врожденные, так и на адаптивные пути иммунологической защиты от рака. Как говорилось выше, риски развития ЗО при псориазе значительно ассоциированы с многими сопутствующими канцерогенными факторами. Повышенный риск онкологии при применении ГИБТ, и в частности анти-ИЛ-17, во многих крупных исследованиях не был подтвержден, статистически значимого увеличения риска рака у пациентов, проходящих биологическую терапию, не наблюдается. Напротив, данную группу препаратов рекомендуют как предпочтительную при подборе терапии для этой группы пациентов с псориазом, чтобы обеспечить их качественной дерматологической помощью.
В целом имеющихся данных, которыми могли бы руководствоваться дерматологи при лечении псориаза у онкологических больных, недостаточно, и большинство клинических рекомендаций содержат общие или неоднозначные сведения по лечению таких пациентов.
Рабочая группа по псориазу Испанской академии дерматологии и венерологии (AEDV) достигла консенсуса, используя метод Дельфи, по ряду рекомендаций, касающихся ведения и терапевтического подхода к онкологическим больным псориазом [24]. Первым важным моментом в рекомендациях, так же как и в рекомендациях Американской академии дерматологии (AAD-NPF) и Британской ассоциации дерматологов (BAD), является профилактика ЗО у пациентов с псориазом, что включает в себя информирование пациентов о их кожном заболевании и связанных с ним сопутствующих патологий, в т. ч. активное участие в скрининговых обследованиях пациентов с псориазом по раку в соответствии с их возрастом и полом, особенно применяя проактивный подход к выявлению рака кожи, оценивая состояние кожи на предмет предраковых поражений, меланомы и немеланомного рака, лимфомы [25, 26].
Основываясь на рекомендациях EuroGuiDerm, BAD, BETA-PSO, французских (Groupe de Recherche sur le Psoriasis de la Société Française de Dermatologie) и испанских рекомендациях врачей общей практики, исследователи пришли к мнению, что лечение псориаза у больных активным раком необходимо обсуждать/согласовывать с онкологом/гематологом в каждом отдельном случае, оценивая активность онкологического заболевания, пользу и возможные риски при применении системного лечения псориаза. При этом в целом ацитретин и апремиласт будут наиболее подходящими небиологическими системными препаратами для лечения псориаза у онкологических больных. Использовать апремиласт рекомендуется с осторожностью из-за недостаточности данных о долгосрочной безопасности. Среди доступных биологических методов лечения анти-ИЛ-23 и анти-ИЛ-17 считаются оптимальными терапевтическими вариантами [27, 28].
Как псорален, так и фотохимиотерапия UVA (PUVA), а также фототерапия UVB расцениваются подходящими терапевтическими вариантами для пациентов с псориазом и новообразованиями в целом (активными и неактивными), кроме пациентов с кожным раком или предрасположенностью к нему [29].
Стоит обратить внимание, что руководства AEDV, EuroGuiDerm, BETA-PSO и французское руководство не рекомендуют использовать циклоспорин пациентам с псориазом и раком в анамнезе, особенно в случаях агрессивного или инвазивного плоскоклеточного рака [24–29].
Метотрексат не подходит пациентам с активными гематологическими злокачественными новообразованиями, учитывая его цитопенический эффект [24]. Спорным остается вопрос о возможности его применения у пациентов с базальноклеточным и плоскоклеточным раком кожи. Рандомизированное клиническое исследование, проведенное среди взрослых пациентов с сердечно-сосудистыми заболеваниями, диабетом или метаболическим синдромом, выявило связь между использованием низких доз метотрексата и повышенным риском рака кожи [30]. Исследование «случай-контроль» среди населения Дании выявило связь между диагнозом рака кожи (меланома и НМРК) и лечением метотрексатом (кумулятивная доза ≥ 2,5 г) дозозависимым образом, хотя у пациентов с псориазом связь продолжала оставаться значимой (отношение шансов = 1,43) для базальноклеточного рака [31]. Однако в рекомендациях EuroGuiDerm и врачей общей практики говорится, что метотрексат может использоваться в качестве системного лечения у пациентов с псориазом и раком в анамнезе в случае неадекватного ответа или противопоказаний к использованию местного лечения, фототерапии UVB или ацитретина. Аналогичным образом руководство BETA-PSO включает использование метотрексата у пациентов с псориазом, солидным, гематологическим, меланомным и немеланомным раком кожи [32, 33].
Согласно рекомендациям AEDV ингибиторы ФНО-α, такие как инфликсимаб, адалимумаб, цертолизумаб, считаются неподходящим терапевтическим вариантом у пациентов с псориазом и гематологическими (активными или неактивными) и активными негематологическими злокачественными новообразованиями, а этанерцепт возможно рассматривать для пациентов с псориазом и немеланомным раком кожи, но не применять для пациентов с активными гематологическими злокачественными новообразованиями. Рекомендуют обсуждать применение анти-ФНО-терапии в каждом случае с онкологом, другими специалистами и самим пациентом.
Ингибитор ИЛ-12 и ИЛ-23 устекинумаб рекомендуется рассматривать как один из возможных вариантов терапии у пациентов с псориазом и раком (немеланомным раком кожи и неактивными злокачественными новообразованиями) в анамнезе.
Лечение анти-IL-23 и анти-IL-17 является подходящим вариантом терапии у онкологических больных с псориазом. Рекомендации AEDV, EuroGuiDerm и BETA-PSO предлагают, что анти-IL-23 и анти-IL-17 могут использоваться у этих пациентов, хотя и с осторожностью, учитывая отсутствие опыта и данных о долгосрочной безопасности [24, 27, 32].
Для онкологических больных, получающих ингибиторы контрольных точек, характерно появление различных иммуноопосредованных кожных побочных эффектов, таких как псориаз [34, 35]. Систематический обзор обсервационных исследований показал, что наиболее распространенным в данном случае является местное лечение кортикостероидами, за которым следует использование ацитретина, системных стероидов, фототерапии, метотрексата и биологических агентов. Что касается использования новых методов лечения, различные публикации показали, что ингибиторы IL-17 и IL-23 являются эффективным и безопасным терапевтическим вариантом для лечения псориаза, связанного с иммунной активацией [36, 37]. Экспертная группа сделала вывод, что подходящим вариантом лечения онкологических больных, получающих ингибиторы контрольных точек, у которых развились или обострились другие патологии, такие как колит, гепатит, эндокринопатии и нефрит или заболевания почек, являются местные препараты и ГИБТ, а традиционное системное лечение при данных патологиях следует избегать.
Заключение
Активное изучение коморбидных патологий при псориазе привело к пониманию рисков развития ЗО у этих пациентов. Накопленный опыт клинических исследований и наблюдений является залогом для будущих перспективных долгосрочных когортных исследований у пациентов с псориазом, у которых развилось онкологическое заболевание и лечившихся системной терапией, включая биологические препараты. Выявлено, что пациенты с псориазом, особенно средней и тяжелой степени тяжести, подвержены повышенному риску развития ЗО, особенно кожи. Поэтому врачам-дерматовенерологам рекомендуется учитывать данный факт и обеспечивать пациентов с псориазом своевременным профилактическим скринингом, междисциплинарным подходом к ведению. Важным моментом является лечение пациентов с онкологией в анамнезе и с активными формами онкологического процесса, при развитии ухудшения со стороны кожи, не оставлять пациента без качественного лечения, учитывая все потенциальные риски и пользу, принимать решение о системной терапии совместно с врачом-онкологом. Решение о выборе системного препарата, о назначении, отмене или возобновлении иммуномодулирующего лечения псориаза следует рассматривать в контексте конкретного вида рака у пациента.
Список литературы / References
- Calapai F, Mannucci C, Cardia L, Currò M, Calapai G, Esposito E, Ammendolia I. Suspected oncologic adverse reactions associated with interleukin-23 inhibitors in EudraVigilance: Comparative study and gender distribution. Pharmacol Res Perspect. 2023;11(5):e01130. https://doi.org/10.1002/prp2.1130.
- Crisafulli S, Bertino L, Fontana A, Calapai F, Ingrasciotta Y, Berretta M et al. Incidence of Skin Cancer in Patients With Chronic Inflammatory Cutaneous Diseases on Targeted Therapies: A Systematic Review and Meta-Analysis of Observational Studies. Front Oncol. 2021;11:687432. https://doi.org/10.3389/fonc.2021.687432.
- Armstrong AW, Read C. Pathophysiology, Clinical Presentation, and Treatment of Psoriasis: A Review. JAMA. 2020;323(19):1945-1960. https://doi.org/10.1001/jama.2020.4006.
- Kaushik SB, Lebwohl MG. Psoriasis: Which therapy for which patient: Psoriasis comorbidities and preferred systemic agents. J Am Acad Dermatol. 2019;80(1):27-40. https://doi.org/10.1016/j.jaad.2018.06.057.
- Kamata M, Tada Y. Efficacy and Safety of Biologics for Psoriasis and Psoriatic Arthritis and Their Impact on Comorbidities: A Literature Review. Int J Mol Sci. 2020;21(5):1690. https://doi.org/10.3390/ijms21051690.
- Ceccarelli M, Venanzi Rullo E, Berretta M, Cacopardo B, Pellicanò GF, Nunnari G et al. New Generation Biologics for the Treatment of Psoriasis and Psoriatic Arthritis. State of the Art and Considerations About the Risk of Infection. Dermatol Ther. 2021;34(1):e14660. https://doi.org/10.1111/dth.14660.
- Pouplard C, Brenaut E, Horreau C, Barnetche T, Misery L, Richard MA et al. Risk of cancer in psoriasis: a systematic review and meta-analysis of epidemiological studies. J Eur Acad Dermatol Venereol. 2013;27(Suppl. 3):36-46. https://doi.org/10.1111/jdv.12165.
- Battista T, Gallo L, Martora F, Fattore D, Potestio L, Cacciapuoti S et al. Biological Therapy for Psoriasis in Cancer Patients: An 8-Year Retrospective Real-Life Study. J Clin Med. 2024;13(7):1940. https://doi.org/10.3390/jcm13071940.
- Vaengebjerg S, Skov L, Egeberg A, Loft ND. Prevalence, Incidence, and Risk of Cancer in Patients With Psoriasis and Psoriatic Arthritis: A Systematic Review and Meta-analysis. JAMA Dermatol. 2020;156(4):421-429. https://doi.org/10.1001/jamadermatol.2020.0024.
- Rademaker M, Rubel DM, Agnew K, Andrews M, Armour KS, Baker C et al. Psoriasis and cancer. An Australian/New Zealand narrative. Australas J Dermatol. 2019;60:12-18. https://doi.org/10.1111/ajd.12889.
- Loft ND, Vaengebjerg S, Skov L. Cancer risk in patients with psoriasis: Should we be paying more attention? Expert Rev Clin Immunol. 2020;16:479-492. https://doi.org/10.1080/1744666X.2020.1754194.
- Ruggiero A, Picone V, Martora F, Fabbrocini G, Megna M. Guselkumab, Risankizumab, and Tildrakizumab in the Management of Psoriasis: A Review of the Real-World Evidence. Clin Cosmet Investig Dermatol. 2022;15:1649-1658. https://doi.org/15:1649‐1658.
- Geller S, Xu H, Lebwohl M, Nardone B, Lacouture ME, Kheterpal M. Malignancy Risk and Recurrence with Psoriasis and its Treatments: A Concise Update. Am J Clin Dermatol. 2018;19(3):363-375. https://doi.org/10.1007/s40257-017-0337-2.
- Shah IA. Beneficial Role of Vitamin D in Common Cancers: Is the Evidence Compelling Enough? WCRJ. 2020;7:e1574. https://doi.org/10.32113/wcrj_20205_1574.
- Collins L, Asfour L, Stephany M, Lear JT, Stasko T. Management of Nonmelanoma Skin Cancer in Transplant Recipients. Clin Oncol. 2019;31(11):779-788. https://doi.org/10.1016/j.clon.2019.08.005.
- Paul CF, Gourraud PA. Cancer risk evaluation in psoriasis: in search of the Holy Grail? J Invest Dermatol. 2009;129(11):2547-2549. https://doi.org/10.1038/jid.2009.203.
- He MM, Lo CH, Wang K, Polychronidis G, Wang L, Zhong R et al. Immunemediated diseases associated with cancer risks. JAMA Oncol. 2022;8(2):209-219. https://doi.org/10.1001/jamaoncol.2021.5680.
- Wang X, Wang X, Wang H, Yang M, Dong W, Shao D. Association between psoriasis and lung cancer: two-sample Mendelian randomization analyses. BMC Pulm Med. 2023;23(1):4. https://doi.org/10.1186/s12890-022-02297-0.
- Rusiñol L, Camiña-Conforto G, Puig L. Biologic treatment of psoriasis in oncologic patients. Expert Opin Biol Ther. 2022;22(12):1567-1578. https://doi.org/10.1080/14712598.2022.2152322.
- Borren NZ, Ananthakrishnan AN. Safety of Biologic Therapy in Older Patients With Immune-Mediated Diseases: A Systematic Review and Metaanalysis. Clin Gastroenterol Hepatol. 2019;17(9):1736-1743.e4. https://doi.org/10.1016/j.cgh.2018.12.032.
- Palakornkitti P, Nimmannitya K, Rattanakaemakorn P. Biological therapy in Psoriasis: An emphasis on its dermatologic adverse events. Asian Pac J Allergy Immunol. 2021;39(4):215-230. https://doi.org/10.12932/AP110521-1129.
- Menter A, Strober BE, Kaplan DH, Kivelevitch D, Prater EF, Stoff B et al. Joint AAD-NPF guidelines of care for the management and treatment of psoriasis with biologics. J Am Acad Dermatol. 2019;80(4):1029-1072. https://doi.org/10.1016/j.jaad.2018.11.057.
- Wu S, Xu Y, Yang L, Guo L, Jiang X. Short-term risk and long-term incidence rate of infection and malignancy with IL-17 and IL-23 inhibitors in adult patients with psoriasis and psoriatic arthritis: a systematic review and meta-analysis. Front Immunol. 2023;14:1294416. https://doi.org/10.3389/fimmu.2023.1294416.
- Puig L, Notario J, López-Ferrer A, Scheneller-Pavelescu L, Pérez B, Galache C et al. Recommendations from the Spanish Academy of Dermatology and Venereology Psoriasis Working Group on the Management of Patients with Cancer and Psoriasis. Actas Dermosifiliogr. 2024;115(7):702-711. https://doi.org/10.1016/j.ad.2024.02.013.
- Wang X, Liu Q, Wu L, Nie Z, Mei Z. Risk of non-melanoma skin cancer in patients with psoriasis: An updated evidence from systematic review with meta-analysis. J Cancer. 2020;11(5):1047-1055. https://doi.org/10.7150/jca.37015.
- Trafford AM, Parisi R, Kontopantelis E, Griffiths CEM, Ashcroft DM. Association of Psoriasis With the Risk of Developing or Dying of Cancer: A Systematic Review and Meta-analysis. JAMA Dermatol. 2019;155(12):1390-1403. https://doi.org/10.1001/jamadermatol.2019.3056.
- Lambert JLW, Segaert S, Ghislain PD, Hillary T, Nikkels A, Willaert F et al. Practical recommendations for systemic treatment in psoriasis in case of coexisting inflammatory, neurologic, infectious or malignant disorders (BETA-PSO: Belgian Evidence-based Treatment Advice in Psoriasis; part 2). J Eur Acad Dermatol Venereol. 2020;34(9):1914-1923. https://doi.org/10.1111/jdv.16683.
- Amatore F, Villani AP, Tauber M, Viguier M, Guillot B; Psoriasis Research Group of the French Society of Dermatology (Groupe de Recherche sur le Psoriasis de la Société Française de Dermatologie). French guidelines on the use of systemic treatments for moderate-to-severe psoriasis in adults. J Eur Acad Dermatol Venereol. 2019;33(3):464-483. https://doi.org/10.1111/jdv.15340.
- Thatiparthi A, Martin A, Liu J, Wu JJ. Risk of Skin Cancer with Phototherapy in Moderate-to-Severe Psoriasis: An Updated Systematic Review. J Clin Aesthet Dermatol. 2022;15(6):68-75. Available at: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9239121.
- Solomon DH, Glynn RJ, Karlson EW, Lu F, Corrigan C, Colls J et al. Adverse Effects of Low-Dose Methotrexate: A Randomized Trial. Ann Intern Med. 2020;172(6):369-380. https://doi.org/10.7326/M19-3369.
- Polesie S, Gillstedt M, Schmidt SAJ, Egeberg A, Pottegård A, Kristensen K. Use of methotrexate and risk of skin cancer: a nationwide case-control study. Br J Cancer. 2023;128(7):1311-1319. https://doi.org/10.1038/s41416-023-02172-7.
- Nast A, Smith C, Spuls PI, Avila Valle G, Bata-Csörgö Z, Boonen H et al. EuroGuiDerm Guideline on the systemic treatment of Psoriasis vulgaris - Part 2: specific clinical and comorbid situations. J Eur Acad Dermatol Venereol. 2021;35(2):281-317. https://doi.org/10.1111/jdv.16926.
- Carrascosa JM, de la Cueva P, Ara M, Puig L, Bordas X, Carretero G et al. Methotrexate in Moderate to Severe Psoriasis: Review of the Literature and Expert Recommendations. Actas Dermosifiliogr. 2016;107(3):194-206. https://doi.org/10.1016/j.ad.2015.10.005.
- Geisler AN, Phillips GS, Barrios DM, Wu J, Leung DYM, Moy AP et al. Immune checkpoint inhibitor-related dermatologic adverse events. J Am Acad Dermatol. 2020;83(5):1255-1268. https://doi.org/10.1016/j.jaad.2020.03.132.
- Cutroneo P, Ingrasciotta Y, Isgrò V, Rullo EV, Berretta M, Fiorica F et al. Psoriasis and psoriasiform reactions secondary to immune checkpoint inhibitors. Dermatol Ther. 2021;34(2):e14830. https://doi.org/10.1111/dth.14830.
- Said JT, Elman SA, Perez-Chada LM, Mita C, Merola JF, LeBoeuf NR. Treatment of immune checkpoint inhibitor-mediated psoriasis: A systematic review. J Am Acad Dermatol. 2022;87(2):399-400. https://doi.org/10.1016/j.jaad.2022.02.030.
- Johnson D, Patel AB, Uemura MI, Trinh VA, Jackson N, Zobniw CM et al. IL17A Blockade Successfully Treated Psoriasiform Dermatologic Toxicity from Immunotherapy. Cancer Immunol Res. 2019;7(6):860-865. https://doi.org/10.1158/2326-6066.Cir-18-0682.








