
Журнал "Медицинский совет" № 11/2024
DOI: 10.21518/ms2024-267
С.В. Долбня1,2, А.А. Толкунова1,2, И.Н. Захарова3, В.Р. Понамарева1, Л.Я. Климов1, Л.Ю. Барычева1,2, Н.В. Зарытовская1, В.В. Кузнецова1,2 , Е.А. Енина1,2
1 Ставропольский государственный медицинский университет, 2 Краевая детская клиническая больница, 3 Российская медицинская академия непрерывного профессионального образования
Введение. На сегодняшний день недостаточно исследований, демонстрирующих влияние обеспеченности витамином D на продукцию провоспалительных цитокинов у детей с аллергическими заболеваниями, что явилось предпосылкой для выполнения исследования.
Цель. Проанализировать динамику показателей интерферона-γ, интерлейкина-17А и 33 у детей с бронхиальной астмой в зависимости от уровня кальцидиола в сыворотке крови до и на фоне дотации препаратами холекальциферола.
Материалы и методы. Обследован 71 ребенок в возрасте от 3 лет до 18 лет: 51 пациент с бронхиальной астмой и 20 детей контрольной группы. Всем детям назначался 3-месячный курс холекальциферола в профилактической дозе в соответствии с национальной программой. У обследованных детей двукратно определялись показатели 25(ОН)D, интерферона-γ, интерлейкина-17А и 33.
Результаты и обсуждение. Медиана 25(ОН)D у пациентов с бронхиальной астмой не достигала уровня здоровых детей ни до, ни после дотации препаратами холекальциферола в профилактических дозах. Прием витамина D приводил к снижению интерферона-γ у здоровых детей с 3,07 [2,29; 4,81] пг/ мл до 2,18 [1,74; 3,45] пг/ мл (р < 0,05). У пациентов с бронхиальной астмой данных изменений в исходной популяции выявлено не было, однако после дотации холекальциферола уровень интерферона-γ у них был значимо выше, чем у здоровых детей: 3,11 [0,89; 5,0] пг/ мл и 2,18 [1,74; 3,45] пг/ мл соответственно (р < 0,05). При анализе интерлейкина-17А у детей с бронхиальной астмой до дотации холекальциферола медиана цитокина была значимо выше, чем после дотации: 2,03 [0,1; 10,01] пг/ мл и 0,96 [0,1; 12,87] пг/ мл соответственно (р = 0,03). Медиана интерлейкина-17А у детей с бронхиальной астмой значимо выше, чем у здоровых детей как до, так и на фоне дотации холекальциферола. Медиана интерлейкина-33 значимо выше у детей с бронхиальной астмой по сравнению со здоровыми детьми как до, так и на фоне дотации витамином D.
Заключение. Выявлено наличие у холекальциферола модулирующего эффекта в отношении интерферона-γ и интерлейкина-17А у пациентов с бронхиальной астмой. Уровни интерлейкина-33 у детей с бронхиальной астмой на фоне приема холекальциферола значимо не изменялись.
Для цитирования: Долбня СВ, Толкунова АА, Захарова ИН, Понамарева ВР, Климов ЛЯ, Барычева ЛЮ, Зарытовская НВ, Кузнецова ВВ, Енина ЕА. Влияние дотации холекальциферола на уровень провоспалительных цитокинов у детей с бронхиальной астмой. Медицинский Совет. 2024;(11):119–129. https://doi.org/10.21518/ms2024-267
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
The effect of cholecalciferol subsidies on the level of pro-inflammatory cytokines in children with bronchial asthma
Svetlana V. Dolbnya1,2*, Anna A. Tolkunova1,2, Irina N. Zakharova3, Viktoriya R. Ponamaryova1, Leonid Ya. Klimov1, Liudmila Yu. Barycheva1,2, Natalia V. Zaritovskaya1, Vera V. Kuznetsova1,2, Elena A. Enina1,2
1 Stavropol State Medical University; 310, Mira St., Stavropol, 355017, Russia
2 Regional Children’s Clinical Hospital; 3, Semashko St., Stavropol, 355029, Russia
3 Russian Medical Academy of Continuing Professional Education; 2/1, Вldg. 1,
Barrikadnaya St., Moscow, 125993, Russia
Introduction. Currently, there are insufficient studies to demonstrate the effect of vitamin D status on the production of proinflammatory cytokines in children with allergic diseases, which precipitated this study.
Aim. To analyse interferon-γ, interleukin-17A and 33 profiles in children with asthma according to serum calcidiol levels before and during cholecalciferol subsidies.
Materials and methods. A total of 71 children aged 3 to 18 years were examined: 51 patients with asthma and 20 children in the control group. A 3-month cholecalciferol course at a prophylactic dose specified in the national program was prescribed to all children. 25(OH)D, interferon-γ, interleukin-17A and 33 levels were twice determined in the examined children.
Results and discussion. Median 25(OH)D levels in patients with asthma did not reach the levels of healthy children either before or after cholecalciferol subsidies at prophylactic doses. Vitamin D intake led to a decrease in interferon-γ levels in healthy children from 3.07 [2.29; 4.81] pg/ml to 2.18 [1.74; 3.45] pg/ml (p < 0.05). In patients with asthma, such changes were not detected in the initial population, however, after cholecalciferol subsidies their interferon-γ levels were significantly higher than those in healthy children: 3.11 [0.89; 5.0] pg/ml and 2.18 [1.74; 3.45] pg/ml, respectively (p < 0.05). Assessment results of interleukin-17A
levels in children with asthma showed that the median cytokine levels were significantly higher before the cholecalciferol subsidies than after them: 2.03 [0.1; 10.01] pg/ml and 0.96 [0.1; 12.87] pg/ml, respectively (p = 0.03). The median interleukin-17A levels in children with asthma were significantly higher than in healthy children, both before and during the cholecalciferol subsidies. The median interleukin-33 levels were significantly higher in children with asthma as compared to healthy children, both before and during vitamin D subsidies.
Conclusion. Our results suggest that cholecalciferol has a modulatory effect on interferon-γ and interleukin-17A in patients with asthma. Interleukin-33 levels did not change significantly in children with asthma on cholecalciferol.
For citation: Dolbnya SV, Tolkunova AA, Zakharova IN, Ponamaryova VR, Klimov LY, Barycheva LY, Zaritovskaya NV, Kuznetsova VV, Enina EA. The effect of cholecalciferol subsidies on the level of pro-inflammatory cytokines in children with bronchial asthma. Meditsinskiy sovet = Medical Council. 2024;(11):119–129. (In Russ.) https://doi.org/10.21518/ms2024-267
Conflict of interest: the authors declare no conflict of interest.
Введение
Согласно данным Европейского респираторного общества, бронхиальная астма (БА) занимает лидирующие позиции среди хронических заболеваний легких у детей. Глобальная инициатива по БА (Global Initiative for Asthma – 2023) определяет ее как гетерогенное заболевание дыхательных путей (ДП), обусловленное хроническим воспалением и характеризующееся наличием респираторных симптомов, таких как свистящие хрипы, одышка, удушье, заложенность в груди и кашель, которые варьируют по времени и интенсивности и проявляются вместе с вариабельной обструкцией ДП. По последним данным Центрального научно-исследовательского института организации и информатизации здравоохранения (2022), в России диагноз БА верифицирован у 1,591 млн пациентов, из которых 84 тыс. – подростки 15–17 лет, а 229 тыс. – дети в возрасте от 0 до 14 лет. Обострения БА представляют серьезную проблему для детей раннего возраста: требуют лекарственной терапии, влияют на качество жизни пациентов и лиц, ухаживающих за ними, ограничивая социальную и физическую активность [1, 2]. Частые обострения БА способствуют ремоделированию ДП, снижают функцию легких, ухудшают тяжесть заболевания, тем самым повышая риск потенциально опасных для жизни событий [2]. В данном аспекте понимание патогенеза БА как гетерогенного динамического сочетания нарушения регуляции иммунного ответа, хронического воспаления ДП, ремоделирования и гиперреактивности тканей бронхов определяет сложность выбора методов лечения и диктует необходимость подробного изучения механизмов, лежащих в основе заболевания [1].
В настоящее время выделяют два основных эндотипа БА – Т2-астма и не-Т2-астма. В свою очередь, эндотип Т2-астмы включает фенотипы аллергической, аспирин-индуцированной и поздней эозинофильной БА, тогда как не-Т2-астма фенотипически соответствует БА, ассоциированной с ожирением, нейтрофильной БА курильщиков и БА с очень поздним дебютом [3]. В основе Т2-астмы лежат реакции Th2-клеток и врожденных лимфоидных клеток 2-го типа (ILC2 – innate lymphoid cells 2), реализуемые посредством продукции характерного набора интерлейкинов (ИЛ). Данный эндотип сопряжен с атопическим дерматитом и аллергическим ринитом, а его формированию зачастую предшествует контакт с аллергеном в раннем возрасте [4]. При Т2-астме аллергены повреждают или активируют эпителиальные клетки (ЭК), вызывая высвобождение воспалительных цитокинов – тимического стромального лимфопоэтина, ИЛ-25 и ИЛ-33, которые непосредственно активируют ряд иммунных клеток, включая дендритные (ДК), ILC2 и Th-клетки [4]. Активированные ДК поглощают аллергены, продуцируют провоспалительные цитокины ИЛ-1β и ИЛ-6 и мигрируют в лимфатические узлы, где способствуют дифференцировке Th2-лимфоцитов, которые далее мигрируют обратно в легкие. Th2-клетки и ILC2 являются основными продуцентами цитокинов 2-го типа – ИЛ-4, -5, -9, -13 [5]. Регуляция активности эозинофилов в бронхах зависит в первую очередь от Th2-лимфоцитов и реализуется посредством ИЛ-5 [1, 6]. ИЛ-13, ИЛ-4 и медиаторы воспаления тучных клеток, базофилов и эозинофилов влияют на гиперреактивность и ремоделирование ДП [1]. Таким образом, реализуется нарушение равновесия эффектов Th1-лимфоцитов и Treg-клеток [7], стимулируется дифференцировка плазматических клеток и выработка IgE, поддерживается хроническое воспаление ДП – развиваются характерные симптомы аллергической БА [1, 5]. С другой стороны, и ЭК, и ДК поддерживают местный иммунный гомеостаз, предотвращая повреждение тканей провоспалительными факторами (ИЛ-10 и ИЛ-37) [7]. Так, цитокины 2-го типа и Th2-лифоциты, учитывая их центральную роль в патогенезе БА, являются основными мишенями для терапии [5], однако многим пациентам не удается достичь надлежащего контроля симптомов при помощи глюкокортикоидов (ГКС), что может свидетельствовать о наличии альтернативных и более устойчивых к ГКС источников цитокинов 2-го типа, реализующих резистентную к терапии БА [8].
У детей с БА обнаружены повышенные уровни ИЛ-33 в сыворотке крови, мокроте и бронхиальных биоптатах, которые коррелируют с тяжестью заболевания, степенью обструкции, Z-score FEF 75% и FeNO [9–11]. ИЛ-33 является членом семейства цитокинов ИЛ-1 и обильно экспрессируется фибробластами, ЭК и эндотелиальными клетками. Действуя через рецептор, подобный рецептору ИЛ-1 (IL-1RL1 – interleukin-1 receptor-like 1), он реализует ответы 2-го типа путем активации базофилов, эозинофилов, тучных клеток, макрофагов и ILC2 [10]. В культуре клеток ДП стимуляция ИЛ-33 приводит к усилению выработки регуляторов провоспалительных молекул (гранулоцитарно-макрофагального колониестимулирующего фактора, молекул клеточной адгезии ICAM-1, хемокина кератиноцитов), а выключение ИЛ-33 в присутствии ИЛ-37 в мышиной модели аллергической БА снижает уровни цитокинов Th2-клеток, эозинофилию ДП и выработку слизи [7]. Высказывается роль полиморфизма гена ИЛ-33 в эпителиальной предрасположенности к эозинофилии и БА [9]. Также дети с БА склонны к повышенной экспрессии и продукции ИЛ-17A и ИЛ-17F в мокроте, сыворотке крови, бронхиальных и назальных биоптатах. Уровень ИЛ-17A в стенке бронхов коррелирует со степенью нейтрофилии ДП и более выражен при среднетяжелой и тяжелой БА, а также у пациентов, склонных к частым обострениям [12]. По сравнению со здоровыми детьми, у пациентов с БА показатели ИЛ-17, ИЛ-27 и FeNO значительно выше и увеличиваются в момент обострения, положительно коррелируют с частотой дыхания и отрицательно – с продолжительностью вдоха и выдоха, пиковым временем и временем достижения пиковой скорости вдоха / общего времени выдоха (TPTEF/TE – time to reach peak tidal expiratory flow/total expiratory time) [13]. Высокую экспрессию ИЛ-17A обеспечивают Th17-клетки: формируется отличный от Т2-астмы эндотип БА с высоким уровнем Th17, которая ассоциирована с низким эффектом терапии ГКС и чаще называется нейтрофильной БА. Группа цитокинов ИЛ-17 активирует сигнальные каскады посредством транскрипционного фактора NF-κB, MAP, стабилизации матричной РНК и взаимодействия с другими факторами (фактор некроза опухоли-α, микробные стимулы), которые опосредуют экспрессию медиаторов воспаления (антимикробных пептидов, цитокинов, хемокинов) в клетках-мишенях. Разнообразные исследования показали, что ИЛ-17A способствует элиминации легочных патогенов, индуцирует выработку слизи и метаплазию бокаловидных клеток в эпителии ДП [12]. Подавление ИЛ-17А эффективно ингибирует ферроптоз ЭК in vivo посредством антиоксидантной системы xCT-GSH-GPX4 и уменьшения воспаления ДП [14].
Обострения БА часто связаны с респираторными вирусными инфекциями, которые запускают мощный ответ цитотоксических Т-клеток (Tc), компартмент Тс-клеток при БА претерпевает существенные фенотипические искажения из-за способности реагировать на ИЛ-33 и ИЛ-4, что приводит к функциональному сдвигу от продукции цитокинов 1-го типа (например, ИФН-γ) ко 2-му типу (ИЛ-5, ИЛ-9). Повышение циркулирующих Tc2-клеток при БА достигает пиков в момент обострения, ассоциировано с более тяжелым течением и резистентностью к ГКС. Это говорит о пластичности и способности к генерации неканонических Тс-клеток, что подтверждается в мышиной модели аллергического воспаления ДП снижением гиперреактивности и эозинофилии в ответ на истощение или генетическую делецию CD8+ Т-клеток [5]. Нельзя не упомянуть о доказанной роли перенесенного бронхиолита респираторно-синцитиальной (РС) вирусной этиологии в повышении риска рецидива свистящего дыхания (wheezing) и формирования БА. Обнаружены недостаточные уровни интерферонов (ИФН) 1-го и 3-го типа в ЭК бронхов у взрослых с атопической БА после перенесенной РС-вирусной инфекции [15].
Иммунные эффекты витамина D обусловливают интерес к изучению его влияния на профилактику и течение БА. Клетки дыхательной системы, первично участвующие в контакте с аллергеном, включая ЭК, альвеолярные макрофаги и ДК, содержат ген цитохрома P450, способный экспрессировать рецепторы витамина D (VDR – vitamin D receptor) на поверхности клетки, а также синтезировать фермент 1-альфа-гидроксилазу, который превращает 25(OH)D в активную форму 1,25(OH)2D. Последний индуцирует пролиферацию и ингибирование апоптоза после эпизода воспаления. Потеря VDR на поверхности клеток вызывает повреждение целостности эпителия [16], а в эксперименте мыши с дефицитом витамина D или без VDR демонстрируют более тяжелый фенотип БА, индуцированной аллергенами клещей домашней пыли [17].
Низкий уровень кальцидиола у пациентов с БА может быть связан с полиморфизмом генов VDR и белка – переносчика витамина D (VDBP – vitamin D binding protein), некоторые из которых ассоциированы с БА, атопией и эозинофилией [18, 19]. Витамин D также повышает экспрессию генов Toll-подобных рецепторов (TLR – Toll-like receptor), распознающих компоненты клеточных стенок и генома бактерий [16]. Согласно результатам клинических наблюдений, витамин D влияет на клеточное звено иммунитета, регулируя баланс Th1- и Th2-клеток, и поддерживает уровень Treg, ингибирует выработку провоспалительных цитокинов (ИЛ-2, -6, -12, ИФН-γ), ДК и Т-клеточной анергии, оказывая супрессивное воздействие на адаптивную иммунную систему и формируя толерогенный фенотип [20–23]. Дифференцировка ДК в присутствии витамина D индуцирует повышение уровня супрессорных цитокинов (ИЛ-10, трансформирующего ростового фактора β), выделяемых Treg, что приводит к снижению продукции IgE, и усиливает синтез невоспалительных IgG4 и IgA. Таким образом, витамин D в некоторой степени модулирует и гуморальное звено иммунитета [6].
Большинство исследований выявляют недостаточные уровни 25(OH)D у детей с БА. Более низкие показатели регистрируются при плохом контроле над заболеванием [6], ассоциированы со снижением функции легких, учащением обострений и необходимостью использования препаратов по требованию [2]. Низкий статус витамина D связан с более высоким уровнем IgE при атопических состояниях [18]. В то же время более высокие исходные показатели кальцидиола у детей с БА сопряжены с меньшим количеством обострений, частотой обращений в отделения неотложной помощи или госпитализаций, а также снижают вероятность возникновения дисфункции крупных и мелких ДП, причем защитный эффект достаточного уровня витамина D со временем снижается [24]. Также дети с исходно низким показателем 25(OH)D оказываются более восприимчивыми к респираторным инфекциям, которые выступают триггерами обострения БА [16]. Имеются данные о влиянии индекса массы тела и уровня 25(OH)D на дыхательную функцию пациентов с БА. Среди детей с нормальной массой тела по мере улучшения обеспеченности витамином D наблюдалась тенденция к увеличению форсированной жизненной емкости легких (ФЖЕЛ) и объема форсированного выдоха за 1-ю секунду (ОФВ1), в то время как у детей с избыточной массой тела / ожирением различий не наблюдалось. Эти результаты свидетельствуют об изменении влияния витамина D на механику респираторной системы у детей с легким фенотипом БА в зависимости от индекса массы тела [22].
Низкий статус обеспеченности витамином D в течение первых нескольких лет жизни ассоциирован с повышенным риском развития БА, экземы, пищевой аллергии, хрипов, аллергического ринита и респираторных инфекций. Наоборот, нормальный и высокий уровень витамина D в пренатальном периоде и раннем детстве может защищать от респираторной инфекции и БА, по данным некоторых авторов, однако другие исследования не получили подобных результатов [25–27]. Детальный анализ после коррекции базовых доз витамина D (с учетом потребления с пищей) показал снижение риска развития БА у потомков женщин с БА (либо в случае, когда у другого биологического родителя диагностирована БА), получавших более высокие дозы витамина D с пищей [28]. Сообщается о роли приема высоких доз витамина D беременными в снижении риска развития аллергического ринита у их детей в возрасте до 3 лет, что может прервать будущий аллергический марш [29]. Последние метаанализы опровергают защитный эффект добавок холекальциферола (ХКФ) во время беременности: показано незначительное влияние дотации препаратов витамина D в первичной профилактике аллергических заболеваний [25, 26]. Такие результаты свидетельствуют о необходимости пересмотра доз ХКФ и рекомендаций по его приему на протяжении беременности, а при проведении исследований необходимо уделять больше внимания раннему началу дотации, учитывать постнатальный критический период от 6 нед. до 6 мес. и выявлять различные фенотипы БА у потомства [23, 26, 27].
Недавний метаанализ ассоциации между обеспеченностью витамином D и функцией легких среди детей с БА показал существование корреляции между 25(OH)D и ОФВ1, ФЖЕЛ и ОФВ1/ФЖЕЛ. Уровень кальцидиола сыворотки крови был положительно связан с лучшим контролем БА по данным теста по контролю над БА (ACT – Asthma Control Test) в большинстве исследований, а ассоциация с функцией легких выявлялась в половине исследований. Кроме того, обнаружено, что дефицит отрицательно коррелирует с обострениями и дозой ингаляционных ГКС, а также чаще выявляется при тяжелой БА [30]. Имеются убедительные доказательства того, что витамин D может снизить риск заболеваемости, тяжести и смертности от гриппа, COVID-19 и РС-вирусной инфекции, однако данный эффект реализуется при уровне 25(OH)D сыворотки крови в диапазоне 30–60 нг/мл [31]. У детей с БА на фоне 3-месячного курса терапии ХКФ отмечена тенденция к нарастанию уровней ИФН-γ, в особенности у пациентов с тяжелым течением БА [32]. В некоторых работах отражена эффективность перорального приема ХКФ в комплексной терапии БА, что выражалось в улучшении контроля, снижении частоты и тяжести обострений [6], хотя не ясно, существует ли причинно-следственная связь между этими наблюдениями [2]. Наибольший эффект дотации на частоту обострений и функцию легких выявлен у детей с исходно низким уровнем кальцидиола, однако при использовании ГКС улучшения функции легких не выявлялось [23]. Последний Кокрейновский обзор не выявил доказательств положительного влияния добавок ХКФ на снижение риска обострений или улучшение контроля БА. В то же время пациенты с тяжелой БА и начальной концентрацией 25(OH)D менее 10 нг/мл были представлены в малом количестве, ввиду чего защитный эффект дотации витамина D не может быть исключен у этих пациентов [33]. Другой метаанализ показал связь между приемом препаратов ХКФ у людей с БА и повышением уровня ИЛ-10 сыворотки крови без существенного влияния на биомаркеры T2-воспаления [21].
Витамин D ингибирует транслокацию P65 – ключевого фактора транскрипции, участвующего в клеточной дифференцировке Th-клеток в Th17, тем самым он способен смещать процесс дифференцировки Th17-клеток в сторону Treg, снижая продукцию ИЛ-17 и увеличивая выработку ИЛ-10 [23]. Исследование группы детей с БА и рахитом показало, что у детей с рахитом уровни ИЛ-1, -6, -17 и IgE сыворотки были достоверно выше, чем у детей с БА без рахита. Также эти показатели положительно коррелировали с длительностью хрипов, а уровень 25(OH)D сыворотки крови коррелировал отрицательно (23,3 ± 6,4 сут в основной группе и 14,9 ± 5,5 сут – в контрольной) [34]. В другом исследовании пациенты с персистирующей БА получали дотацию ХКФ в течение 3 мес., по истечении которых отмечалось значительное улучшение параметров легочной функции, снижение ИЛ-17А и увеличение ИЛ-10 в сыворотке по сравнению с исходными данными, причем уровень улучшения ОФВ1 был связан с более высоким исходным соотношением ИЛ-17А/ИЛ-10 [35].
Очевидно, что существует влияние активных метаболитов витамина D на механизмы воспаления ДП, а иммунологические эффекты ХКФ могут оказывать влияние на течение БА, что явилось предпосылкой для выполнения нашего исследования.
Цель работы – проанализировать динамику показателей ИФН-γ, ИЛ-17А и ИЛ-33 у детей с БА в зависимости от уровня 25(ОН)D в сыворотке крови до и на фоне дотации препаратами ХКФ.
Материалы и методы
В исследование был включен 71 ребенок, проживающий в Ставропольском крае. Работа проводилась в течение 2018–2021 гг. Забор крови проводился дважды – накануне и по итогам 3-месячного приема водного раствора ХКФ. В анализируемую группу был включен 51 пациент с БА: 35 (68,6%) мальчиков и 16 (31,4%) девочек в возрасте от 3 до 18 лет, медиана возраста детей с БА – 12,76 [9,46; 14,62] года. В зависимости от механизма развития заболевания у 45 (88,2%) детей диагностирована атопическая БА, у 6 (11,8%) – неатопическая, по степени тяжести у 25 (49,0%) легкое течение БА, у 11 (21,6%) – среднетяжелое и у 15 (29,4%) – тяжелое. По степени контроля над симптомами у 23 (45,1%) детей БА была контролируемой, у 6 (11,8%) – частично контролируемой и у 22 (43,1%) – неконтролируемой. Контрольная группа представлена 20 здоровыми детьми, не имеющими хронических заболеваний, в возрасте от 6 мес. до 18 лет, из которых 9 (45,0%) мальчиков и 11 (55,0%) девочек, медиана возраста – 7,66 [2,98; 12,09] года.
У детей анализируемых групп определяли уровни 25(ОН)D и ИНФ-γ, ИЛ-17А, ИЛ-33 иммуноферментным методом. При определении концентрации провоспалительных цитокинов учитывался инфекционный статус обследуемых детей. Забор крови производился при условии отсутствия обострения заболевания и (или) острого инфекционного заболевания. При наличии в анамнезе указания на недавно перенесенное острое заболевание / обострение к исследованию допускались дети в период реконвалесценции с нормотермией на протяжении не менее 7 суток. Всем детям после первоначального определения 25(ОН)D назначалась профилактическая доза ХКФ 1000–1500 МЕ/сут в соответствии с рекомендациями национальной программы «Недостаточность витамина D у детей и подростков Российской Федерации: современные подходы к коррекции» [36]. Длительность дотации препаратами ХКФ составляла 3 мес.
Интерпретация результатов осуществлялась в соответствии с рекомендациями национальной программы: тяжелый дефицит – уровень 25(ОН)D менее 10 нг/мл; дефицит – 10–20 нг/мл; недостаточность – 20–30 нг/мл; нормальное содержание – 30–100 нг/мл, уровень более 100 нг/мл расценивали как избыточный [36].
Статистическую обработку данных проводили с использованием пакета программ AtteStat, Statistica 10.0 (StatSoft Inc., США). Средние арифметические величины (M) и ошибки средней арифметической величины (m) определялись для параметрических количественных значений. Для непараметрических количественных значений определялись медиана, квартили Q1 и Q3. Для выявления различий между двумя сравниваемыми группами в случае анализа параметрических количественных данных использовали t-критерий Стьюдента, в случае анализа непараметрических количественных данных – U-критерий Манна – Уитни. Для оценки связей между количественными данными был использован критерий Пирсона (χ2) с поправками для малых выборок. В случае если хотя бы один показатель был меньше 4, вводилась поправка Йейтса, а в случае, когда один из показателей был менее 4, при этом общее число показателей было 30, использовали критерий Фишера. С целью определения корреляционной зависимости между показателями использовали коэффициенты парной корреляции Пирсона (r) и ранговой корреляции Кендалла. Статистически достоверными различия считались при р ≤ 0,05.
Результаты
Медиана 25(ОН)D у исследуемых детей с БА составила 17,9 [12,5; 20,6] нг/мл до начала приема препаратов ХКФ и 32,9 [27,1; 41,1] нг/мл на фоне дотации (p = 0,0001), у детей из группы контроля показатель был значимо выше – 28,5 [19,5; 35,9] нг/мл без дотации и 43,9 [32,7; 51,5] нг/мл – на фоне приема витамина D (p < 0,05). До начала дотации недостаточный уровень витамина D был диагностирован у 80,4% детей с БА (дефицит витамина D – 13,7%) и у 55,2% здоровых детей (p = 0,03). После дотации доля исследуемых с недостаточностью витамина D значимо снизилась среди как пациентов с БА (p = 0,0005), так и здоровых детей (p = 0,001) и составила 28,0 и 10,3% соответственно. У пациентов с БА на фоне дотации ХКФ и в группе контроля как до, так и на фоне дотации ХКФ дефицит витамина D не был выявлен.
При сравнении медиан ИФН-γ у детей с БА до и на фоне дотации ХКФ значимых различий не выявлено (табл. 1). У здоровых детей медианы ИФН-γ значимо снизились после дотации препаратами витамина D с 3,07 [2,29; 4,81] пг/мл до 2,18 [1,74; 3,45] пг/мл соответственно. Сходная закономерность была продемонстрирована в работе W. Maboshe et al., описавших снижение уровня ИФН-γ у здоровых лиц на фоне приема витамина D [37]. Анализ данных показал существование отрицательной корреляции средней силы между сывороточным кальцидиолом и ИФН-γ у детей с БА до начала дотации ХКФ (r = –0,47, p = 0,017). На фоне приема витамина D корреляционная связь уже не определялась (r = –0,08, p = 0,72), что, вероятно, обусловлено влиянием витамина D на продукцию ИФН-γ по принципу отрицательной обратной связи, когда в условиях достижения оптимальных уровней 25(ОН)D модуляция им выработки ИФН-γ останавливается либо регулируется иными факторами. У здоровых детей корреляционной связи между уровнями сывороточного 25(OH)D и ИФН-γ без дотации ХКФ (r = 0,047, p = 0,84) и с ней (r = –0,013, p = 0,96) не выявлено (табл. 1).
Таблица 1. Показатели провоспалительных цитокинов у детей исследуемых групп
| Показатель | Определение | Р1 | ||
| первичное (до дотации препаратами ХКФ) | вторичное (после дотации препаратами ХКФ) | |||
| ИЛ-17А | БА | 2,03 [0,1; 10,01] | 0,96 [0,1; 12,87] | 0,03 |
| Контроль | 0,14 [0,10; 0,19] | 0,11 [0,02; 0,22] | >0,05 | |
| Р2 | 0,03 | 0,04 | – | |
| ИЛ-33 | БА | 2,48 [1,87; 2,69] | 2,43 [1,89; 2,69] | >0,05 |
| Контроль | 0,96 [0,48; 1,43] | 0,78 [0,61; 1,31] | >0,05 | |
| P2 | 0,000006 | 0,00002 | – | |
| ИФН-γ | БА | 2,89 [1,78; 3,99] | 3,11 [0,89; 5,0] | >0,05 |
| Контроль | 3,07 [2,29; 4,81] | 2,18 [1,74; 3,45] | 0,03 | |
| P2 | >0,05 | 0,04 | – | |
Примечание. ХКФ – холекальциферол; БА – бронхиальная астма; ИЛ – интерлейкин; ИФН – интерферон; Р1 – статистическая значимость различий уровня провоспалительных цитокинов между группами до и после дотации препаратами ХКФ; Р2 – статистическая значимость различий уровня провоспалительных цитокинов между пациентами с БА и группой контроля.
Следует отметить, что до дотации ХКФ значимых различий в уровне ИФН-γ при сравнении детей с БА и детей контрольной группы выявлено не было, однако медиана ИФН-γ на фоне дотации у детей с БА статистически значимо выросла по сравнению со здоровыми (p = 0,04), что может свидетельствовать о возможности частичной модуляции ИФН-ответа у пациентов с БА посредством витамина D. При оценке медиан ИФН-γ у детей исследуемых групп с разными уровнями 25(OH)D у детей контрольной группы значимые различия не выявлены, определялась тенденция к увеличению сывороточных концентраций ИФН-γ на фоне более высоких уровней сывороточного кальцидиола. Пациенты с БА в условиях недостаточности витамина D демонстрировали значимо более низкие медианы ИФН-γ по сравнении с пациентами, имеющими дефицит витамина D (p < 0,05), однако при нормальной обеспеченности витамином D данная закономерность была нивелирована (табл. 2).
Таблица 2. Медианы интерферона-γ у детей исследуемых групп в зависимости от обеспеченности витамином D, Ме [Q1; Q3], пг/мл
| Группа | Витамин D, нг/мл | Р1 | |||
| 0–10 | 11–20 | 21–30 | 30–100 | ||
| Бронхиальная астма | 4,22 [2,00; 4,22] (n = 7) | 3,78 [2,00; 5,33] (n = 23) | 2,00 [1,11; 2,44] (n = 11) | 4,89 [0,89; 7,33] (n = 10) | 0,04 (при сравнении дефицита и недостаточности) |
| Контроль | – | 2,35 [1,65; 2,42] (n = 5) | 2,98 [2,44; 2,98] (n = 6) | 3,15 [2,11; 3,65] (n = 9) | >0,05 |
| Р2 | – | >0,05 | >0,05 | >0,05 | – |
Примечание. Р1 – статистическая значимость различий уровня интерферона-γ между группами с различной обеспеченностью витамином D; Р2 – статистическая значимость различий уровня интерферона-γ между пациентами с БА и группой контроля.
При оценке возрастных особенностей уровней ИФН-γ обнаружено, что у детей в возрасте от 4 до 7 лет при БА (n = 6) и в контрольной группе (n = 6) на фоне дотации ХКФ медианы ИФН-γ значимо снижались и составляли 6,11 [4,22; 7,33] пг/мл исходно и 2,78 [1,56; 3,45] пг/мл – на фоне дотации при БА (p = 0,03); 3,98 [2,98; 4,87] пг/мл исходно и 2,09 [1,45; 3,75] пг/мл – на фоне дотации у здоровых (p < 0,04). Анализ других возрастных групп не показал значимых различий (рис. 1).
Рисунок 1. Медианы интерферона-γ у детей исследуемых групп разных возрастов
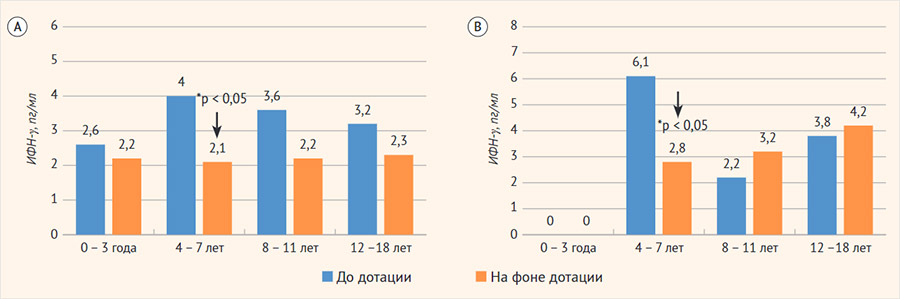
А – группа контроля; В – группа детей с бронхиальной астмой.
У пациентов с БА в зависимости от степени тяжести заболевания до и после дотации ХКФ медианы ИФН-γ значимо не различались и составили при легком течении БА 4,22 [2,02; 5,01] пг/мл до дотации и 2,44 [0,78; 3,33] пг/мл после дотации, при среднетяжелом течении БА 3,78 [1,78; 4,22] пг/мл и 3,11 [1,34; 4,22] пг/мл до и после дотации соответственно. При тяжелом течении БА отмечалась тенденция к повышению уровня ИФН-γ после дотации препаратами витамина D: медианы цитокина составили 2,01 [1,11; 3,11] пг/мл до дотации (n = 15) и 4,44 [3,11; 4,44] пг/мл после дотации (n = 7) (р > 0,05). Уровни 25(OH)D у детей с легким, среднетяжелым и тяжелым течением БА были сопоставимы (p > 0,05). У детей с БА в зависимости от уровня контроля заболевания до и после дотации препаратами витамина D не выявлено значимых различий в уровне ИФН-γ. У пациентов с контролируемой БА медианы ИФН-γ составили 4,45 [1,89; 5,55] пг/мл и 2,44 [0,89; 3,11] пг/мл до и после дотации ХКФ соответственно, при частично контролируемой БА – 2,89 [1,89; 4,11] пг/мл и 5,78 [2,23; 15,19] пг/мл до и после дотации соответственно, при неконтролируемой БА медианы цитокина составили 3,11 [1,11; 4,22] пг/мл (n = 23) и 3,67 [0,89; 10,01] пг/мл до и после приема препаратов витамина D (рис. 2). Уровни 25(OH)D у детей с контролируемой, частично контролируемой и неконтролируемой БА были сопоставимы (p > 0,05).
Рисунок 2. Медианы интерферона-γ у детей с бронхиальной астмой
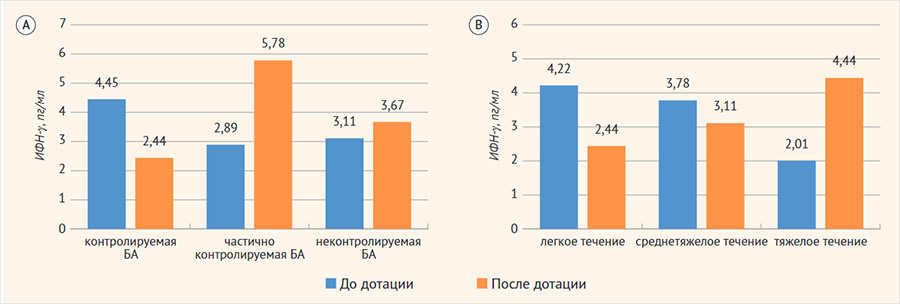
БА – бронхиальная астма. А – в зависимости от уровня контроля бронхиальной астмы; В – в зависимости от степени тяжести заболевания.
При анализе ИЛ-17А у детей с БА до дотации ХКФ медиана цитокина была значимо выше, чем после дотации (табл. 1). Медианы ИЛ-17А у детей с БА были значимо выше, чем у здоровых детей как до, так и на фоне дотации ХКФ. У здоровых детей значимых различий между медианами ИЛ-17А до и после назначения добавок витамина D выявлено не было. Корреляции между уровнями ИЛ-17А и 25(OH)D у детей с БА до (r = –0,129, p = 0,54) и на фоне приема ХКФ не выявлено (r = –0,101, p = 0,63), у здоровых детей до дотации препаратами витамина D корреляции не обнаружено (r = 0,174, p = 0,46), но на фоне дотации была выявлена отрицательная корреляционная связь средней силы (r = –0,51, p = 0,02). При оценке медиан ИЛ-17А у детей исследуемых групп с разными уровнями 25(OH)D было выявлено, что у здоровых детей значимых различий не было. У пациентов с БА медианы ИЛ-17А были значимо ниже при наличии недостаточности и нормальной обеспеченности витамином D по сравнению с пациентами, имеющими дефицит витамина D. У детей с БА и дефицитом витамина D медианы ИЛ-17А были значимо выше, чем у детей контрольной группы (табл. 3).
Таблица 3. Медианы интерлейкина-17А у детей исследуемых групп в зависимости от обеспеченности витамином D, Ме [Q1; Q3], пг/мл
|
Группа |
Витамин D, нг/мл | P1 | |||
| 0–10 | 11–20 | 21–30 | 30–100 | ||
|
Бронхиальная астма |
0,08 [0,01; 5,58] | 6,16 [0,01; 12,04] | 0,01 [0,01; 0,27] | 1,91 [0,01; 16,40] | 0,02 (при сравнении дефицита и недостаточности) 0,05 (при сравнении дефицита и нормальной обеспеченности) |
|
Контроль |
– | 0,11 [0,02; 0,15] | 0,14 [0,12; 0,17] | 0,17 [0,10; 0,21] | >0,05 |
|
P2 |
– | 0,04 | >0,05 | >0,05 | – |
Примечание. Р1 – статистическая значимость различий уровня интерлейкина-17А между группами с различной обеспеченностью витамином D; Р2 – статистическая значимость различий уровня интерлейкина-17А между пациентами с БА и группой контроля.
При оценке уровней ИЛ-17А у детей исследуемых групп разных возрастов выявлено, что у пациентов с БА до и после дотации ХКФ, а также при сравнении со здоровыми детьми значимых различий не определяется, выявлена тенденция к снижению медиан ИЛ-17А после дотации ХКФ. Корреляции между возрастом пациентов с БА и детей из группы контроля и уровнем ИЛ-17А не выявлено. Выявлена слабая корреляция между уровнем ИФН-γ и ИЛ-17А у пациентов с БА до дотации ХКФ (r = 0,29, p = 0,036). На фоне приема витамина D между уровнем ИФН-γ и ИЛ-17А выявлена сильная корреляция у здоровых детей (r = 0,84, p = 0,0001), в то время как у пациентов с БА корреляция статистически не значима (r = 0,28, p = 0,18). Вероятно, существование данной взаимосвязи обусловлено способностью Th17-клеток продуцировать некоторое количество ИФН-γ [38, 39]. У пациентов с БА в зависимости от степени тяжести заболевания до и после дотации ХКФ медианы ИЛ-17А значимо не различались и составили при легком течении БА0,12 [0,01; 4,01] пг/мл до приема и 0,10 [0,01; 1,73] пг/мл после дотации (p > 0,05), при среднетяжелом течении БА 6,25 [0,01; 11,4] пг/мл и 0,10 [0,01; 1,81] пг/мл до и после дотации соответственно (р = 0,09), при тяжелом течении БА медианы ИЛ-17А составили 0,15 [0,01; 0,72] пг/мл до дотации и 0,10 [0,01; 0,44] пг/мл после дотации (p > 0,05). У детей с БА в зависимости от уровня контроля заболевания до и после приема профилактической дозы препарата витамина D не выявлено значимых различий уровней ИЛ-17А. У пациентов с контролируемой БА медианы ИЛ-17А составили 0,07 [0,01; 6,05] пг/мл и 0,10 [0,01; 1,81] пг/мл до и после дотации ХКФ соответственно, при частично контролируемой БА – 4,05 [0,01; 8,84] пг/мл и 0,37 [0,01; 3,45] пг/мл до и после дотации соответственно, при неконтролируемой БА медианы цитокина составили 0,27 [0,01; 12,80] пг/мл и 0,10 [0,01; 6,21] пг/мл (рис. 3). Уровни 25(OH)D у детей с контролируемой, частично контролируемой и неконтролируемой БА были сопоставимы.
Рисунок 3. Медианы интерлейкина-17А у детей с бронхиальной астмой

БА – бронхиальная астма. А А – в зависимости от уровня контроля бронхиальной астмы; В – в зависимости от степени тяжести заболевания.
При анализе ИЛ-33 как до, так и после дотации ХКФ медиана цитокина была значимо выше у пациентов с БА, чем у здоровых детей (табл. 1). Медианы ИЛ-33 у детей с БА были выше в 2,5–4 раза в сравнении с детьми контрольной группы как до, так и после дотации ХКФ. Значимой разницы между медианами данного цитокина до и после приема витамина D в исследуемых группах не выявлено. При оценке медиан ИЛ-33 у детей исследуемых групп с разными уровнями 25(OH)D внутри групп при БА и у здоровых детей значимых различий не выявлено. У детей с БА вне зависимости от уровня витамина D медианы ИЛ-33 были значимо выше, чем у здоровых детей (табл. 4).
Таблица 4. Медианы интерлейкина-33 у детей исследуемых групп в зависимости от обеспеченности витамином D, Ме [Q1; Q3], пг/мл
| Группа | Витамин D, нг/мл | Р1 | |||
| 0–10 | 11–20 | 21–30 | 30–100 | ||
| Бронхиальная астма | 1,74 [1,07; 1,74] | 2,54 [1,92; 2,70] | 2,62 [2,37; 2,69] | 2,43 [1,99; 2,54] | >0,05 |
| Контроль | – | 0,69 [0,61; 1,13] | 0,35 [0,18; 0,35] | 1,13 [0,695; 1,13] | >0,05 |
| Р2 | – | 0,002 | 0,002 | 0,007 | – |
Примечание. Р1 – статистическая значимость различий уровня интерлейкина-33 между группами с различной обеспеченностью витамином D; Р2 – статистическая значимость различий уровня интерлейкина-33 между пациентами с БА и группой контроля.
По данным нашего исследования, у детей с БА в любом возрасте медиана ИЛ-33 выше, чем у здоровых детей, как до, так и после дотации ХКФ. При сравнении медиан ИЛ-33 внутри анализируемых групп детей разных возрастов значимых различий не выявлено. Корреляции между возрастом пациентов с БА и детей из контрольной группы и уровнем ИЛ-33 не выявлено. У пациентов с БА в зависимости от степени тяжести заболевания до и после дотации ХКФ медианы ИЛ-33 значимо не различались и составили при легком течении БА 2,54 [2,20; 2,63] пг/мл до дотации и 2,48 [2,09; 2,68] пг/мл после дотации (p > 0,05), при среднетяжелом течении БА 2,48 [1,86; 2,61] пг/мл и 2,69 [1,73; 2,70] пг/мл до и после дотации соответственно (p > 0,05), при тяжелом течении БА медианы ИЛ-33 составили 2,37 [1,38; 2,72] пг/мл до дотации и 1,98 [1,89; 2,31] пг/мл после дотации (p > 0,05). У детей с БА в зависимости от уровня контроля заболевания до и после дотации препаратами витамина D не выявлено значимых различий уровней ИЛ-33. У пациентов с контролируемой БА медианы ИЛ-33 составили 2,56 [2,43; 2,92] пг/мл и 2,70 [2,19; 2,71] пг/мл до и после дотации ХКФ соответственно (p > 0,05), при частично контролируемой БА – 1,93 [1,71; 2,28] пг/мл и 2,21 [1,86; 2,48] пг/мл до и после дотации соответственно (p > 0,05), при неконтролируемой БА медианы цитокина составили 2,48 [1,43; 2,72] пг/мл и 2,09 [1,89; 2,62] пг/мл (p > 0,05).
Обсуждение
Таким образом, по результатам нашего исследования, у пациентов с БА продемонстрировано наличие модулирующего эффекта в отношении ИФН-γ и ИЛ-17А у витамина D, при том что уровень ИЛ-33 у детей с БА от приема витамина D значимо не изменялся. Показано существование отрицательной корреляции средней силы между 25(OH)D и ИФН-γ у детей с БА до назначения ХКФ, которая на фоне приема витамина D уже не прослеживалась, что, по всей видимости, обусловлено модулированием витамином D продукции ИФН-γ по принципу отрицательной обратной связи, когда в условиях достижения оптимальных уровней витамина D модуляция им выработки ИФН-γ останавливается либо регулируется иными факторами.
Следует отметить, что до дотации ХКФ значимых различий в уровне ИФН-γ при сравнении детей с БА и из группы контроля выявлено не было, однако после дотации уровень ИФН-γ у пациентов с БА стал значимо более высоким, чем у здоровых детей, что соотносится с результатами ряда исследований, свидетельствующих о наличии сниженного ответа ИФН-γ у пациентов с атопическими заболеваниями. Согласно исследованию D. Stern et al., низкая продукция ИФН-γ в 9 мес. являлась фактором риска аллергической сенсибилизации и хрипов в возрасте 2, 11 и 13 лет [40]. В работе M. Tian et al. показано значительное снижение уровней ИФН-γ в периферической крови детей с обострением БА по сравнению с детьми без нее, что подчеркивает важность изучения динамики данного цитокина при БА и поиск регуляторных путей его продукции [41].
При анализе ИЛ-17А у детей с БА до дотации ХКФ медиана цитокина была значимо выше, чем после дотации, что было показано в ряде исследований [42, 43]. Это объясняется тем, что витамин D ингибирует транслокацию P65 – ключевого фактора транскрипции, участвующего в клеточной дифференцировке Th-клеток в Th17, тем самым способствуя смещению процесса дифференцировки Th17-клеток в сторону Treg и снижению продукцию ИЛ-17 [23]. Медианы ИЛ-17А в нашем исследовании были ожидаемо значимо выше у детей с БА по сравнению со здоровыми как до, так и на фоне дотации ХКФ.
Выявлена слабая корреляция между уровнем ИФН-γ и ИЛ-17А у пациентов с БА до дотации ХКФ, но не у детей контрольной группы. После дотации препаратами витамина D между уровнем ИФН-γ и ИЛ-17А выявлена сильная корреляция у здоровых детей, в то время как у пациентов с БА корреляции обнаружено не было. Существование данной корреляции, вероятно, связано со способностью Th17-клеток продуцировать некоторое количество ИФН-γ [38, 39].
Заключение
По результатам исследования у ХКФ был выявлен модулирующий эффект в отношении ИФН-γ и ИЛ-17А у пациентов с БА: показано улучшение ответа ИФН-γ, а также значимое снижение медианы ИЛ-17А на фоне дотации препаратами витамина D. Выявленная связь средней силы между показателями 25(OH)D и ИФН-γ у детей с БА до назначения ХКФ нивелирована на фоне приема ХКФ, что свидетельствует о наличии модулирующего эффекта у витамина D в отношении продукции ИФН-γ. Выявлена корреляционная связь между уровнем ИФН-γ и ИЛ-17А как у пациентов с БА, так и у здоровых детей. Показатели ИЛ-33 у детей с БА как до, так и после дотации ХКФ превосходят таковые у здоровых детей в 2,5–4 раза, при этом уровни на фоне приема препаратов витамина D значимо не изменялись. Полученные результаты подчеркивают сложность и многонаправленность иммунных механизмов регуляции аллергического воспаления при БА и демонстрируют важность контроля и своевременной коррекции гиповитаминоза D у пациентов данной группы.
Список литературы / References
Развернуть
- Бяловский ЮЮ, Глотов СИ, Ракитина ИС, Ермачкова АН. Патогенетические аспекты фенотипирования бронхиальной астмы. Российский медико-биологический вестник имени академика И.П. Павлова. 2024;32(1):145-158. https://doi.org/10.17816/PAVLOVJ181606.
- Лошкова ЕВ, Кондратьева ЕИ, Малиновская МГ, Янкина ГН. Современное представление о витамине D и генетической регуляции воспаления на примере бронхиальной астмы. Вопросы практической педиатрии. 2022;17(3):147-155. https://doi.org/10.20953/1817-7646-2022-3-147-155.
- Ненашева НМ. Т2-бронхиальная астма: характеристика эндотипа и биомаркеры. Пульмонология. 2019;29(2):216-228. https://doi.org/10.18093/0869-0189-2019-29-2-216-228.
- Hammad H, Lambrecht BN. The basic immunology of asthma. Cell. 2021;184(6):1469-1485. https://doi.org/10.1016/j.cell.2021.02.016.
- Van der Ploeg EK, Krabbendam L, Vroman H, van Nimwegen M, de Bruijn MJW, de Boer GM et al. Type-2 CD8+ T-cell formation relies on interleukin-33 and is linked to asthma exacerbations. Nat Commun. 2023;14(1):5137. https://doi.org/10.1038/s41467-023-40820-x.
- Ильенкова НА, Степанова ЛВ, Коноплева ОС, Федоров МВ. Роль витамина D в формировании бронхиальной астмы у детей и ее течении. Педиатрия. Журнал имени Г.Н. Сперанского. 2020;99(2):249-255. https://doi.org/10.24110/0031-403X-2020-99-2-249-255.
- Schröder A, Lunding LP, Zissler UM, Vock C, Webering S, Ehlers JC et al. IL-37 regulates allergic inflammation by counterbalancing pro-inflammatory IL-1 and IL-33. Allergy. 2022;77(3):856-869. https://doi.org/10.1111/all.15072.
- Van der Ploeg EK, Golebski K, van Nimwegen M, Fergusson JR, Heesters BA, Martinez-Gonzalez I et al. Steroid-resistant human inflammatory ILC2s are marked by CD45RO and elevated in type 2 respiratory diseases. Sci Immunol. 2021;6(55):eabd3489. https://doi.org/10.1126/sciimmunol.abd3489.
- Ketelaar ME, Portelli MA, Dijk FN, Shrine N, Faiz A, Vermeulen CJ et al. Phenotypic and functional translation of IL33 genetics in asthma. J Allergy Clin Immunol. 2021;147(1):144-157. https://doi.org/10.1016/j.jaci.2020.04.051.
- Zhao R, Shi Y, Liu N, Li B. Elevated levels of interleukin-33 are associated with asthma: A meta-analysis. Immun Inflamm Dis. 2023;11(4):e842. https://doi.org/10.1002/iid3.842.
- Yang Q, Zheng Y, Dong J, Xu Q, Li S, Li A et al. Serum interleukin-33 combined with FEF75% z-score and FeNO improves the diagnostic accuracy of asthma in children. J Pediatr (Rio J). 2024;100(1):81-87. https://doi.org/10.1016/j.jped.2023.08.004.
- Ritzmann F, Lunding LP, Bals R, Wegmann M, Beisswenger C. IL-17 cytokines and chronic lung diseases. Cells. 2022;11(14):2132. https://doi.org/10.3390/cells11142132.
- Liu Z, Niu C, Ying L, Zhang Q, Long M, Fu Z. Exploration of the serum interleukin-17 and interleukin-27 expression levels in children with bronchial asthma and their correlation with indicators of lung function. Genet Test Mol Biomarkers. 2020;24(1):10-16. https://doi.org/10.1089/gtmb.2019.0155.
- Song J, Zhang H, Tong Y, Wang Y, Xiang Q, Dai H et al. Molecular mechanism of interleukin-17A regulating airway epithelial cell ferroptosis based on allergic asthma airway inflammation. Redox Biol. 2023;68:102970. https://doi.org/10.1016/j.redox.2023.102970.
- Bosco A. Emerging role for interferons in respiratory viral infections and childhood asthma. Front Immunol. 2023;14:1109001. https://doi.org/10.3389/fimmu.2023.1109001.
- Raju A, Luthra G, Shahbaz M, Almatooq H, Foucambert P, Esbrand FD et al. Role of vitamin D deficiency in increased susceptibility to respiratory infections among children: a systematic review. Cureus. 2022;14(9):e29205. https://doi.org/10.7759/cureus.29205.
- Kilic A, Halu A, De Marzio M, Maiorino E, Duvall MG, Bruggemann TR et al. Vitamin D constrains inflammation by modulating the expression of key genes on Chr17q12-21.1. eLife. 2024;12:RP89270. https://doi.org/10.7554/eLife.89270.2.
- Bastyte D, Tamasauskiene L, Golubickaite I, Ugenskiene R, Sitkauskiene B. Vitamin D receptor and vitamin D binding protein gene polymorphisms in patients with asthma: a pilot study. BMC Pulm Med. 2023;23(1):245. https://doi.org/10.1186/s12890-023-02531-3.
- Bastyte D, Tamasauskiene L, Stakaitiene I, Ugenskiene R, Gradauskiene Sitkauskiene B. The association of vitamin D receptor gene polymorphisms with vitamin D, total IgE, and blood eosinophils in patients with atopy. Biomolecules. 2024;14(2):212. https://doi.org/10.3390/biom14020212.
- Goncalves-Mendes N, Talvas J, Dualé C, Guttmann A, Corbin V, Marceau G et al. Impact of vitamin D supplementation on influenza vaccine response and immune functions in deficient elderly persons: a randomized placebo-controlled trial. Front Immunol. 2019;10:65. https://doi.org/10.3389/fimmu.2019.00065.
- El Abd A, Dasari H, Dodin P, Trottier H, Ducharme FM. The effects of vitamin D supplementation on inflammatory biomarkers in patients with asthma: a systematic review and meta-analysis of randomized controlled trials. Front Immunol. 2024;15:1335968. https://doi.org/10.3389/fimmu.2024.1335968.
- Papamichael MM, Itsiopoulos C, Katsardis C, Tsoukalas D, Erbas B. Does BMI modify the association between vitamin D and pulmonary function in children of the mild asthma phenotype? Int J Environ Res Public Health. 2022;19(24):16768. https://doi.org/10.3390/ijerph192416768.
- Gaudet M, Plesa M, Mogas A, Jalaleddine N, Hamid Q, Al Heialy S. Recent advances in vitamin D implications in chronic respiratory diseases. Respir Res. 2022;23(1):252. https://doi.org/10.1186/s12931-022-02147-x.
- Li Q, Zhou Q, Zhang G, Tian X, Chen Y, Cun Y et al. Long-term effects of vitamin D on exacerbation rate, health care utilization and lung function in children with asthma. Ann Transl Med. 2022;10(20):1094. https://doi.org/10.21037/atm-22-2750.
- Luo C, Sun Y, Zeng Z, Liu Y, Peng S. Vitamin D supplementation in pregnant women or infants for preventing allergic diseases: a systematic review and meta-analysis of randomized controlled trials. Chin Med J (Engl). 2022;135(3):276-284. https://doi.org/10.1097/CM9.0000000000001951.
- Tareke AA, Hadgu AA, Ayana AM, Zerfu TA. Prenatal vitamin D supplementation and child respiratory health: A systematic review and meta-analysis of randomized controlled trials. World Allergy Organ J. 2020;13(12):100486. https://doi.org/10.1016/j.waojou.2020.100486.
- Brustad N, Chawes B. Vitamin D primary prevention of respiratory infections and asthma in early childhood: evidence and mechanisms. J Allergy Clin Immunol Pract. 2024;12(7):1707-1714. https://doi.org/10.1016/j.jaip.2024.02.005.
- Sharma S, Garg M. Investigating the role of vitamin D in asthma. eLife. 2024;13:e97031. https://doi.org/10.7554/eLife.97031.
- Shimizu M, Kato T, Adachi Y, Wada T, Murakami S, Ito Y et al. Maternal dietary vitamin D intake during pregnancy is associated with allergic disease symptoms in children at 3 years old: the Japan environment and children’s study. Int Arch Allergy Immunol. 2023;184(11):1106-1115. https://doi.org/10.1159/000531970.
- Abi-Ayad M, Nedjar I, Chabni N. Association between 25-hydroxy vitamin D and lung function (FEV1, FVC, FEV1/FVC) in children and adults with asthma: A systematic review. Lung India. 2023;40(5):449-456. https://doi.org/10.4103/lungindia.lungindia_213_23.
- Grant WB. Vitamin D and viral infections: Infectious diseases, autoimmune diseases, and cancers. Adv Food Nutr Res. 2024;109:271-314. https://doi.org/10.1016/bs.afnr.2023.12.007.
- Долбня СВ, Дятлова АА, Климов ЛЯ, Кондратьева ЕИ, Захарова ИН, Енина ЕА. Взаимосвязь между обеспеченностью витамином D и уровнем интерферона-γ у детей с хроническими заболеваниями легких. Медицинский совет. 2023;17(12):231-239. https://doi.org/10.21518/ms2023-221.
- Williamson A, Martineau AR, Sheikh A, Jolliffe D, Griffiths CJ. Vitamin D for the management of asthma. Cochrane Database Syst Rev. 2023;(2):CD011511. https://doi.org/10.1002/14651858.CD011511.pub3.
- Aierken A, Yusufu B, Xu P. Correlation between asthmatic infants with rickets and vitamin D, inflammatory factors and immunoglobulin E. Exp Ther Med. 2020;20(3):2122-2126. https://doi.org/10.3892/etm.2020.8949.
- Shabana MA, Esawy MM, Ismail NA, Said AM. Predictive role of IL-17A/IL-10 ratio in persistent asthmatic patients on vitamin D supplement. Immunobiology. 2019;224(6):721-727. https://doi.org/10.1016/j.imbio.2019.09.005.
- Боровик ТЭ, Громова ОА, Захарова ИН, Мальцев СВ, Мошетова ЛК, Намазова-Баранова ЛС. и др. Недостаточность витамина D у детей и подростков Российской Федерации: современные подходы к коррекции: национальная программа. 2-е изд. М.: Педиатръ; 2021. 116 с.
- Maboshe W, Macdonald HM, Wassall H, Fraser WD, Tang J, Fielding S et al. Low-Dose Vitamin D3 Supplementation Does Not Affect Natural Regulatory T Cell Population but Attenuates Seasonal Changes in T Cell-P roduced IFN-γ: Results From the D-SIRe2 Randomized Controlled Trial. Front Immunol. 2021;12:623087. https://doi.org/10.3389/fimmu.2021.623087.
- Xing X, Li A, Tan H, Zhou Y. IFN-γ+ IL-17+ Th17 cells regulate fibrosis through secreting IL-21 in systemic scleroderma. J Cell Mol Med. 2020;24(23):13600-13608. https://doi.org/10.1111/jcmm.15266.
- Xie H, Zeng J, Yan X, Shen N, Zheng X, Luo H. Clinical Significance and Properties of IFN-γ+IL-17+ Th17 Cells in Liver Injury Associated with Chronic Hepatitis B Virus Infection. Digestion. 2022;103(6):438-450. https://doi.org/10.1159/000526924.
- Stern DA, Guerra S, Halonen M, Wright AL, Martinez FD. Low IFN-gamma production in the first year of life as a predictor of wheeze during childhood. J Allergy Clin Immunol. 2007;120(4):835-841. https://doi.org/10.1016/j.jaci.2007.05.050.
- Tian M, Zhou Y, Jia H, Zhu X, Cui Y. The Clinical Significance of Changes in the Expression Levels of MicroRNA-1 and Inflammatory Factors in the Peripheral Blood of Children with Acute-Stage Asthma. Biomed Res Int. 2018:7632487. https://doi.org/10.1155/2018/7632487.
- Nanzer AM, Chambers ES, Ryanna K, Richards DF, Black C, Timms PM et al. Enhanced production of IL-17A in patients with severe asthma is inhibited by 1α,25-dihydroxyvitamin D3 in a glucocorticoid-independent fashion. J Allergy Clin Immunol. 2013;132(2):297-304.e3. https://doi.org/10.1016/j.jaci.2013.03.037.
- Shabana MA, Esawy MM, Ismail NA, Said AM. Predictive role of IL-17A/IL-10 ratio in persistent asthmatic patients on vitamin D supplement. Immunobiology. 2019;224(6):721-727. https://doi.org/10.1016/j.imbio.2019.09.005.








