
Журнал "Медицинский совет" №1/2025
DOI: 10.21518/ms2025-075
И.Н. Захарова1, И.В. Бережная1, Н.Г. Сугян1,2, Я.В. Оробинская1,3, В.В. Пупыкина1, В.Д. Чурилова1,2
1 Российская медицинская академия непрерывного профессионального образования; 125993, Россия, Москва, ул. Баррикадная, д. 2/1, стр. 1
2 Химкинская больница; 141407, Россия, Московская обл., Химки, Куркинское шоссе, д. 11
3 Поликлиника «Мама и малыш», Химкинская больница; 141400, Россия, Московская обл., Химки, ул. Родионова, д. 1
Функциональные нарушения желудочно-кишечного тракта (ЖКТ) – распространенная проблема в педиатрической практике. Симптомы данного нарушения у младенцев составляют от 25 до 55%. Это существенно влияет на качество жизни детей и их семей. Функциональные нарушения ЖКТ характеризуются выраженными клиническими проявлениями, несмотря на отсутствие органической патологии ЖКТ и нарушений обмена веществ. В статье представлены основные виды функциональных нарушений, такие как младенческие колики, функциональные запоры и младенческая регургитация, а также их распространенность, патофизиологические механизмы и клиническая картина. Особое внимание уделяется диетическим рекомендациям, которые могут способствовать улучшению состояния детей. Широко применяются детские смеси на основе коровьего молока, тогда как смеси на основе козьего молока являются относительно новой альтернативой. Однако следует отметить, что белок козьего молока обладает рядом преимуществ для здоровья по сравнению с белком коровьего молока, особенно в плане пищеварения, т. к. усваивается быстрее и эффективнее, чем белок коровьего молока. На примере клинического случая ребенка К. в возрасте 2 мес. с жалобами со стороны мамы на сильный плач после еды, нерегулярный стул, срыгивания, короткие и беспокойные эпизоды сна представлены рекомендации по ведению пациентов с функциональными нарушениями ЖКТ на современных молочных смесях при отсутствии грудного вскармливания. По результатам оценочной шкалы CoMiSS (Cow’s Milk-related Symptom Score) определили, что детское питание на основе козьего молока может быть перспективной альтернативой детскому питанию на основе коровьего молока для этого младенца.
Для цитирования: Захарова ИН, Бережная ИВ, Сугян НГ, Оробинская ЯВ, Пупыкина ВВ, Чурилова ВД. Питание как способ коррекции функциональных нарушений желудочно-кишечного тракта у младенцев. Медицинский совет. 2025;19(1): https://doi.org/10.21518/ms2025-075.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Nutrition as a method for managing functional gastrointestinal disorders in infants
Irina N. Zakharova1, Irina V. Berezhnaya1, Narine G. Sugian1,2, Yana V. Orobinskaya1,3, Viktoria V. Pupykina1, Viktoriya D. Churilova1,2
1 Russian Medical Academy of Continuous Professional Education; 2/1, Bldg. 1, Barrikadnaya St., Moscow, 125993, Russia
2 Khimki Hospital; 11, Kurkinskoe Shosse, Khimki, Moscow Region, 141407, Russia
3 Mother and Baby Outpatient Clinic, Khimki Hospital; 1, Rodionov St., Khimki, Moscow Region, 141400, Russia
Functional gastrointestinal disorders (FGIDs) are a common problem in paediatric practice. Symptoms of this disorder in infants account for 25 to 55%. Presence of these symptoms in children has significant impact on their quality of life and also, affects the parents’ quality of life. Functional GI disorders are characterized by pronounced clinical manifestations, despite the absence of organic GI pathology and metabolic disorders. The article presents the major types of functional disorders such as infantile colic, functional constipation and infantile regurgitation, as well as their prevalence, pathophysiological mechanisms and clinical presentation. Particular attention is paid to dietary recommendations that can help improve the health condition of children. Cow’s milk-based infant formulas are popular, while goat’s milk-based formulas are a newish alternative nutrition. It should, however, be noted that goat milk protein has a range of health benefits compared to cow’s milk protein, especially in terms of digestion, as it is more efficiently digested than proteins from cow milk. Recommendations for the management of patients with functional GI disorders on modern milk formulas in the absence of breastfeeding are presented using the exam- ple of a clinical report of a 2-month-old baby (K.) with his mother’s complaints about loud crying after eating, irregular bowel movements, regurgitation, short and restless sleep episodes. The CoMiSS (Cow’s Milk-related Symptom Score) scale showed that goat’s milk-based infant formula may be a promising alternative to cow’s milk-based infant formula for this baby.
For citation: Zakharova IN, Berezhnaya IV, Sugian NG, Orobinskaya YV, Pupykina VV, Churilova VD. Nutrition as a method for managing functional gastrointestinal disorders in infants. Meditsinskiy sovet = Medical Council. 2025;(1):116-125. (In Russ.) https://doi.org/10.21518/ms2025-075
Conflict of interest: the authors declare no conflict of interest.
Введение
Знания о болезнях желудочно-кишечного тракта (ЖКТ) у детей имеют многовековую историю. Еще в IV в. до н. э. великий Гиппократ в своем труде «О природе ребенка» подробно описывал особенности физиологии детского организма и заболевания органов пищеварения. Медицинские тексты, найденные в разных странах древнего мира – от Египта до Китая, от Иудеи до Ассирии – содержат сведения о лечении детей, их питании и уходе за ними. Эти знания были запечатлены в различных источниках: папирусах египтян, глиняных табличках шумерской цивилизации, манускриптах древней Индии и Вавилона. Особое внимание детскому здоровью уделяли также древнегреческие врачи, оставившие множество записей о симптомах и лечении детских болезней [1].
В Древнем Риме учение о детях получило дальнейшее развитие. В частности, в работах Сорана Эфесского содержится несколько глав, посвященных заболеваниям детей. В трудах К. Галена (129–199), врача из Багдада Разива (I–II вв. нашей эры) и в «Каноне врачебной науки» Ибн Сины рассматриваются вопросы физиологии, гигиены, питания и болезней детей. На протяжении следующих пятнадцати столетий лечение детей основывалось на принципах, изложенных Сораном и Галеном. Зачастую детей лечили так же, как и взрослых, или вовсе не оказывали им медицинскую помощь [1].
Одним из характерных признаков заболевания органов пищеварения в древности была диарея. В эпоху Гиппократа преобладало мнение о тесной связи развития диареи у младенцев с метеорологическими условиями, периодами отлучения от грудного вскармливания и прорезыванием зубов. Так, летние случаи жидкого стула часто интерпретировались как «летняя диарея», вызываемая летней жарой, а зимние – как «зимняя диарея». Гиппократ одним из первых детально описал клиническую картину кала с примесью крови и слизи, предположительно наблюдаемого при дизентерии, связав вспышки заболевания с некачественной питьевой водой [2].
Вплоть до XVI в. активно велись исследования причин диареи, при этом существовало убеждение о прямой зависимости диареи от резких изменений в рационе питания. В XVII в. «летняя диарея» стала рассматриваться как следствие заражения пищи мухами, а «зимняя диарея» – как результат сочетания холода, повышенной влажности и недостатка подходящей пищи и одежды [2].
Запоры также упоминаются в древних медицинских трактатах. Как правило, их связывали с нерациональным питанием и недостаточной физической активностью. Гален особое внимание уделял физиологическим аспектам данного расстройства. Он утверждал, что «запоры у детей могут быть вызваны неправильным рационом, следовательно, их можно предотвратить, контролируя ежедневное питание». Гален также описал лекарственное средство для лечения запоров. В его состав входили шафран, сумбул, мирра, белый и длинный перец, гальбан, бальзамное масло, китайская и цейлонская корица, кора корня мандрагоры, выжатый сок мандрагоры, семена дикой моркови и сагапен. Растительные компоненты измельчались в смеси с бальзамным маслом и соком мандрагоры, после чего добавлялся мед [3].
Разумное потребление пищи и ее целебные свойства также описывали еще с древних времен. Античные врачи были убеждены, что сбалансированный рацион является ключом к крепкому здоровью, жизненной энергии и хорошему самочувствию, и посвящали этой теме целые научные труды. Так, известный английский педиатр Уильям Кадоган (1711–1794) подчеркивал, что «правильное питание не менее важно, чем одежда ребенка… Необходимо следить за тем, чтобы ему предоставлялась исключительно полезная пища в количествах, необходимых для поддержания и роста организма…». Правильное питание ребенка играет важнейшую роль в развитии детского организма, воздействуя сразу на несколько систем. Во-первых, оно стимулирует различные органы чувств – от зрительных до вкусовых рецепторов. Во-вторых, пища существенно влияет на работу внутренних систем, включая иммунную защиту, гормональный фон и пищеварительный тракт. Еда служит источником необходимых организму веществ – от базовых нутриентов, таких как белки и углеводы, до важнейших витаминов и минералов, обеспечивающих полноценное развитие ребенка [4].
На сегодняшний день исключительно грудное вскармливание в течение первых 6 мес. жизни является оптимальным способом питания для младенцев. Несмотря на рекомендации Всемирной организации здравоохранения (ВОЗ), более половины младенцев во всем мире с рождения находятся на смешанном или искусственном вскармливании [5]. Детские смеси на основе коровьего молока широко применяются, тогда как смеси на основе козьего молока являются относительно новой альтернативой. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration (FDA)) признало козье молоко наиболее безопасным и подходящим источником белка для здорового роста и развития младенцев [6, 7]. Белок козьего молока обладает рядом преимуществ для здоровья по сравнению с белком коровьего молока, особенно в плане пищеварения, т. к. усваивается быстрее и эффективнее, чем белок коровьего молока [8, 9].
Функциональные расстройства желудочно-кишечного тракта у младенцев
В первый год жизни у младенцев часто возникают проблемы с ЖКТ, такие как запоры, диарея, срыгивание, газообразование и колики. Распространенность этих симптомов составляет от 25 до 55% [10–12].
Функциональные гастроинтестинальные расстройства (ФГИР) представляют собой группу состояний, характеризующихся нарушением функции органов пищеварения в связи с изменением их регуляции [13]. Клинические проявления ФГИР включают разнообразное сочетание желудочно-кишечных симптомов, возникающих при отсутствии структурных или биохимических нарушений [13]. Данное определение функциональных нарушений (ФН), сформулированное D.A. Drossman, – дискутабельный вопрос современной медицины. Принципиально важным является понимание взаимообусловленности структуры и функции, а также роли этих компонентов в формировании патологического состояния [14]. Выдающийся отечественный врач, академик В.Х. Василенко в середине ХХ в. высказывал однозначную позицию, которая заключалась в необоснованности разобщения структурных и функциональных нарушений. В.Х. Василенко заявлял: «Функция без структуры немыслима, структура без функции бессмысленна». Действительно, многочисленные исследования с применением современных методов диагностики подтверждают справедливость данного высказывания [15]. Таким образом, термин «функциональные нарушения» приобретает условный характер. Согласно Римским критериям IV, есть основания для использования понятия «расстройства церебро-интестинального взаимодействия» [16]. Однако данный термин также не раскрывает полноценно специфику этой группы нарушений.
Особую актуальность представляет изучение патогенетических механизмов, которые лежат в основе ФН ЖКТ. Рядом исследователей выдвигается гипотеза о ведущей роли взаимодействия компонентов двунаправленной оси «кишечник – мозг», функционирование которой осуществляется посредством нейротрансмиттеров, гормонов и иммунных медиаторов [17]. В мультидисциплинарном национальном консенсусе, посвященном синдрому повышенной эпителиальной проницаемости (СПЭП), признается значимый вклад нарушений моторики и гиперсенситивности в патогенез ФН ЖКТ. Раскрывая сущность проницаемости кишечного эпителиального барьера, авторы подчеркивают универсальность данного механизма. Также приводятся доказательства того, что следствием СПЭП является низкоуровневое воспаление кишечной стенки с увеличением количества тучных клеток и эозинофилов [18]. Значимая роль в патогенезе ФН ЖКТ отводится дисбиозу, поскольку для обеспечения барьерной функции кишечника критически важным является состояние кишечной микробиоты. К факторам, играющим роль в развитии ФГИР, также относят диетические особенности, генетическую предрасположенность, инфекции, стресс [19]. Таким образом, не вызывает сомнений полиэтиологичность и гетерогенность механизмов, лежащих в основе ФН ЖКТ.
Показатели распространенности данных нарушений имеют широкую вариативность. Данный факт обусловлен отсутствием маркеров, способствующих объективизации при установлении диагноза, поскольку нозологические формы имеют клинико-анамнестические дефиниции. Широкое применение Римских критериев IV (2016) позволяет преодолеть неоднородность диагностических критериев. В табл. 1 представлено соотношение европейских кодов ФН ЖКТ и Международной классификации болезней 10-го пересмотра (МКБ-10) [16].
Таблица 1. Функциональные нарушения желудочно-кишечного тракта: дети от 0 до 4-х лет. Соответствие европейских кодов функциональных нарушений желудочно-кишечного тракта и Международной классификации болезней 10-го пересмотра
| Римские критерии IV | МКБ-10 | ||
| G1 | Срыгивание | P92.1 | Срыгивания и руминация новорожденного |
| G2 | Синдром руминации | ||
| G3 | Синдром циклической рвоты | R11 | Циклическая (функциональная) рвота |
| G4 | Колики | R10.4 P92.0 | Кишечная колика Метеоризм |
| G5 | Функциональная диарея | K59.1 | Функциональная диарея |
| G6 | Болезненность и затруднения дефекации (дисхезия) | K59.4 | Спазм анального сфинктера |
| G7 | Функциональный запор | K59.0 | Запор |
Согласно данным систематического обзора, посвященного эпидемиологии ФН ЖКТ, совокупная распространенность данной патологии среди детей в возрасте до 4 лет составляет 22,2% [20]. При этом у детей до 1 года наиболее часто диагностируются младенческая регургитация, в более старшем возрасте (13–48 мес.) преобладающей нозологией является функциональный запор [12]. Схематическое изображение возраста манифестации ФН ЖКТ представлено на рис. 1. Согласно клиническим исследованиям, 55% младенцев демонстрируют по крайней мере один симптом ФГИР от рождения до 6 мес. [21]. Как правило, ФН ЖКТ имеют благоприятное течение и регрессируют по мере взросления ребенка. Однако в исследованиях показано, что явления ФГИР ухудшают качество жизни младенца и родителей и имеют отсроченное влияние на последующую жизнь.
Рисунок 1. Возраст проявления функциональных нарушений желудочно-кишечного тракта у детей
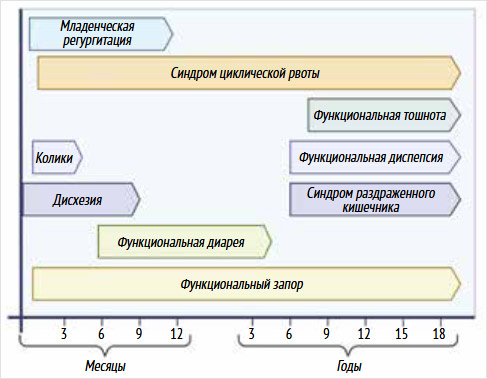
Условно графы соответствуют определенной нозологии [22]. Адаптировано и создано с помощью BioRender.
Младенческая регургитация (синдром младенческих срыгиваний) является наиболее распространенным ФГИР, возникающим в течение первого года жизни, и представляет собой пассивный ретроградный пассаж (заброс) содержимого желудка в глотку, ротовую полость [12, 23]. Данное состояние диагностируется у 67% младенцев, частота встречаемости достигает пика в возрасте 4 мес. [21]. Также установлено, что младенческие срыгивания самостоятельно регрессируют при достижении ребенком 10–12 мес., в этой возрастной группе лишь у 5% детей сохраняются симптомы. Существуют анатомо-физиологические особенности верхних отделов пищеварительного тракта, предрасполагающие к синдрому младенческих срыгиваний.
Для объективной диагностики регургитации у младенца в возрасте от 3 нед. до 12 мес. необходимо наличие двух следующих диагностических критериев [16]:
1) срыгивание 2 или более раз в день в течение 3 или более недель;
2) отсутствие рвоты, кровавой рвоты, аспирации, апноэ, задержки развития, трудностей с кормлением или глотанием или ненормальной позы.
В отличие от срыгивания рвота представляет собой сложный нервно-рефлекторный акт, сопровождающийся множеством физиологических реакций и участием вспомогательной мускулатуры. О физиологическом характере срыгиваний у младенцев можно судить, если регургитация происходит неизмененным молоком без патологических примесей, появляется не позже 1 ч после кормления ребенка и усиливается в горизонтальном положении и при беспокойстве, не приводит к нарушению физического развития, а также отсутствуют вегетативные реакции, такие как гиперсаливация, бледность кожи [24]. Для объективной оценки симптомов срыгивания у младенцев используется шкала интенсивности срыгивания Европейского общества детской гастроэнтерологии, гепатологии и питания (ESPGHAN), которая учитывает частоту и объем срыгивания.
В ряде случаев требуется исключение патологического гастроэзофагеального рефлюкса (ГЭР), который ассоциирован с повреждением слизистой оболочки пищевода, ведет к развитию рефлюкс-эзофагита и связанных с ним осложнений. О патологическом ГЭР свидетельствует наличие «симптомов тревоги», включающих снижение массы тела, неукротимую рвоту фонтаном, рвоту с патологическими примесями, а также респираторные и неврологические нарушения. Выявление данных симптомов является показанием для тщательного обследования ребенка.
Младенческие колики характеризуются повторяющимися эпизодами безутешного плача, беспокойства или раздражительности, возникающими и завершающимися без очевидных причин. Не существует единой точки зрения на патогенез младенческих колик, однако не вызывает сомнений многофакторность причин данного состояния. Патофизиологическую роль в развитии колик у младенцев могут играть сложные взаимодействия между поведенческими факторами (психологическими и социальными), факторами питания (гиперчувствительность или пищевая аллергия), незрелостью ЖКТ, дисбалансом кишечной микробиоты, а также нарушения взаимодействий в функциональной оси «кишечник – мозг» [25].
Широкая вариабельность показателей распространенности младенческих колик объясняется применением разных диагностических критериев и отсутствием единой терминологии. По данным описательного обзора, распространенность колик среди младенцев в возрасте 0–5 мес., оцененная с использованием Римских критериев IV, составила 14,9% [26]. В возрастной группе 0–12 мес. показатель частоты младенческих колик варьировал от 1,9% до 19,2%. Необходимо учитывать, что диагностика младенческих колик связана с родительским восприятием интенсивности и продолжительности эпизодов плача, а также социальными факторами. Необъяснимая природа плача является причиной родительского стресса [27]. Как правило, клинические симптомы младенческих колик максимально выражены в 4–6 нед., затем их интенсивность уменьшается к 3–4 мес. жизни [28].
Согласно Римским критериями IV, для диагностики младенческих колик необходимо соответствие всем трем критериям [16]:
1) возраст ребенка < 5 мес., когда симптомы начинаются и прекращаются;
2) повторяющиеся и продолжительные периоды плача, беспокойства или раздражительности, о которых сообщают лица, осуществляющие уход, которые происходят без очевидной причины и не могут быть предотвращены или устранены лицами, осуществляющими уход;
3) отсутствие признаков задержки развития, лихорадки или болезни.
Исследователи занимаются изучением долгосрочных последствий младенческих колик. В ряде исследований была продемонстрирована связь колик с развитием ФН ЖКТ в более старшем возрасте, также исследуется роль колик в формировании аллергических заболеваний и мигрени [25]. Таким образом, важно вовремя диагностировать данное состояние и осуществлять комплексный подход к терапии.
Функциональный запор определяется как нарушение функции кишечника, проявляющееся увеличением интервалов между дефекациями или систематическим недостаточным опорожнением кишечника. По данным Американской ассоциации педиатров, 95% запоров у детей имеют функциональный характер [29]. Патофизиологические механизмы развития функционального запора многогранны и представляют собой сложное взаимодействие ряда факторов, таких как дисбиоз кишечника, снижение моторики толстой кишки, аноректальные дисфункции, поведение задержки стула, психологические проблемы, генетическая предрасположенность, диета и снижение физической активности [30].
Согласно описательному обзору, совокупная распространенность в возрастной группе 0–12 мес. составляет 1,5–17% [26]. До 84% детей с запорами страдают от недержания кала, и более трети детей имеют поведенческие проблемы из-за данной патологии. Также отмечается, что в 25% случаев симптомы сохраняются во взрослом возрасте [31].
Диагностика функционального запора у детей в возрасте до 4 лет проводится в соответствии с Римскими критериями IV при наличии не менее 2 из следующих критериев в течение месяца [16]:
1) 2 или менее дефекаций в неделю;
2) 1 или более эпизодов недержания кала в неделю после приобретения гигиенических навыков;
3) наличие эпизодов задержки дефекации;
4) болезненные дефекации или твердые каловые массы 1-го или 2-го типа по Бристольской шкале стула;
5) образование каловых камней, которые могут затруднять дефекацию.
Для исключения органических причин запора требуется тщательный сбор анамнеза и проведение физикального обследования, направленные на выявление признаков болезни Гиршпрунга, аноректальных пороков развития, нервно-мышечных заболеваний и метаболических расстройств при эндокринных заболеваниях [32].
Клинические симптомы функционального запора многообразны. В большинстве случаев развитию функционального запора предшествует эпизод острой задержки стула, развивающийся в силу разных причин. В данных обстоятельствах акт дефекации у ребенка ассоциируется с неприятными ощущениями и болью, следствием чего является целенаправленное подсознательное удержание кала. При очередном позыве к дефекации дети либо предпринимают большие усилия для избавления от каловых масс, либо занимают «удерживающую позу», сокращая мышцы тазового дна, ягодичные мышцы. Такое поведение способствует задержке стула в прямой кишке, следствием чего является затруднение эвакуации, поскольку стул становится более комковатым и твердым. Таким образом, замыкается «порочный круг» нарушения дефекации [33]. Скопившиеся каловые массы растягивают стенку прямой кишки, способствуя формированию функционального мегаректума. Данное состояние сопровождается дисфункцией нервно-мышечной регуляции, что предвещает формирование диссинергической дефекации.
Патофизиологические механизмы развития запора многофакторны, что определяет необходимость проведения комплексной этиопатогенетической терапии.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Визит 1
Ребенок К., мальчик, 2 мес., на приеме с мамой.
Жалобы: сильный плач после еды, нерегулярный стул, срыгивания, короткие и беспокойные эпизоды сна. Анамнез жизни: беременность третья, первые две завершились родами. Протекала на фоне токсикоза в 1-м триместре, далее без особенностей. Роды самостоятельные, на сроке 39 нед. Масса тела 3 550 г, длина 52 см. Шкала Апгар 8/9 б. К груди приложен в родильном зале. Выписан домой своевременно. Контактов с инфекционными больными не было. Вакцинирован в соответствии с национальным календарем профилактических прививок. Аллергоанамнез не отягощен.
Анамнез заболевания: со слов мамы, на грудном вскармливании около 1,5 мес., далее из-за гипогалактии вынуждены были перевести на адаптированную молочную смесь. В аптеке посоветовали питание на основе коровьего белка. Через 2 ч после кормления ребенок стал беспокойным, постоянно находился в вынужденном положении (с прижатыми к животу ножками). Через неделю стали отмечать срыгивания 4–5 раз в день объемом около 5 мл. Стул нерегулярный, через день, мягкий, горчичного цвета. Самостоятельно ставят газоотводную трубочку, дают препараты «против колик», состояние с легкой положительной динамикой. За последнюю неделю приступы плача стали более продолжительными. Ребенок спит короткими снами по 20–30 мин, просыпается с плачем.
Объективный осмотр: температура тела 36,6 °С, масса тела 5 220 г, длина 54,5 см. На осмотр реагирует положительно. Аппетит сохранен. Кожные покровы розовые, сыпи нет, влажность удовлетворительная. Слизистая полости рта чистая, язык чистый. Дыхание в легких пуэрильное, хрипов нет. Частота дыхательных движений – 38/мин. Тоны сердца ясные, ритмичные. Частота сердечных сокращений – 120/мин. Живот умеренно вздут, доступен глубокой пальпации. Стула на момент осмотра нет.
Учитывая жалобы, данные анамнеза, объективного осмотра и беря во внимание, отсутствие факторов риска интенсивных колик (низкий вес при рождении, первенец, атопия в анамнезе у матери, высокие симптомы послеродовой депрессии у матери, постоянная пренатальная тошнота), было предположено, что проблемы с ЖКТ могут быть связаны с употреблением коровьего молока. Воспользовавшись оценочной шкалой CoMiSS (Cow’s Milk-related Symptom Score) и опираясь на данные, что детское питание на основе козьего молока может быть перспективной альтернативой детскому питанию на основе коровьего молока для младенцев, страдающих от симптомов со стороны ЖКТ, при полученных результатах CoMiSS < 6 был рекомендован перевод на смесь на основе козьего молока Kabrita® (табл. 2) [34]. Был получен результат, равный 5 баллам, что указывает на симптомы, которые могут быть связаны с употреблением коровьего молока, но не являются аллергией на коровье молоко.
Таблица 2. CoMiSS: оценка симптомов, возникающих при употреблении коровьего молока
| Симптом | Оценка | Периодичность | Фактическая оценка |
| Плач | 0 1 2 3 4 5 6 |
≤1
ч/день 1–1,5 ч/день 1,5–2 ч/день 2–3 ч/день 3–4 ч/день 4–5 ч/день ≥5 ч/день |
2 |
| Срыгивание |
0 1 2 3 4 5 6 |
0–2
эпизода/день ≥3 – ≤5 небольшого объема >5 эпизодов в объеме >1 кофейной ложки >5 эпизодов в объеме ± половины употребленной порции < половины кормлений Постоянное срыгивание в небольшом объеме в течеие > 30 мин после каждого кормления Срыгивание от половины до всего объема порции питания во время по меньшей мере половины кормлений Срыгивание всей порции питания после каждого кормления |
1 |
| Стул (Бристольская шкала) |
4 0 2 4 6 |
1-й
и 2-й тип (твердый стул) 3-й и 4-й тип (нормальный стул) 5-й тип (мягкий стул) 6-й тип (жидкий стул, если не связан с инфекцией) 7-й тип (водянистый стул) |
2 |
| Кожные симптомы |
Голова,
шея, туловище 0 1 2 3 Руки, ноги 0 1 2 3 |
отсутствует слабовыраженная умеренная тяжелая отсутствует слабовыраженная умеренная тяжелая |
0 |
| Респираторные симптомы |
0 1 2 3 |
Отсутствуют
Слабовыраженные Умеренные Тяжелые |
0 |
Контрольный осмотр был назначен через 2 нед.
Визит 2
Ребенок К., мальчик, 2 мес., на приеме с мамой. Жалоб нет. Анамнез заболевания: улучшения отмечают с первого дня применения смеси на основе козьего молока. Срыгивания сократились до 1–2 раз в день. Увеличилась продолжительность сна. После первой недели приема стул стал ежедневным.
Особенности смеси на основе козьего молока
Проблемы с ЖКТ у детей до года могут вызывать стресс у родителей, беспокойство и недостаток сна, особенно если ребенок находится на искусственном вскармливании. Хотя большинство младенцев естественным образом перерастают эти симптомы по мере взросления, детская смесь, которая уменьшает дискомфорт, может быть полезна, когда интенсивность ФН достигает своего пика [35]. Хотя общий состав белков, жиров и углеводов в коровьем и козьем молоке схож, между ними есть различия, которые могут влиять на их усвояемость и питательную ценность [36]. Белок козьего молока имеет различные показатели пользы для здоровья с точки зрения переваривания. На сегодняшний день в экспериментах in vitro показано, что он усваивается быстрее и эффективнее [37]. Продукты с высоким содержанием казеина, как правило, вызывают секрецию желудочной кислоты, что приводит к коагуляции казеина и замедляет опорожнение желудка [9]. В дополнение к этому одной из отличительных особенностей козьего молока является отсутствие β-казеина А1, который присутствует в коровьем молоке. Исследования показывают, что этот белок может вызывать воспалительные процессы и дискомфорт в ЖКТ у некоторых детей. Козье молоко содержит преимущественно β-казеин А2, который более безопасен и лучше переносится [38]. Кроме того, благодаря β-казеину А2 козье молоко может способствовать снижению аллергенного потенциала [39, 40, 41]. На сегодняшний день D. Infante et al. доказали, что введение смеси на основе козьего молока быстро снижает интенсивность симптомов со стороны ЖКТ [42]. Она хорошо переносится, безопасна и способствует нормальному росту младенцев. Об этом также свидетельствовало низкое количество негативных симптомов в исследовании P. Maximino et al. [43]. Доказано, что средняя ежедневная частота дефекации была выше у детей, получавших смеси на основе козьего молока [44]. Также в тематическом исследовании A. Salsberg et al. употребление подобной смеси в течение 3 нед. хорошо переносилось 11-месячными детьми, у которых наблюдались негативные симптомы, связанные с употреблением коровьего молока, и показатели шкалы CoMiSS уменьшились после введения козьей смеси [45].
Помимо белков, жиры коровьего и козьего молока различаются как по структуре, так и по липидному профилю. Жировые шарики в козьем молоке меньше и содержат больше среднецепочечных жирных кислот, что может сделать это молоко более усвояемым [45].
Акцентируя внимание на формировании микробиоты у младенцев, нельзя не отметить, что детские смеси на основе козьего молока избирательно увеличивают относительное содержание Blautia, Roseburia и Muribaculum в кишечнике, а идентификация метаболомики показала стимуляцию биосинтеза желчных кислот, стероидов и метаболизм арахидоновой кислоты. Полученные метаболиты были положительно связаны с увеличением количества микроорганизмов в детских смесях на основе козьего молока [46]. К тому же молочные олигосахариды (МОС), естественным образом присутствующие в таких детских смесях, проявляют сильные пребиотические свойства и антипатогенную адгезию. Они могут способствовать здоровью кишечника младенцев, стимулировать рост Bifidobacterium animalis subsp. lactis BB12, B. longum BB536, Lactobacillus acidophilus 4461 и L. Casei, а в качестве противоинфекционного средства предотвращать адгезию Escherichia coli NCTC 10418 и Salmonella typhimurium к клеткам Caco-2 [47, 48]. Конкретно в исследовании K. Chen et al. Bifidobacterium animalis subsp. lactis BB-12, присутствующая в молочной смеси Kabrita®, снижала частоту плача младенцев [49]. А в исследовании 2024 г. в долгосрочной перспективе было показано, что продолжительность дневного сна была значительно больше у детей, получавших смеси на основе козьего молока (в среднем 8,6 ч). К тому же поперечный анализ показывает, что у младенцев, получавших грудное молоко и смесь на основе козьего молока, продолжительность сна была выше, чем у младенцев, получавших смесь на основе коровьего молока (рис. 2) [50].
Рисунок 2. Результаты продолжительности сна у детей на грудном вскармливании и на смеси из козьего молока Kabrita®
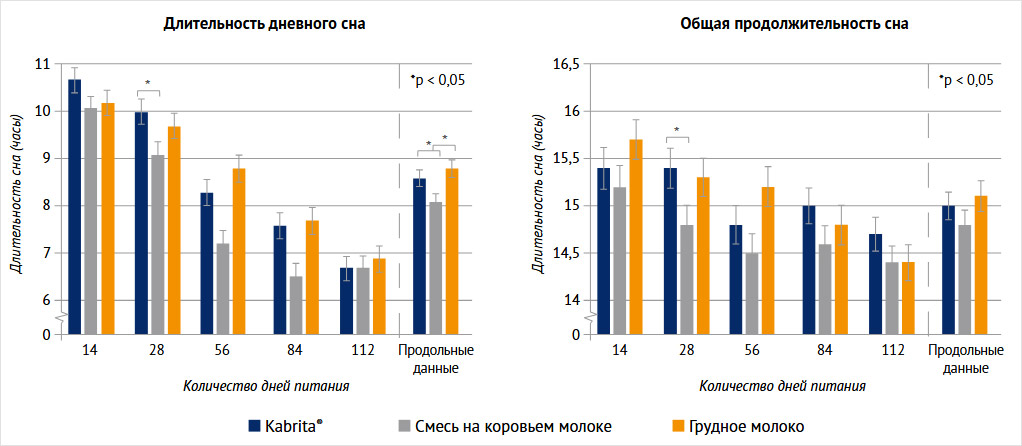
Продольные данные показали, что время дневного сна у младенцев на смеси из козьего молока (Kabrita®) сравнимо с продолжительностью сна у младенцев на грудном молоке и статистически значимо: на 30 мин больше, чем у младенцев на смеси из коровьего молока (р = 0,03). При анализе данных по отдельным визитам видно, что общая продолжительность сна у детей на смеси Kabrita® существенно выше, чем у детей на коровьей смеси. Эта разница особенно очевидна на 28-й день приема смесей (MD 0,60, 95% Сl 0,03–1,18) [1].
В подтверждение вышесказанному исследование «Эволюция младенческой микробиоты под влиянием различных продуктов питания» показало, что микробиота детей, употребляющих смесь из козьего молока Kabrita®, сходна с микробиотой детей на грудном вскармливании (корреляция 94,6%). Исследования, связанные с использованием смесей Kabrita®, показывают, что после 6 мес. их использования наблюдаются заметные темпы роста популяций Bifidobacterium у младенцев [2].
Заключение
Смеси на основе козьего молока действительно имеют ряд свойств, которые делают их привлекательным вариантом для детского питания. Дети, употребляющие смесь на основе козьего молока, показывают низкую распространенность негативных симптомов со стороны ЖКТ, указывая на ее потенциальную пользу. Формулы молочных смесей из линейки Kabrita® способствуют быстрому росту и развитию ребенка, улучшают пищеварение, помогают сформировать здоровую микробиоту ЖКТ и способствуют более спокойному и продолжительному сну в течение всего времени.
[1] Длительность сна у младенцев на смеси из козьего молока. По данным двойного слепого рандомизированного контролируемого исследования. Режим доступа: https://www.kabrita.ru/spetsialistam/pages/Kabrita_uluchshaet_son-podtverzhdeno_klinicheskimi_issledovaniyami.pdf.
[2] The evolution of infants’ gut microbiota under different feeding regimes. Available at: https://ausnutria-nutrition-institute.com/app/uploads/2021/06/6126_AUSNUTRIA_WCPGHAN_Poster_Microbiota_A0_i.pdf.
Список литературы / References
Развернуть
- Румянцев АГ, Тимакова МВ. История и эволюция педиатрии. Вопросы практической педиатрии. 2013;8(2):59-65. Режим доступа: https://elibrary.ru/qajkgd.
- Lim ML, Wallace MR. Infectious diarrhea in history. Infect Dis Clin North Am. 2004;18(2):261-274. https://doi.org/10.1016/j.idc.2004.01.006.
- Ковнер С. Очерки истории медицины. Вып. третий (От Платона до Галена). Киев; 1888. 436 с. Режим доступа: https://commons.wikimedia.org/wiki/File:Ковнер_С._Г._-_Очерки_истории_медицины_(вып_III)_1888.pdf.
- Захарова ИН, Лыкина ЕВ. Последствия неправильного вскармливания детей. Вопросы современной педиатрии. 2007;6(1):40-46. Режим доступа: https://vsp.spr-journal.ru/jour/article/view/995.
- Darmon N, Drewnowski A. Does social class predict diet quality? Am J Clin Nutr. 2008;87(5):1107-1117. https://doi.org/10.1093/ajcn/87.5.1107.
- Keefe DM. Agency Response Letter GRAS Notice No. GRN 000644, C.f.F.S.a.A. Nutrition, Editor; 2016. Available at: https://www.fda.gov/food/gras-notice-inventory/agency-response-letter-gras-notice-no-grn-000644.
- Agostoni C, Bresson JL, Fairweather-Tait S, Flynn A, Golly I, Korhonen H et al. Scientific Opinion on the suitability of goat milk protein as a source of protein in infant formulae and in follow-on formulae. EFSA J. 2012;10(3):2603. https://doi.org/10.2903/j.efsa.2012.2603.
- Maathuis A, Havenaar R, He T, Bellmann S. Protein Digestion and Quality of Goat and Cow Milk Infant Formula and Human Milk Under Simulated Infant Conditions. J Pediatr Gastroenterol Nutr. 2017;65(6):661-666. https://doi.org/10.1097/MPG.0000000000001740.
- Hodgkinson AJ, Wallace OAM, Boggs I, Broadhurst M, Prosser CG. Gastric digestion of cow and goat milk: Impact of infant and young child in vitro digestion conditions. Food Chem. 2018;245:275-281. https://doi.org/10.1016/j.foodchem.2017.10.028.
- Bellaiche M, Oozeer R, Gerardi-Temporel G, Faure C, Vandenplas Y. Multiple functional gastrointestinal disorders are frequent in formula-fed infants and decrease their quality of life. Acta Paediatr. 2018;107(7):1276-1282. https://doi.org/10.1111/apa.14348.
- Iacono G, Merolla R, D’Amico D, Bonci E, Cavataio F, Di Prima L et al. Gastrointestinal symptoms in infancy: a population-based prospective study. Dig Liver Dis. 2005;37(6):432-438. https://doi.org/10.1016/j.dld.2005.01.009.
- Steutel NF, Zeevenhooven J, Scarpato E, Vandenplas Y, Tabbers MM, Staiano A, Benninga MA. Prevalence of Functional Gastrointestinal Disorders in European Infants and Toddlers. J Pediatr. 2020;221:107-114. https://doi.org/10.1016/j.jpeds.2020.02.076.
- Vernon-Roberts A, Safe M, Day AS. Editorial: Pediatric Functional Gastrointestinal Disorders: Challenges in Diagnosis and Treatment. Gastrointest Disord. 2024;6(1):308-312. https://doi.org/10.3390/gidisord6010021.
- Drossman DA. The functional gastrointestinal disorders and the Rome II process. Gut. 1999;45(Suppl. 2):II1-II5. https://doi.org/10.1136/gut.45.2008.ii1.
- Колесников ДБ, Рапопорт СИ, Вознесенская ЛА. Современные взгляды на психосоматические заболевания. Клиническая медицина. 2014;92(7):12-18. Режим доступа: https://elibrary.ru/smyapf.
- Drossman DA. Functional Gastrointestinal Disorders: History, Pathophysiology, Clinical Features and Rome IV. Gastroenterology. 2016;150(6):1262-1279.e2. https://doi.org/10.1053/j.gastro.2016.02.032.
- Zeng XL, Zhu LJ, Yang XD. Exploration of the complex origins of primary constipation. World J Clin Cases. 2024;12(24):5476-5482. https://doi.org/10.12998/wjcc.v12.i24.5476.
- Симаненков ВИ, Маев ИВ, Ткачева ОН, Алексеенко СА, Андреев ДН, Бордин ДС и др. Синдром повышенной эпителиальной проницаемости в клинической практике. Мультидисциплинарный национальный консенсус. Кардиоваскулярная терапия и профилактика. 2021;20(1):2758. https://doi.org/10.15829/1728-8800-2021-2758.
- Aydemir Y, Aydemir O, Dinleyici M, Saglik AC, Cam D, Kaya TB, Canpolat FE. Screening for functional gastrointestinal disorders in preterm infants up to 12 months of corrected age: a prospective cohort study. Eur J Pediatr. 2024;183(5):2091-2099. https://doi.org/10.1007/s00431-024-05451-4.
- Vernon-Roberts A, Alexander I, Day AS. Systematic Review of Pediatric Functional Gastrointestinal Disorders (Rome IV Criteria). J Clin Med. 2021;10(21):5087. https://doi.org/10.3390/jcm10215087.
- Indrio F, Enninger A, Aldekhail W, Al-Ghanem G, Al-Hussaini A, Al-Hussaini B et al. Management of the Most Common Functional Gastrointestinal Disorders in Infancy: The Middle East Expert Consensus. Pediatr Gastroenterol Hepatol Nutr. 2021;24(4):325-336. https://doi.org/10.5223/pghn.2021.24.4.325.
- Benninga MA, Faure C, Hyman PE, St James Roberts I, Schechter NL, Nurko S. Childhood Functional Gastrointestinal Disorders: Neonate/Toddler. Gastroenterology. 2016;150(6):1443-1455.e2. https://doi.org/10.1053/j.gastro.2016.02.016.
- Deeb MT, Mohsen YM, Nehal ES. Diagnostic Outcome of Rome IV Criteria in Infant Regurgitation. QJM. 2024;117(Suppl. 1):hcae070.494. https://doi.org/10.1093/qjmed/hcae070.494.
- Захарова ИН, Сугян НГ, Бережная ИВ. Функциональные гастроинтестинальные расстройства у детей раннего возраста: критерии диагностики и подходы к диетотерапии. Российский вестник перинатологии и педиатрии. 2018;63(1):113-121. https://doi.org/10.21508/1027-4065-2018-63-1-113-121.
- Indrio F, Dargenio VN, Francavilla R, Szajewska H, Vandenplas Y. Infantile Colic and Long-Term Outcomes in Childhood: A Narrative Synthesis of the Evidence. Nutrients. 2023;15(3):615. https://doi.org/10.3390/nu15030615.
- Muhardi L, Aw MM, Hasosah M, Ng RT, Chong SY, Hegar B et al. A Narrative Review on the Update in the Prevalence of Infantile Colic, Regurgitation, and Constipation in Young Children: Implications of the ROME IV Criteria. Front Pediatr. 2022;9:778747. https://doi.org/10.3389/fped.2021.778747.
- Despriee ÅW, Mägi CO, Småstuen MC, Glavin K, Nordhagen L, Jonassen CM et al. Prevalence and perinatal risk factors of parent-reported colic, abdominal pain and other pain or discomforts in infants until 3 months of age - A prospective cohort study in PreventADALL. J Clin Nurs. 2022;31(19-20):2784-2796. https://doi.org/10.1111/jocn.16097.
- Haiden N, Savino F, Hill S, Kivelä L, De Koning B, Kӧglmeier J et al. Infant formulas for the treatment of functional gastrointestinal disorders: A position paper of the ESPGHAN Nutrition Committee. J Pediatr Gastroenterol Nutr. 2024;79(1):168-180. https://doi.org/10.1002/jpn3.12240.
- Walter AW, Hovenkamp A, Devanarayana NM, Solanga R, Rajindrajith S, Benninga MA. Functional constipation in infancy and early childhood: epidemiology, risk factors, and healthcare consultation. BMC Pediatr. 2019;19(1):285. https://doi.org/10.1186/s12887-019-1652-y.
- Tran DL, Sintusek P. Functional constipation in children: What physicians should know. World J Gastroenterol. 2023;29(8):1261-1288. https://doi.org/10.3748/wjg.v29.i8.1261.
- Diaz S, Bittar K, Hashmi MF, Mendez MD. Constipation. In: StatPearls. Treasure Island (FL): StatPearls Publishing; 2023. Available at: https://pubmed.ncbi.nlm.nih.gov/30020663.
- Захарова ИН, Бережная ИВ, Касьянова АН, Сугян НГ, Лазарева СИ, Дедикова ОВ и др. Функциональные нарушения желудочно-кишечного тракта у детей раннего возраста - современный взгляд на традиционные проблемы у младенцев. Педиатрия. Consilium Medicum. 2018;(3):24-29. Режим доступа: https://www.kabrita.ru/assets/assets_vracham/pdf/nauchnye-publikatsii/Consilium Medicum, 2018 №3.pdf.
- Zeevenhooven J, Koppen IJ, Benninga MA. The New Rome IV Criteria for Functional Gastrointestinal Disorders in Infants and Toddlers. Pediatr Gastroenterol Hepatol Nutr. 2017;20(1):1-13. https://doi.org/10.5223/pghn.2017.20.1.1.
- Switkowski KM, Oken E, Simonin EM, Nadeau KC, Rifas-Shiman SL, Lightdale JR. Early-life risk factors for both infant colic and excessive crying without colic. Pediatr Res. 2024. https://doi.org/10.1038/s41390024-03518-4.
- Vandenplas Y, Bajerova K, Dupont C, Eigenmann P, Kuitunen M, Meyer R et al. The Cow’s Milk Related Symptom Score: The 2022 Update. Nutrients. 2022;14(13):2682. https://doi.org/10.3390/nu14132682.
- Vandenplas Y. Algorithms for Common Gastrointestinal Disorders. J Pediatr Gastroenterol Nutr. 2016;63(Suppl. 1):S38-S40. https://doi.org/10.1097/MPG.0000000000001220.
- Verruck S, Dantas A, Prudencio ES. Functionality of the components from goat’s milk, recent advances for functional dairy products development and its implications on human health. J Funct Foods. 2019;52:243-257. https://doi.org/10.1016/j.jff.2018.11.017.
- Gan J, Bornhorst GM, Henrick BM, German JB. Protein Digestion of Baby Foods: Study Approaches and Implications for Infant Health. Mol Nutr Food Res. 2018;62(1):1700231. https://doi.org/10.1002/mnfr.201700231.
- Muñoz-Salinas F, Andrade-Montemayor HM, De la Torre-Carbot K, Duarte-Vázquez MÁ, Silva-Jarquin JC. Comparative Analysis of the Protein Composition of Goat Milk from French Alpine, Nubian, and Creole Breeds and Holstein Friesian Cow Milk: Implications for Early Infant Nutrition. Animals. 2022;12(17):2236. https://doi.org/10.3390/ani12172236.
- Hodgkinson AJ, Wallace OAM, Smolenski G, Prosser CG. Gastric digestion of cow and goat milk: Peptides derived from simulated conditions of infant digestion. Food Chem. 2019;276:619-625. https://doi.org/10.1016/j.foodchem.2018.10.065.
- Lara-Villoslada F, Olivares M, Jiménez J, Boza J, Xaus J. Goat milk is less immunogenic than cow milk in a murine model of atopy. J Pediatr Gastroenterol Nutr. 2004;39(4):354-360. https://doi.org/10.1097/00005176200410000-00010.
- Infante D, Prosser C, Tormo R. Constipated Patients Fed Goat Milk Protein Formula: A Case Series Study. J Nutr Health Sci. 2018;5(2):203. https://doi.org/10.15744/2393-9060.5.203.
- Maximino P, van Lee L, Meijer-Krommenhoek YN, van der Zee L, da Costa Ribeiro Junior H. Common gastrointestinal symptoms in healthy infants receiving goat milk-based formula or cow’s milk-based formula: a double-blind, randomized, controlled trial. BMC Pediatr. 2024;24(1):753. https://doi.org/10.1186/s12887-024-05214-y.
- Grant C, Rotherham B, Sharpe S, Scragg R, Thompson J, Andrews J et al. Randomized, double-blind comparison of growth in infants receiving goat milk formula versus cow milk infant formula. J Paediatr Child Health. 2005;41(11):564-568. https://doi.org/10.1111/j.1440-1754.2005.00722.x.
- Salsberg A. Goat Milk Toddler Formula Reduces Symptoms Associated With Cow Milk Consumption. J Acad Nutr Dietetics. 2016;116(9):A100. https://doi.org/10.1016/J.JAND.2016.06.363.
- Kompan D, Komprej A. The Effect of Fatty Acids in Goat Milk on Health. In: Chaiyabutr N (ed.). Milk Production - An Up-to-Date Overview of Animal Nutrition, Management and Health. InTech; 2012. https://doi.org/10.5772/50769.
- Chen Q, Yin Q, Xie Q, Liu S, Guo Z, Li B. Elucidating gut microbiota and metabolite patterns shaped by goat milk-based infant formula feeding in mice colonized by healthy infant feces. Food Chem. 2023;410:135413. https://doi.org/10.1016/j.foodchem.2023.135413.
- Leong A, Liu Z, Almshawit H, Zisu B, Pillidge C, Rochfort S, Gill H. Oligosaccharides in goats’ milk-based infant formula and their prebiotic and anti-infection properties. Br J Nutr. 2019;122(4):441-449. https://doi.org/10.1017/S000711451900134X.
- Chen K, Zhang G, Xie H, You L, Li H, Zhang Y et al. Efficacy of Bifidobacterium animalis subsp. lactis, BB-12® on infant colic -a randomised, doubleblinded, placebo-controlled study. Benef Microbes. 2021;12(6):531-540. https://doi.org/10.3920/BM2020.0233.
- van Lee L, Meijer-Krommenhoek Y, He T, van der Zee L, Verkade H. Sleep duration among breastfed, goat milk-based or cow’s milk-based infant formula-fed infants: Post hoc analyses from a double-blind RCT. J Pediatr Gastroenterol Nutr. 2025;80(3):482-489. https://doi.org/10.1002/jpn3.12436.








