
Журнал "Медицинский совет" №12/2023
DOI: 10.21518/ms2023-149
Л.Я. Климов 1, В.А. Курьянинова 1,2,3, Е.А. Черкасова 1, А.В. Ягупова 1,2, С.В. Долбня 1,4, И.Н. Захарова 5, Л.М. Абрамская 1, Т.А. Ивенская 1, С.Н. Кашникова 1, Л.Д. Кочнева 1,4, Г.Ю. Уткина 2, Д.В. Бобрышев 1, А.А. Карайкозова 1, Е.А. Ермакова
1 Ставропольский государственный медицинский университет; 355017, Россия, Ставрополь, ул. Мира, д. 310
2 Городская детская клиническая больница имени Г.К. Филиппского; 355002, Россия, Ставрополь, ул. Пономарева, д. 5
3 Международный медицинский центр «Мой медицинский центр»; 191186, Россия, Санкт-Петербург, ул. М. Конюшенная, д. 8
4 Краевая детская клиническая больница; 355029, Россия, Ставрополь, ул. Семашко, д. 3
5 Российская медицинская академия непрерывного профессионального образования; 125993, Россия, Москва,
ул. Баррикадная, д. 2/1, стр. 1
Введение. Одним из клинических проявлений целиакии является нарушение процессов костного ремоделирования, что повышает риск развития остеопенических состояний, в т. ч. переломов костей. Средний возраст первого перелома одинаков при целиакии и в общей популяции, однако частота выше у пациентов с целиакией.
Цель. Сопоставить клинико-анамнестические, антропометрические и лабораторные показатели у детей и подростков с целиакией с переломами и без переломов костей.
Материалы и методы. В исследование включен 151 ребенок с целиакией в возрасте от 1 до 17 лет. Пациенты разделены на две группы: имевшие переломы в течение жизни - 21 (13,9%) ребенок и не имевшие переломов - 130 (86,1%) детей.
Результаты. Частота переломов среди включенных в исследование пациентов составила 13,9%, при этом у детей с дефицитом витамина D переломы регистрировались в 2,7 раза чаще, чем у детей с его оптимальным уровнем (р = 0,019).
У 20 (95,2%) детей с переломами выявлен дефицит витамина D, а значения 30 нг/мл и более - у 1 (4,8%) ребенка. В группе пациентов без переломов оптимальный уровень 25(OH)D отмечался в 43 (33,1%) случаях. У пациентов с переломами выявлен статистически значимо более низкий показатель остеокальцина, чем у детей без переломов, - 26,9 (15,6; 32,9) нг/мл (р < 0,001), а уровень С-концевого телопептида у детей с переломами в 1,9 раза превышает его уровень в группе детей, не имеющих переломы (р = 0,01). Медиана паратгормона у детей с переломами - 34,6 (19,6; 54,7) пг/мл, у детей без переломов - 24,2 (17,1; 39,5) пг/мл (р = 0,1).
Выводы. У детей с целиакией и переломами трубчатых костей отмечается преобладание остеорезорбции над остеосинтезом за счет повышенного уровня паратгормона и выраженного дефицита витамина D. Поддержание оптимального уровня 25(OH)D и мониторинг биохимических маркеров костного метаболизма имеют у пациентов с целиакией значение для оценки процессов формирования и резорбции кости.
Для цитирования: Климов Л.Я., Курьянинова В.А., Черкасова Е.А., Ягупова А.В., Долбня С.В., Захарова И.Н., Абрамская Л.М., Ивенская Т.А., Кашникова С.Н., Кочнева Л.Д., Уткина Г.Ю., Бобрышев Д.В., Карайкозова А.А., Ермакова Е.А. Переломы костей у детей с целиакией: анализ клинико-антропометрических данных и показателей костного метаболизма. Медицинский Совет. 2023;(12):171-181. https://doi.org/10.21518/ms2023-149
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Информированное согласие. Пациент дал свое информированное согласие на публикацию этого клинического наблюдения.
Bone fractures in children with celiac disease: analysis of clinical and anthropometric measurements and bone metabolism markers
Leonid Ya. Klimov1, Victoriya A. Kuryaninova 1,2,3, Elizaveta A. Cherkasova 1, Anastasia V. Yagupova 1,2, Svetlana V. Dolbnya 1,4, Irina N. Zakharova 5, Lyudmila M. Abramskaya 1, Tatyana A. Ivenskaya 1, Svetlana N. Kashnikova 1, Lyubov D. Kochneva1,4, Galina Yu. Utkina 2, Dmitry V. Bobryshev 1, Alena A. Karaikozova 1, Ekaterina A. Ermakova 1
1 Stavropol State Medical University; 310, Mira St., Stavropol, 355017, Russia
2 Filippskiy City Children’s Clinical Hospital; 5, Ponomarev St., Stavropol, 355002, Russia
3 Мy Medical Center International Medical Center; 8, M. Konyushennaya St., St Petersburg, 191186, Russia
4 Regional Children’s Clinical Hospital; 3, Semashko St., Stavropol, 355029, Russia
5 Russian Medical Academy of Continuous Professional Education; 2/1, Bldg. 1, Barrikadnaya St., Moscow, 125993, Russia
Introduction. Abnormal bone remodelling process is one of the clinical manifestations of celiac disease, which increases the risk of developing osteopenia conditions, including bone fractures. The median age for the first fracture is similar in celiac disease and in the general population, but the incidence is higher in patients with celiac disease.
Aim. To compare clinical and anamnestic characteristics, anthropometric measurements and laboratory test results in celiac children and adolescents with and without bone fractures.
Materials and methods. A total of 151 children aged 1–17 years were included in the study. Patients were divided into two groups: those who had fractures in their lifetime – 21 (13.9%) children and those who had no fractures – 130 (86.1%) children.
Results. The frequency of fractures among the patients included in the study was 13.9%, while among children with vitamin D deficiency fractures were reported 2.7 times more often than among children with its optimal level (p = 0.019). Vitamin D deficiency was detected in 20 (95.2%) children with fractures, and levels of 30 ng/ml or higher were found in 1 (4.8%) child. In the group of patients without fractures, the 25(OH)D optimal level was observed in 43 (33.1%) cases. It was found that patients with fractures had a significantly lower osteocalcin level than children without fractures – 26.9 (15.6; 32.9) ng/ml (p < 0.001), and children with fractures had C-terminal telopeptide level 1.9 times higher than the group of children without fractures (p = 0.01). The median PTH concentration in children with fractures was 34.6 (19.6; 54.7) pg/ml, whereas in children without fractures it was 24.2 (17.1; 39.5) pg/ml (p = 0.1).
Conclusion. Due to elevated PTH level and severe vitamin D deficiency, a predominance of osteoresorption over osteosynthesis was observed in children with celiac disease and fractures of tubular bones. It is important to maintain a 25(OH)D optimal level and monitor biochemical markers of bone metabolism in patients with celiac disease to assess the processes of bone formation and resorption.
For citation: Klimov L.Y., Kuryaninova V.A., Cherkasova E.A., Yagupova A.V., Dolbnya S.V., Zakharova I.N., Abramskaya L.M., Ivenskaya T.A., Kashnikova S.N., Kochneva L.D., Utkina G.Yu., Bobryshev D.V., Karaikozova A.A., Ermakova E.A. Bone fractures in children with celiac disease: analysis of clinical and anthropometric measurements and bone metabolism markers. Meditsinskiy sovet = Medical Council. 2023;(12):171-181. (In Russ.) https://doi.org/10.21518/ms2023-149
Conflict of interest: the authors declare no conflict of interest.
Informed consent. The patient has given his or her informed consent to the publication of this clinical observation.
Введение
Целиакия представляет собой хроническое генетически детерминированное иммуноопосредованное заболевание, связанное с непереносимостью глютена и/или соответствующих проламинов, проявляющееся атрофической энтеропатией и развитием синдрома мальабсорбции [1–3].
На сегодняшний день, согласно данным высокочувствительных скринирующих популяционных исследований, проведенных за последние 35 лет, частота встречаемости глютеновой энтеропатии составляет около 1% населения [4]. В нашей стране крупных эпидемиологических исследований до настоящего времени не проводилось, а предполагаемая частота заболевания в России может составлять 1:100–1:250 [1, 3, 5]. Анализ эпидемиологии целиакии демонстрирует преобладание недиагностированных случаев, что, вероятно, объясняется преобладанием в структуре нозологии малосимптомных и скрытых форм, затрудняя процесс постановки диагноза и ухудшая качество жизни пациентов [6, 7].
На сегодняшний день накоплено достаточно данных, позволяющих утверждать, что целиакия является генетически детерминированным заболеванием, факторами риска развития которого являются гаплотипы HLA-DQ2 и HLA-DQ8, встречаемые практически у 100% больных [1] [8].
Результатом повреждения слизистой оболочки тонкой кишки, проявляющимся различной степенью гиперрегенераторной атрофии ее ворсинок, является развитие синдрома мальабсорбции, что приводит к формированию нарушений внутрикишечного метаболизма, формируя сложную и полиморфную клиническую картину заболевания.
Клинические проявления целиакии условно можно подразделить на две группы: кишечные, формирующие «ядро» симптомокомплекса типичной целиакии, и внекишечные, обусловленные метаболическими расстройствами [6, 9, 10].
Одним из весьма значимых проявлений целиакии, приводящих к значительному снижению качества жизни пациентов, является нарушение процессов костного ремоделирования (остеосинтеза и остеорезорбции), что значительно повышает риск развития остеопении и остеопороза у детей и подростков с данной нозологией. Механизмы, лежащие в основе нарушения минерализации костной ткани при глютеновой энтеропатии, очевидны [11]. Синдром мальабсорбции, являясь ключевым звеном в патогенезе проявлений целиакии, приводит к нарушению всасывания кальция и витамина D, тем самым стимулируя биологическую активность остеокластов и способствуя развитию остеомаляции. Кроме того, нарушения костной минерализации обусловлены изменениями гормональных механизмов регуляции линейного роста и кальцификации скелета. В частности, мальабсорбция кальция способствует компенсаторному повышению уровня паратиреоидного гормона с развитием вторичного гиперпаратиреоза, что приводит к стимуляции остеокластов и мобилизации ионов кальция из его основного депо в организме – костной ткани (рис. 1) [12–17].
Рисунок 1. Роль активного метаболита витамина D кальцитриола и паратиреоидного гормона в регуляции кальциевого гомеостаза

CaSR (calcium-sensing receptor) – рецептор, чувствительный к кальцию; VDR (Vitamin D Receptor) – рецептор витамина D; ПТГ – паратиреоидный гормон; FGF23 (Fibroblast Growth Factor 23) – фактор роста фибробластов; RANKL (Receptor Activator of Nuclear Factor Kappa-B Ligand) – мембранный белок, цитокин семейства факторов некроза опухоли
Важнейшую роль в процессах костного метаболизма играет витамин D – биологически активное вещество, относящееся к семейству стероидных гормонов и имеющее две основные формы – витамин D2 (эргокальциферол) и витамин D3 (холекальциферол), которые можно найти в продуктах питания или добавках, однако только холекальциферол способен вырабатываться эндогенно в коже под воздействием излучения ультрафиолетового спектра. Процессы метаболических превращений витамина D до образования его активных соединений осуществляются посредством реакций гидроксилирования, происходящих в коже, печени, почках, в результате чего образуется кальцидиол – 25(OH)D, являющийся основным циркулирующим метаболитом витамина D. Его содержание в плазме крови является надежным и специфичным показателем обеспеченности организма витамином. Витамин D реализует свое биологическое действие, связываясь с высокополиморфными рецепторами (Vitamin D Receptor, VDR), выявленными более чем в 38 органах и тканях организма и обеспечивающими его плейотропный эффект [12, 14].
Наиболее значимой функцией витамина D в детском возрасте, очевидно, является остеотропное действие и участие в регуляции фосфорно-кальциевого метаболизма. Биологически активный метаболит витамина D кальцитриол регулирует синтез кальций-связывающих белков, ответственных за абсорбцию ионов кальция в кишечнике и реабсорбцию в почках, тем самым поддерживая процессы минерализации коллагенового матрикса. В период активного роста ребенка абсорбция кальция возрастает до 80%, а в отсутствие достаточного уровня кальцитриола снижается до 10–15%, что приводит к снижению минеральной плотности костной ткани, снижению темпов роста, развитию остеопенических состояний, а в перспективе – к развитию остеопороза. Прогрессирующая деминерализация костной ткани, существующая на протяжении нескольких лет, особенно в условиях атипичного и субклинического течения целиакии, неизбежно приводит к снижению прочности костей, что существенно повышает риск развития спонтанных переломов [12, 18–20].
Дети и подростки с целиакией составляют группу риска по развитию витамин D- и кальций-дефицитных состояний; компенсаторные возможности повышенного всасывания данных нутриентов у них весьма ограниченны. Закономерно, что частота переломов у детей и подростков с целиакией значительно превосходит таковую в популяции здоровых детей. Средний возраст первого эпизода перелома, согласно данным ряда исследований, одинаков у пациентов с глютеновой энтеропатией и в общей популяции, однако частота переломов выше у пациентов с целиакией [4, 21].
В отличие от других осложнений целиакии, частота которых напрямую коррелирует с временем постановки диагноза и длительностью нахождения на безглютеновой диете, высокий риск развития переломов может сохраняться в течение многих лет с момента постановки диагноза и отнюдь не всегда зависит от сроков соблюдения диеты, однако данные об этом весьма противоречивы. Некоторые авторы свидетельствуют о постоянном долгосрочном риске возникновения спонтанных переломов, в то время как другие считают, что риск ограничен преддиагностическим периодом и значительно снижается при переводе пациента на безглютеновую диету; кроме того, повышенный риск возникновения переломов может отмечаться у пациентов, соблюдающих диету нестрого [22, 23].
Неоднородность результатов может быть частично обусловлена факторами, которые ранее не всегда принимались во внимание, такими как различные сроки восстановления слизистой оболочки тонкой кишки. Характерная гистологическая картина – атрофия ворсинок двенадцатиперстной и тощей кишки – нормализуется после того, как пациенты переводятся на безглютеновую диету. Однако, согласно данным литературы, сроки репарации и восстановления функций слизистой оболочки весьма индивидуальны и могут существенно различаться. По данным морфологов, стойкую атрофию ворсинок можно наблюдать даже в случае нормализации уровней серологических маркеров [23].
На сегодняшний день в литературе существуют различные мнения относительно взаимосвязи гиповитаминоза D и повышенного риска переломов костей. Так, среди взрослого населения имеются данные, позволяющие связать дефицит витамина D с повышенным риском переломов, в то время как для детей прогностического алгоритма, позволяющего оценить такую взаимосвязь на сегодняшний день, не существует. Кроме того, остается открытым вопрос, существует ли связь между низким уровнем витамина D и тем, почему у некоторых детей переломы возникают в результате незначительной травмы, в то время как у других этого не происходит. Низкий уровень витамина D приводит к отрицательному балансу кальция, повышению секреции паратиреоидного гормона, тем самым усиливая резорбцию костной ткани. Физиологическим следствием этих процессов является снижение минеральной плотности костной ткани, при этом риск переломов костей возрастает [24]. Однако исследования, направленные на изучение корреляции между уровнем 25(ОН)D в сыворотке крови и повышенным риском развития переломов, имеют неоднозначный характер: некоторые данные демонстрируют заметную связь, а другие такую взаимосвязь опровергают [25, 26]. A. Herdea et al. в своем исследовании продемонстрировали, что у 75% детей с переломами в анамнезе уровень витамина D в сыворотке был ниже нормы. При этом вероятность возникновения как спонтанных, так и индуцированных переломов костей у детей с дефицитом и недостаточностью витамина D в два раза выше, чем у детей с его нормальными показателями. Наименьшая частота переломов была зарегистрирована у пациентов с уровнем 25(ОН)D более 40 нг/мл, что позволяет считать данные значения протективными в отношении развития остеопенических состояний [26].
Оценить процессы костного метаболизма, а также дать характеристику эффективности процессов костного ремоделирования на сегодняшний день стало возможным благодаря широкому внедрению в практику и лабораторную диагностику определения маркеров костного метаболизма. Наиболее информативным маркером является остеокальцин – белок костного матрикса неколлагеновой природы, отражающий активность процесса остеосинтеза. Его уровень, начиная активно нарастать уже в раннем детском возрасте, достигает своих максимальных значений в пубертатный период [27]. Наиболее информативными маркерами остеорезорбции являются С- и N-концевые телопептиды, представляющие собой продукты деградации коллагена I типа.
Определение уровней маркеров костного метаболизма, а также уровня 25(ОН)D в плазме крови может иметь прогностическое значение для оценки риска развития остеопенических состояний, а следовательно, и развития спонтанных переломов у детей и подростков с целиакией [27, 28].
Цель исследования: сопоставить клинико-анамнестические, антропометрические и лабораторные показатели у детей и подростков с целиакией с переломами и без переломов костей.
Материалы и методы
В исследование включен 151 ребенок с целиакией в возрасте от 1 до 17 лет (медиана возраста 7,6 (4,8; 11,5) лет), находившихся на стационарном лечении в гастроэнтерологическом отделении ДГКБ им. Г.К. Филиппского г. Ставрополя в период с 2001 по 2020 г., среди которых 67 (44,4%) мальчиков и 84 (55,6%) девочки. Всем пациентам диагноз целиакии был установлен в соответствии с клиническими, серологическими и морфологическими критериями ESPGHAN (1990, 2012, 2019 гг.).
Пациенты были разделены на две группы в зависимости от наличия или отсутствия переломов костей в анамнезе. Первую группу составил 21 ребенок (13,9%), имевший переломы в течение жизни, из которых было 14 (66,6%) мальчиков и 7 (33,4%) девочек. Среди пациентов этой группы в активном периоде заболевания было обследовано 8 (38,1%) человек и 13 (61,9%) детей после верификации диагноза.
Во вторую группу (группу сравнения) было включено 130 (86,1%) детей с целиакией, не имевших переломов костей в анамнезе, из которых было 54 (41,5%) мальчика и 76 (58,5%) девочек. Из них в остром периоде заболевания было обследовано 45 (34,6%) человек, 60 (46,2%) детей, соблюдающих безглютеновую диету (продолжительность диеты в среднем 5,3 ± 0,5 года), и 25 (19,2%), не придерживающихся безглютеновой диеты в среднем на протяжении 4,1 ± 0,7 года.
Контрольную группу составили 32 здоровых ребенка, из которых было 14 (43,8%) мальчиков и 18 (56,2%) девочек; средний возраст составил 8,1 ± 0,4 года.
Всем пациентам было проведено антропометрическое обследование, которое включало в себя определение длины и массы тела. Анализ полученных данных проводился с использованием компьютерной программы ВОЗ AnthroPlus. Был проведен расчет отклонения длины тела относительно возраста (SDS длины тела), а также массы тела относительно длины тела (SDS массы тела) и SDS ИМТ. При оценке длины тела данные в пределах ± 1,0 SDS расценивались как вариант нормы, колебания от -1,0 SDS до -2,0 SDS – как задержка роста ниже среднего, а при отставании длины тела на 2,0 SDS и более – как низкорослость. Дефицит массы тела рассчитывался в процентах от долженствующей массы, соответствующей росту.
У всех обследованных пациентов иммуноферментным методом было проведено определение уровней кальцидиола (25(ОН)D3), паратиреоидного гормона, а также маркеров костного метаболизма (остеокальцин, С-концевой телопептид) в сыворотке крови.
Статистическая обработка результатов проводилась с помощью пакета программ AtteStat (IBM SPSS Statistics 24) с использованием параметрических и непараметрических методов. Для оценки количественных показателей на предмет соответствия нормальному распределению использовали критерий Шапиро – Уилка. Так как все распределения были ненормальными, показатели представлены в виде медианы (Me) 1-го и 3-го квартиля (1Q и 3Q). Для сравнения независимых совокупностей использовался U-критерий Манна – Уитни. Качественные данные представлены с указанием абсолютных и относительных (%) значений. Сравнение номинальных данных проводилось при помощи критерия (χ2) Пирсона. Различия считались статистически достоверными при р < 0,05.
Результаты
Cредний возраст диагностики целиакии в группе детей, не имевших переломы костей в анамнезе, ниже – 4,2 ± 0,3 лет, чем в группе детей, имевших переломы в течение жизни, – 5,6 ± 1,1 лет, что может свидетельствовать о прогрессировании процессов нарушения минеральной плотности костной ткани и увеличении риска развития переломов на фоне поздней диагностики целиакии.
Общая частота переломов у обследованных нами детей составила 13,9%, при этом отмечено, что переломы верхних конечностей встречались у 17 (81,0%) детей, переломы нижних конечностей – у 4 (19,0%) пациентов. Вполне закономерно, что в 2,5 раза чаще переломы регистрировались у мальчиков – у 14 (20,9%) по сравнению с 7 (8,3%) девочками (p = 0,03).
Медиана возраста возникновения переломов у мальчиков составила 7,5 (4,6; 9,3) лет, а у девочек – 7,0 (5,5; 7,0) лет. У 9 пациентов переломы были зарегистрированы в среднем за 3,6 ± 0,9 (4,5 (0,5–5,0)) года до постановки диагноза, а у 12 детей в среднем через 5,0 ± 1,2 (3,7 (1,2–5,4)) лет после диагностики целиакии, при этом у 1 ребенка отмечалось наличие двух переломов в анамнезе. В течение первого года от начала соблюдения безглютеновой диеты переломы были зарегистрированы у 3 (14,3%) детей, из них у 2 пациентов были отмечены переломы в течение первых 6 мес., что, вероятно, отражает характер процессов костной минерализации в активном периоде целиакии.
Медиана возраста детей, у которых переломы костей возникли до постановки диагноза, составила 7,0 (5,0; 10,0) лет, медиана возраста перелома на фоне соблюдения диеты – 8,5 (6,25–9,5) лет. Медиана продолжительности соблюдения безглютеновой диеты в группе детей, у которых отсутствовали переломы в анамнезе от момента постановки диагноза до момента обследования, составила 5,9 (3,7–7,3) лет.
В табл. 1 приведена частота клинических симптомов целиакии у детей и подростков в зависимости от наличия/отсутствия переломов в анамнезе.
Таблица 1. Частота клинических симптомов целиакии у детей и подростков в зависимости от наличия или отсутствия переломов в анамнезе
| Клинические симптомы целиакии | Пациенты с целиакией | Достоверность различий (р) | ||
| С переломами в анамнезе n = 21 | Без переломов в анамнезе n = 130 | |||
| «Большие» симптомы целиакии | ||||
|
диарея |
10 (47,6%) | 63 (48,5%) | 0,943 | |
|
вздутие и увеличение размеров живота |
14 (66,7%) | 82 (63,1%) | 0,752 | |
|
рецидивирующие боли в животе |
12 (57,1%) | 94 (72,3%) | 0,159 | |
|
рвота |
6 (28,6%) | 54 (41,5%) | 0,623 | |
|
нарушение аппетита |
13 (61,9%) | 107 (82,3%) | 0,032 | |
|
раздражительность, агрессивность |
5 (23,8%) | 40 (30,8%) | 0,518 | |
|
дефицит массы тела |
4 (19,0%) | 31 (23,8%) | 0,629 | |
|
задержка роста |
2 (9,5%) | 23 (17,7%) | 0,351 | |
| «Малые» симптомы целиакии | ||||
|
боли в костях/ногах |
1 (4,8%) | 11 (8,5%) | 0,561 | |
|
кариес |
9 (42,9%) | 39 (30%) | 0,241 | |
|
головные боли |
3 (14,3%) | 6 (4,6%) | 0,083 | |
|
беспокойный сон |
3 (14,3%) | 25 (19,2%) | 0,589 | |
|
запоры |
1 (4,8%) | 11 (8,5%) | 0,561 | |
|
кожные высыпания |
7 (33,3%) | 28 (21,5%) | 0,235 | |
Сравнительный анализ продемонстрировал отсутствие статистически значимых различий в клинической картине заболевания у детей с переломами костей и без таковых.
В группе детей без переломов в 1,3 раза чаще отмечалась жалоба на снижение аппетита (р = 0,032). Очевидно, что предполагать повышенный риск остеопении у пациентов с целиакией, ориентируясь на гастроинтестинальные жалобы, на частоту кариеса и боли в костях и суставах, невозможно. Исходя из этого, оценка риска нарушений формирования костной ткани и/или ее повышенной резорбции потребовала анализа лабораторных показателей, отражающих регуляцию фосфорно-кальциевого гомеостаза (уровень 25(ОН)D и паратгормона в сыворотке крови) и маркеров костного метаболизма (остеокальцин, С-концевой телопептид).
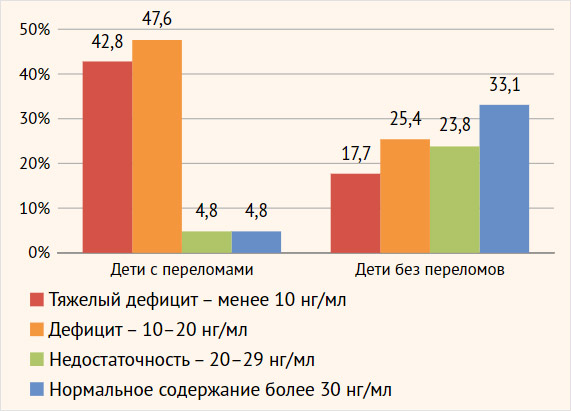
В группе детей с наличием переломов костей в анамнезе уровень витамина D ниже порогового был выявлен у 20 (95,2%) из 21 человека, при этом тяжелый дефицит (25(ОН)D менее 10 нг/мл) отмечался у 9 (42,8%) пациентов, дефицит зарегистрирован у 10 (47,6%), а недостаточность – у 1 (4,8%) ребенка соответственно. Уровень витамина D, соответствующий нормальному значению (30 нг/мл и более), был выявлен только у 1 (4,8%) ребенка. Оптимальный уровень кальцидиола у детей, не имевших переломов, отмечался гораздо чаще – в 43 (33,1%) случаях, дефицит диагностирован у 33 (25,4%), тяжелый дефицит был выявлен у 23 (17,7%) человек, а недостаточность – у 31 (23,8%) ребенка (рис. 2).
Рисунок 2. Обеспеченность витамином D детей с целиакией в зависимости от наличия или отсутствия переломов в анамнезе
Медиана кальцидиола в сыворотке крови у пациентов с целиакией без переломов в анамнезе составила 21,9 (12,8; 33,9) нг/мл, что в 1,7 раза ниже, чем в группе здоровых детей, – 36,5 (27,7; 43,2) нг/мл (р < 0,05), а уровень 25(ОН)D в группе детей с переломами еще в 2 раза ниже, чем у больных с целиакией без переломов (р < 0,05), и в 3,3 раза ниже, чем в контрольной группе (р < 0,001) (рис. 3).
Рисунок 3. Медиана 25(ОН)D у пациентов с целиакией и у здоровых детей
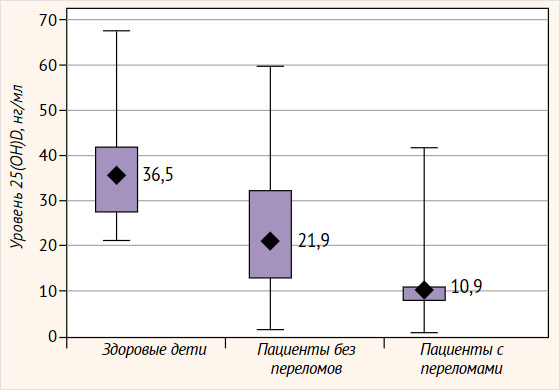
Обеспеченность витамином D внутри группы детей с целиакией неоднородна: пациенты с переломами демонстрируют статистически значимо более низкие показатели, чем пациенты без переломов. Очевидно, что низкий уровень витамина D ассоциирован с развитием остеопенических состояний и, по-видимому, повышает риск развития спонтанных переломов у детей и подростков с целиакией.
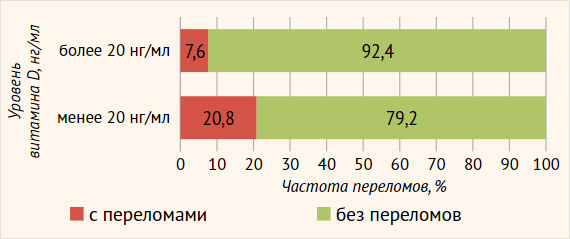
У детей с дефицитом витамина D (25(ОН)D менее 20 нг/мл) переломы регистрировались в 2,7 раза чаще, чем у детей с уровнем витамина D более 20 нг/мл, – 20,8 и 7,6% соответственно (р = 0,019) (рис. 4).
Рисунок 4. Частота переломов у детей с целиакией в зависимости от уровня витамина D
Сравнительный анализ показателей костного метаболизма здоровых детей (контрольная группа) с пациентами без переломов, обследованных в активном периоде целиакии – 45 (34,6%), с данными детей, имевших переломы до верификации диагноза – 8 (38,1%), представлен в табл. 2.
Таблица 2. Показатели 25(ОН)D, паратиреоидного гормона (ПТГ) и маркеров костного метаболизма у пациентов с целиакией в активном периоде заболевания
| Лабораторные показатели | Контрольная группа, n = 32 | Пациенты с целиакией в момент верификации диагноза, n (%) | Достоверность различий | |||
| С переломами в анамнезе, n = 8 | Без переломов в анамнезе, n = 45 | р1 | р2 | р3 | ||
|
25(ОН)D, нг/мл |
36,5 [27,7; 43,2] | 14,9 [11,1; 19,6] | 20,1 [10,9; 30,0] | <0,001 | <0,001 | <0,001 |
|
ОСК, нг/мл |
63,4 [51,6; 79,7] | 34,2 [26,9; 56,2] | 41,6 [27,0; 59,3] |
<0,001 |
0,008 | 0,03 |
|
С-КТП, пг/мл |
24,6 [12,3; 33,7] | 168,0 [30,4; 168,0] | 57,8 [41,5; 90,4] | <0,001 | <0,001 | 0,03 |
|
ПТГ, пг/мл |
17,4 [14,3; 20,1] | 76,1 [33,1; 88,2] | 25,8 [17,0; 34,9] | <0,01 |
<0,001 |
0,14 |
Примечание: р1 – достоверность различий между показателями у детей контрольной группы и пациентами с переломами; р2 -достоверность различий между показателями у детей контрольной группы и пациентами без переломов; р3 – достоверность различий между показателями у пациентов с переломами и без переломов.
Уровень 25(ОН)D в группе детей, имеющих переломы в анамнезе, в 1,3 раза ниже, чем у пациентов в остром периоде целиакии без переломов (p < 0,001), и в 2,4 раза ниже по сравнению с детьми из контрольной группы (p < 0,001). В то же время у детей без переломов показатель остеокальцина в 1,2 раза выше (р = 0,03), а уровень С-концевого телопептида в 2,9 раза ниже, чем у детей с переломами в анамнезе (р = 0,03). Уровень паратиреоидного гормона у детей без переломов в 2,9 раза ниже, чем у детей с переломами до постановки диагноза (p = 0,14). В активном периоде целиакии вторичный гиперпаратиреоз (уровень ПТГ выше 70 пг/мл) выявлен у 5 (62,5%) из 8 пациентов, имеющих переломы в анамнезе, и у 2 (4,4%) из 45 детей без переломов (p < 0,001).
В табл. 3 представлены данные сравнительного анализа маркеров костного метаболизма у пациентов с целиакией, обследованных на фоне соблюдения безглютеновой диеты, из которых 13 (61,9%) человек имели переломы костей в анамнезе и 60 (46,2%) не имели таковых, с лабораторными данными детей из контрольной группы.
Таблица 3. Показатели 25(ОН)D, паратиреоидного гормона (ПТГ) и костного метаболизма пациентов с целиакией, обследованных на фоне безглютеновой диеты
| Лабораторные показатели | Контрольная группа, n = 32 | Пациенты с целиакией после верификации диагноза | Достоверность различий | |||
| с переломами костей, n = 13 | без переломов костей, n = 60 | р1 | р2 | р3 | ||
|
25(ОН)D, нг/мл |
36,5 [27,7; 43,2] | 13,3 [7,9; 18,0] | 27,9 [17,8; 37,8] | <0,001 | 0,001 | 0,001 |
|
ОСК, нг/мл |
63,4 [51,6; 79,7] | 25,7 [15,4; 27,5] | 39,1 [30,2; 67,7] |
<0,001 |
0,09 |
<0,001 |
|
С-КТП, пг/мл |
24,6 [12,3; 33,7] | 106,6 [66,2; 115,7] | 50,6 [19,2; 99,2] | 0,0005 | <0,001 | 0,131 |
|
ПТГ, пг/мл |
17,4 [14,3; 20,1] | 31,1 [24,8; 45,9] | 19,2 [16,6; 31,9] | 0,008 | 0,06 | 0,480 |
Примечание. р1 – достоверность различий между показателями у детей контрольной группы и пациентами с переломами после постановки диагноза; р2 – достоверность различий между показателями у детей контрольной группы и пациентами без переломов, соблюдающих БГД; р3 – достоверность различий между показателями у пациентов с переломами после постановки диагноза и без переломов, соблюдающих БГД.
Уровень витамина D в группе детей с переломами в анамнезе на фоне соблюдения безглютеновой диеты в 2,1 раза ниже, чем у детей без переломов (р = 0,001), и в 2,7 раза ниже, чем у пациентов контрольной группы (p < 0,001). Показатель остеокальцина у детей с переломами после постановки диагноза в 1,5 раза ниже (р < 0,001), чем у детей без переломов, находящихся на диете, а уровень С-концевого телопептида у них в 2,1 раза выше (р = 0,13). Кроме того, в группе детей, имеющих переломы на фоне соблюдения безглютеновой диеты, отмечен более высокий уровень паратиреоидного гормона, в 1,6 раза превышающий таковой у детей без переломов после постановки диагноза (р = 0,480). Уровень ПТГ выше 70 пг/мл зафиксирован лишь у 1 (7,7%) ребенка с переломами в анамнезе на фоне соблюдения безглютеновой диеты; в группе детей без переломов после начала адекватной терапии заболевания вторичный гиперпаратиреоз выявлен у 2 (3,3%) пациентов (р = 0,473).
Сравнительный анализ показателей костного метаболизма демонстрирует преобладание процессов остеорезорбции над остеосинтезом, в т. ч. вследствие гормональных изменений (повышенной концентрации ПТГ и более выраженного дефицита витамина D), у детей с переломами в анамнезе в сравнении с пациентами с целиакией, не имевшими переломов в течение жизни. Кроме того, дети с переломами значительно хуже обеспечены витамином D, чем пациенты без переломов в анамнезе, что позволяет рассматривать дефицит 25(ОН)D как один из факторов риска формирования остеопенических состояний, в т. ч. спонтанных и индуцированных переломов трубчатых костей, у детей и подростков с целиакией. При строгом соблюдении безглютеновой диеты показатели маркеров остеорезорбции несколько снижаются, приближаясь к уровню здоровых детей. Так, у детей с переломами в анамнезе в активном периоде целиакии уровень С-концевого телопептида в 1,6 раза выше, чем в этой же группе детей после установки диагноза и перевода на безглютеновую диету (р = 0,04), а уровень ПТГ у детей с переломами на фоне соблюдения безглютеновой диеты в 2,4 раза ниже, чем до верификации диагноза (р = 0,04).
Проведен анализ антропометрических показателей у пациентов в активном периоде целиакии (8 (38,1%) детей с переломами в анамнезе и 45 (34,6%) без переломов) (табл. 4).
Таблица 4. Показатели физического развития пациентов с целиакией в активном периоде заболевания
| Показатели физического развития | Пациенты в активном периоде целиакии, n (%) | ||
| с переломами до постановки диагноза, n = 8 | без переломов до постановки диагноза, n = 45 | р | |
|
Рост больше +1,0 SDS |
1 (12,5%) | 4 (8,9%) | 0,748 |
|
Рост от -1,0 SDS до +1,0 SDS |
4 (50,0%) | 19 (42,2%) | 0,683 |
|
Рост от -1,0 SDS до -2,0 SDS (низкорослость) |
1 (12,5%) | 16 (35,6%) | 0,198 |
|
Отставание роста более чем на -2,0 SDS (нанизм) |
2 (25,0%) | 6 (13,3%) | 0,396 |
|
Среднее отклонение длины тела, M ± m, SDS |
-0,9 ± 0,5 | -0,7 ± 0,2 | 0,711 |
|
Масса тела больше +1,0 SDS |
- | - | - |
|
Масса тела от -1,0 SDS до +1,0 SDS |
- | 16 (35,6%) | - |
|
Масса тела от -1,0 SDS до -2,0 SDS |
4 (50,0%) | 20 (44,4%) | 0,772 |
|
Отставание массы более чем на -2,0 SDS |
4 (50,0%) | 9 (20,0%) | 0,07 |
|
Среднее отклонение массы тела, M ± m, SDS |
-1,8 ± 0,2 | -1,1 ± 0,2 | 0,02 |
Среднее отклонение длины тела у детей с переломами в анамнезе, обследованных в активном периоде целиакии, в 1,3 раза ниже, чем у пациентов без переломов (р = 0,711). При этом доля детей с нанизмом (отставание роста более чем на 2,0 SDS) среди имеющих переломы составила 25%, что в 1,9 раза выше, чем у детей без переломов (р = 0,396).
Среднее отклонение массы тела в группе детей без переломов в активном периоде целиакии составило -1,1 ± 0,2 SDS, превышая данный показатель у детей с переломами в 1,6 раза (р = 0,02). Выраженный дефицит массы тела (отставание более массы более чем на -2,0 SDS) в 2,5 раза чаще регистрировался у пациентов с переломами в анамнезе (р = 0,07).
В табл. 5 представлены данные сравнительного анализа показателей физического развития пациентов с целиакией, находящихся на безглютеновой диете, в зависимости от наличия/отсутствия переломов костей в анамнезе.
Таблица 5. Показатели физического развития пациентов с целиакией на фоне соблюдения безглютеновой диеты
| Показатели физического развития | Пациенты с целиакией на фоне безглютеновой диеты, n (%) | ||
| с переломами костей, n = 13 | без переломов костей, n = 60 | р | |
|
Рост больше +1,0 SDS |
- | 8 (13,3%) | - |
|
Рост от -1,0 SDS до +1,0 SDS |
11 (84,6%) | 22 (36,7%) | 0,002 |
|
Рост от -1,0 SDS до -2,0 SDS (низкорослость) |
2 (15,4%) | 19 (31,7%) | 0,240 |
|
Отставание роста более чем на -2,0 SDS (нанизм) |
- | 11 (18,3%) | - |
|
Среднее отклонение длины тела, M ± m, SDS |
-0,3 ± 0,2 | -0,9 ± 0,2 | 0,04 |
|
Масса тела больше +1,0 SDS |
- | 5 (8,3%) | - |
|
Масса тела от -1,0 SDS до +1,0 SDS |
8 (61,5%) | 20 (33,3%) | 0,05 |
|
Масса тела от -1,0 SDS до -2,0 SDS |
4 (30,8%) | 21 (35,1%) | 0,771 |
|
Отставание массы более чем на -2,0 SDS |
1 (7,7%) | 14 (23,3%) | 0,206 |
|
Среднее отклонение массы тела, M ± m, SDS |
-0,6 ± 0,3 | -1,2 ± 0,2 | 0,1 |
Cоблюдение безглютеновой диеты благоприятно влияет на антропометрические показатели обследованных детей. Так, на фоне соблюдения безглютеновой диеты среднее отклонение длины тела у детей с переломами в анамнезе в 3 раза выше, чем у обследованных пациентов с переломами в активном периоде целиакии (р = 0,279). Кроме того, доля пациентов с нормальными показателями длины тела (от -1,0 SDS до +1,0 SDS) среди пациентов с переломами в анамнезе на фоне соблюдения безглютеновой диеты в 1,7 раза выше, чем до верификации диагноза (р = 0,09), а пациентов с нанизмом в группе детей с переломами на фоне адекватного лечения не выявлено. Среднее отклонение массы тела у детей с переломами в активном периоде целиакии в 3 раза ниже, чем у детей с переломами на фоне безглютеновой диеты (р = 0,003), при этом снижение массы тела более чем на -2,0 SDS выявлено лишь у 1 (7,7%) из 13 детей с переломами в анамнезе, соблюдающих безглютеновую диету по сравнению с 4 (50,0%) детьми, обследованными до верификации диагноза (р = 0,02). Также на фоне соблюдения аглиадиновой диеты в группе детей с переломами в анамнезе увеличилась доля пациентов с нормальными показателями массы тела (от -1,0 SDS до +1,0 SDS) – 8 (61,5%). Таким образом, при строгом соблюдении безглютеновой диеты антропометрические показатели детей с нарушениями минерализации костной ткани при целиакии закономерно приближаются к показателям физического развития здоровых детей.
Обсуждение
Согласно данным ряда исследований, связь целиакии с нарушением процессов минерализации костной ткани, а также с повышенным риском формирования остеопенических состояний не вызывает сомнений: так, 9 перекрестных исследований продемонстрировали повышенный риск переломов костей у детей с целиакией (95% случаев) в сравнении со здоровыми детьми [8, 22]. Снижение минеральной плотности костной ткани может быть обнаружено более чем у 50% пациентов в активном периоде целиакии при отсутствии адекватного лечения, в то время как при соблюдении безглютеновой диеты доля детей с остеопеническими состояниями снижается до 30–40%. Однако, по мнению ряда исследователей, риск переломов не всегда ограничен преддиагностическим периодом и может сохраняться в течение многих лет после верификации диагноза [23, 29].
Дети и подростки с целиакией в любом возрасте формируют группу риска по витамин D- и кальций-дефицитным состояниям за счет мальабсорбции этих нутриентов в результате атрофических изменений в слизистой оболочке тонкой кишки и недостаточному их поступлению с пищей при соблюдении безглютеновой диеты [16]. Полинутриентная недостаточность, характерная для целиакии, способствует инициации процессов остеорезорбции, реализующихся благодаря значительной активации гормональных механизмов костного ремоделирования, в т. ч. компенсаторного повышения уровня паратиреоидного гормона с развитием в наиболее далеко зашедших случаях вторичного гиперпаратиреоза [17].
Наше исследование в детской популяции больных подтверждает, что переломы костей у детей и подростков с целиакией являются одним из достаточно распространенных внекишечных проявлений заболевания – за 20 лет наблюдений из 151 пациента они были выявлены у 21 (13,9%) ребенка. В зарубежной литературе подчеркивается, что высокий риск развития остеопенических состояний, в т. ч. и переломов трубчатых костей, в значительном количестве случаев ассоциирован с гендерной принадлежностью пациентов, наблюдаясь преимущественно у лиц мужского пола, что полностью согласуется с полученными нами данными: в 2,5 раза чаще переломы регистрировались у мальчиков – у 14 (20,9%) по сравнению с 7 (8,3%) девочками (p = 0,03) [29].
Дефицит 25(ОН)D в сыворотке крови, характерный для детей и подростков с целиакией в целом, в наибольшей степени выражен у пациентов с переломами трубчатых костей в анамнезе. Однако в литературе на сегодняшний день существуют противоположные мнения относительно взаимосвязи низкого уровня витамина D и повышенного риска формирования переломов костей: некоторые данные демонстрируют заметную связь, а другие такую взаимосвязь опровергают [25, 26]. Согласно данным нашего исследования, у 20 (95,2%) из 21 ребенка с целиакией, имеющих переломы в анамнезе, уровень 25(ОН)D был ниже порогового значения, при этом тяжелый дефицит был выявлен у 42,8% пациентов. У детей с дефицитом витамина D переломы были зарегистрированы в 2,7 раза чаще, чем у детей с его нормальной обеспеченностью.
Анализ показателей маркеров костного метаболизма у обследованных нами пациентов демонстрирует преобладание у детей с переломами в анамнезе процессов остеорезорбции над остеосинтезом: уровень остеокальцина у них достоверно ниже, а показатели С-концевого телопептида и ПТГ значительно выше, чем у пациентов с целиакией без переломов в анамнезе, что также не противоречит зарубежным исследованиям [27, 28].
Дотация препаратами холекальциферола способствует нормализации уровня 25(ОН)D, уменьшая интенсивность остеомаляции за счет снижения активности паратиреоидного гормона, статистически значимо повышая уровень остеокальцина и снижая уровень С-концевых телопептидов коллагена I типа.
Таким образом, поддержание оптимального уровня 25(ОН)D в сыворотке крови и мониторинг биохимических маркеров костного метаболизма у пациентов с целиакией могут иметь высокое прогностическое значение для оценки темпов формирования и резорбции кости. Динамическая оценка маркеров костного метаболизма позволяет с высокой степенью эффективности диагностировать остеопенические состояния у детей и подростков с целиакией на ранних этапах, предупреждая такие серьезные осложнения, как патологические переломы.
Выводы
1. Частота переломов в группе пациентов с целиакией составила 13,9%, при этом в 2,5 раза чаще переломы регистрировались у мальчиков: у 14 (20,9%) по сравнению с 7 (8,3%) девочками (p = 0,03).
2. Отсутствие различий в частоте клинических признаков целиакии у детей в зависимости от наличия переломов в анамнезе подтверждает необходимость анализа лабораторных показателей, отражающих регуляцию фосфорно-кальциевого гомеостаза и маркеров костного метаболизма для оценки риска формирования остеопенических состояний.
3. Пациенты с переломами костей в анамнезе демонстрируют статистически значимо более низкие показатели обеспеченности 25(ОН)D, чем дети без переломов. Частота переломов у детей с дефицитом витамина D (менее 20 нг/мл) в 2,7 раза выше, чем у пациентов с уровнем выше 20 нг/мл.
4. У детей и подростков с целиакией с переломами трубчатых
костей процессы остеорезорбции преобладают над остеосинтезом, о чем
свидетельствуют статистически значимо низкие показатели остеокальцина, высокие
уровни С-концевого телопептида и ПТГ.
Список литературы / References
- Рославцева Е.А., Дмитриева Ю.А., Захарова И.Н., Боровик Т.Э., Потапов А.С., Сурков А.Н. и др. Целиакия у детей: проект клинических рекомендаций. Экспериментальная и клиническая гастроэнтерология. 2021;188(4):199-227. https://doi.org/10.31146/1682-8658-ecg-188-4-199-227.
- Husby S., Koletzko S., Korponay-Szabo I., Kurppa K., Mearin M.L., Ribes-Koninckx C. et al. European Society Paediatric Gastroenterology, Hepatology and Nutrition Guidelines for Diagnosing Coeliac Disease 2020. J Pediatr Gastroenterol Nutr. 2020;70(1):141-156. https://doi.org/10.1097/MPG.0000000000002497.
- Caio G., Volta U., Sapone A., Leffler D.A., De Giorgio R., Catassi C. et al. Celiac disease: A comprehensive current review. BMC Med. 2019;17:142-150. https://doi.org/10.1186/s12916-019-1380-z.
- Lebwohl B., MicF^lsson K., Green P., Ludvigsson J.F. Persistent mucosal damage and risk of fracture in celiac disease. J Clin Endocrinol Metab. 2014;99(2):609-615. https://doi.org/10.1210/jc.2013-3164.
- Бессонов А.А., Крюкова Н.А., Мухараева Е.М., Скворцов В.В. Целиакия в практике гастроэнтеролога. Экспериментальная и клиническая гастроэнтерология. 2019;167(7):4-9. https://doi.org/10.31146/1682-8658-ecg-167-7-4-9.
- Бельмер С.В., Ревнова М.О. Клинические проявления целиакии: на пути к ранней диагностике. Экспериментальная и клиническая гастроэнтерология. 2021;188(4):106-115. https://doi.org/10.31146/1682-8658-ecg-188-4-106-115.
- Быкова С.В., Парфенов А.И., Сабельникова Е.А. Эпидемиология целиакии в мире. Альманах клинической медицины. 2018;46(1):23-31. https://doi.org/10.18786/2072-0505-2018-46-1-23-31.
- Климов Л.Я., Стоян М.В., Курьянинова В.А., Герасименко Е.С., Кашников В.С., Атанесян Р.А. и др. Диагностика целиакии в группах генетического риска: современный взгляд на проблему. Медицинский вестник Северного Кавказа. 2018;13(3):555-560. https://doi.org/10.14300/mnnc.2018.13104.
- Lindfors K., Ciacci C., Kurppa K., Lundin K.E.A., Govind K.M., Mearin L.M. et al. Coeliac disease. Nat Rev Dis Primers. 2019;3:1-10. https://doi.org/10.1038/s41572-018-0054-z.
- Belei O., Dobrescu A., Heredea R., Iacob E.R., David V., Marginean O. Histologic recovery among children with celiac disease on a gluten-free diet. A long-term follow-up single-center experience. Arch Med Sci AMS. 2018;14:94-98. https://doi.org/10.5114/aoms.2018.72241.
- Звягин А.А., Бавыкина И.А., Почивалов А.В., Вечеркин Д.В. Состояние минеральной плотности костной ткани у здоровых детей и больных на безглютеновой диете. Педиатрия. Журнал имени Г.Н. Сперанского. 2015;94(4):141-145. Режим доступа: https://www.elibrary.ru/item.asp?id=24237472.
- Климов Л.Я., Абрамская Л.М., Стоян М.В., Курьянинова В.А., Долбня С.В., Касьянова А.Н. и др. Гормонально-метаболические закономерности нарушения минерализации костной ткани у детей с целиакией. Медицинский совет. 2017;(1):149-154. https://doi.org/10.21518/2079-701X-2017-1-149-154.
- Nardecchia S., Auricchio R., Discepolo V., Troncone R. Extra-intestinal man-ifestations of coeliac disease in children: clinical features and mechanisms. Front Pediatr. 2019;7:1-9. https://doi.org/10.3389/fped.2019.00056.
- Di Nardo G., Villa M.P., Conti L., Ranucci G., Pacchiarotti C., Principessa L. et al. Nutritional deficiencies in children with celiac disease resulting from a gluten-free diet: a systematic review. Nutrients. 2019;11:1-12. https://doi.org/10.3390/nu11071588.
- Jin Oh H., Hei Ryu K., Joon Park B., Ho Yoon B. Osteoporosis and osteoporotic fractures in gastrointestinal disease. J Bone Metab. 2018;25(4):213-217. https://doi.org/10.11005/jbm.2018.25.4.213.
- Yang H.R. Updates on bone health in children with gastrointestinal diseases. Ann Pediatr Endocrinol Metab. 2020;25:10-14. https://doi.org/10.6065/apem.2020.25.1.10.
- Хавкин А.И., Новикова В.П., Вашура А.Ю., Ковтун Т.А. Ось микробиота-кость: современные представления о механизмах взаимодействия. Вопросы практической педиатрии. 2022;17(5):66-74. https://doi.org/10.20953/1817-7646-2022-5-66-74.
- Antonucci R., Locci C., Clemente M.G., Chicconi E., Antonucci L. Vitamin D deficiency in childhood: old lessons and current challenges. J Pediatr Endocrinol Metab. 2018;31(3):247-260. https://doi.org/10.1515/jpem-2017-0391.
- Bittker S.S. Elevated levels of 1,25-dihydroxyvitamin D in plasma as a missing risk factor for celiac disease. Clin Exp Gastroentero. 2020;13:1-15. https://doi.org/10.2147/CEG.S222353.
- Vici G., Camilletti D., Polzonetti V. Possible role of vitamin D in celiac disease onset. Nutrients. 2020;12:1-17. https://doi.org/10.3390/nu12041051.
- Costa F.D., Maia C., Almeida S., Ferreira R. Child with multiple fractures: a rare presentation of a common disease. BMJ Case Rep. 2017;2017:bcr2016218477. https://doi.org/10.1136/bcr-2016-218477.
- Duerksen D.R., Lix L.M., Johansson H., McCloskey E.V., Harvey N.C., Kanis J.A., Leslie W.D. Fracture risk assessment in celiac disease: A registry-based cohort study. PMC. 2021;32(1):93-99. https://doi.org/10.1007/s00198-020-05579-7.
- Malik A.A., Baig M., Butt N.S., Imran M., Alzahrani S.H., Gazzaz Z.J. Bibliometric analysis of global research productivity on vitamin D and bone metabolism (2001-2020): learn from the past to plan future. Nutruents. 2022;14:1-16. https://doi.org/10.3390/nu14030542.
- Hosseinzadeh P., Mohseni M., Minaie A., Kiebzak G.M. Vitamin D status in children with forearm fractures: incidence and risk factors. J Am Acad Orthop Surg Glob Res Rev. 2020;4(8):1-5. https://doi.org/10.5435/JAAOSGlobal-D-20-00150.
- Yang G., Lee W.Y.W., Hung A.L.H., Tang M.F., Li X., Kong A.P.S. Association of serum 25(OH)Vit-D levels with risk of pediatric fractures: a systematic review and meta-analysis. Osteoporos Int. 2021;32(7):1287-1300. https://doi.org/10.1007/s00198-020-05814-1.
- Herdea A., Ionescu. A., Dragomirescu M.C., Ulici A. Vitamin D - A risk factor for bone fractures in children: a population-based prospective case-control randomized cross-sectional study. Int J Environ Res Public Health. 2023;20:1-11. https://doi.org/10.3390/ijerph20043300.
- Bhattoa H.P. Laboratory aspects and clinical utility of bone turnover markers. EJIFCC. 2018;29(2):117-128. Available at: https://pubmed.ncbi.nlm.nih.gov/30050395.
- Greenblatt M.B., Tsai J.N., Wein M.N. Bone Turnover Markers in the diagnosis and monitoring of metabolic bone disease. Clin Chem. 2017;63(2):464-474. https://doi.org/10.1373/clinchem.2016.259085.
- Zanchetta М.В., Longobardi V., Costa F., Longarini G., Mazure R.M., Moreno M.L. et al. Impaired bone microarchitecture improves after one year on gluten-free diet: a prospective longitudinal HRpQCT study in women with celiac disease. J Bone Miner Res. 2017;32(1):135-142. https://doi.org/10.1002/jbmr.2922.








