
Журнал "Медицинский совет" №1/2024
DOI: 10.21518/ms2023-494
А.Е. Кучина1*, И.Н. Захарова1, В.Е. Одинцова2, И.Н. Холодова1, А.Д. Козлова3, Ф.А. Кошкин4
1 Российская медицинская академия непрерывного профессионального образования; 125993, Россия, Москва, ул. Баррикадная, д. 2/1, стр. 1
2 Atlas Biomed Group –
ООО «Кномикс»; 123423, Россия, Москва, ул. Народного Ополчения, д. 34, стр. 1, пом. 1/1
3 Курчатовский геномный центр НИЦ «Курчатовский институт»; 123098, Россия, Москва, пл.
Академика Курчатова, д. 1
4 ТОО «Геномед»; 050022, Республика Казахстан, Алматы, ул.
Кашгарская, д. 69
Введение. Грудное молоко матери – лучшее питание для ребенка и, как ни парадоксально, единственный продукт младенческого рациона, состав которого нам до сих пор не полностью известен. Данная статья посвящена результатам впервые проведенного в Российской Федерации исследования микробиоты грудного молока.
Цель. Изучить состав микробиоты грудного молока здоровых женщин, проживающих в Российской Федерации, и определить влияние различных факторов на его разнообразие.
Материалы и методы. Проведено молекулярно-генетическое исследование 56 образцов молозива и 12 образцов зрелого грудного молока от 56 здоровых доноров методом секвенирования бактериального фрагмента гена 16S рРНК.
Результаты. В выборке из 56 образцов молозива были идентифицированы 22 типа и 242 рода бактерий. У здоровых женщин с нормальным индексом массы тела, от физиологически протекаю щей беременности, не принимавших антибиотики, после естественных родов в срок наиболее многочисленными типами бактерий оказались Firmicutes, Proteobacteria, Actinobacteriota, на уровне родов были наиболее распространены Streptococcus, Staphylococcus и Gemella. Статистический анализ влияния национальной принадлежности, возраста, количества детей в семье и длительности госпитализации (PERMANOVA) не показал существенных различий в пропорциях бактерий в молозиве женщин (p > 0,05). Единственный фактор, который оказался значимым, – пол ребенка. У матерей девочек биоразнообразие молозива (индекс Шеннона) выше, чем у матерей мальчиков. Кроме того, микробиота зрелого грудного молока (спустя 1 мес. после родов) отличается более низким альфа-разнообразием по сравнению с молозивом.
Обсуждение. Проанализировав полученные нами результаты и отчеты зарубежных коллег, мы выявили существенные сходства и отличия, которые, безусловно, объясняются рядом причин, связанных с методологическими и географическими различиями, способом, сроком и даже временем суток сбора образцов грудного молока.
Заключение. В целом молозиво здоровых женщин имело достаточно стабильный бактериальный состав, а его богатое биоразнообразие в полной мере демонстрировало высокое качество первого микробного инокулята для кишечника новорожденного. Полученные нами результаты дают полное представление о здоровой микробиоте грудного молока женщин, проживающих в Российской Федерации, и могут использоваться в качестве нормативных показателей, а также для сравнения с аналогичными показателями у женщин других стран.
Благодарности. Авторы выражают благодарность компании Medela за помощь в проведении исследования
Для цитирования: Кучина А.Е., Захарова И.Н., Одинцова В.Е., Холодова И.Н., Козлова А.Д., Кошкин Ф.А. Микробиота грудного молока здоровых женщин, проживающих в Российской Федерации. Медицинский Совет. 2024;(1):7–18. https://doi.org/10.21518/ms2023-494
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Breast milk microbiota of healthy women living in the Russian Federation
Anastasiya E. Kuchina1, Irina N. Zakharova1, Vera E. Odintsova2, Irina N. Kholodova1, Aleksandra D. Kozlova3, Filipp A. Koshkin4
1 Russian Medical Academy of Continuous Professional Education; 2/1, Bldg. 1, Barrikadnaya St., Moscow, 125993, Russia
2 Atlas Biomed Group – Knomics LLC; 34, Bldg. 1, room 1/1, Narodnogo Opolchenia St., Moscow, 123423, Russia
3 Kurchatov Genome Center of the National Research Centre “Kurchatov Institute”; 1, Akademik Kurchatov Square, Moscow, 123098, Russia
4 Genomed LLP; 69, Kashgarskaya St., Almaty, 050022, Republic of Kazakhstan
Introduction. Mother’s breast milk is considered to be the best source of infant nutrition and, paradoxical as it may sound, the only product of the infant diet, which composition is still poorly known to us. This article presents the findings of a study on the breast milk microbiota conducted in the Russian Federation for the first time.
Aim. To study the composition of the breast milk microbiota of healthy women living in the Russian Federation and identify the impact of various factors on its diversity.
Materials and methods. A molecular genetic study on 56 colostrum samples and 12 mature breast milk samples from 56 healthy donors using a method based on sequencing of bacterial 16S rRNA gene was conducted.
Results. In a batch of 56 colostrum samples, 22 species and 242 genera of bacteria were identified. Firmicutes, Proteobacteria, Actinobacteriota were the most predominant species of bacteria in healthy women with a normal body mass index, from a physiological pregnancy, who did not take antibiotics, after natural delivery at term; Streptococcus, Staphylococcus and Gemella were the most predominant at the level of delivery. Statistical analysis of the impact of nationality, age, number of children in the family and duration of hospitalization (PERMANOVA) showed no significant differences in the proportions of bacteria in the colostrum of women (p > 0.05). The gender of the child was the only factor that turned out to be significant.
The biodiversity of colostrum of girl-delivered mothers were higher (Shannon index) than that of boy-delivered mothers. In addition, the mature breast milk microbiota (1 month after delivery) has lower alpha diversity as compared to colostrum.
Discussion. The analysis of our results and reports from foreign colleagues showed significant similarities and differences, which, certainly, were explained by a number of reasons related to methodological and geographical differences, the method, timing and even the time of day when breast milk samples were collected.
Conclusion. In general, the colostrum of healthy women had a fairly stable bacterial composition, and its rich biodiversity fully demonstrated high quality of the first microbial inoculum for the newborn intestine. Our results provide valuable insights into the healthy breast milk microbiota in women living in the Russian Federation and can be used as reference ranges, as well as for comparison with similar indicators in women from other countries.
Acknowledgments. The authors would like to thank the Medela Company for assistance in the study conducting.
For citation: Kuchina A.E., Zakharova I.N., Odintsova V.E., Kholodova I.N., Kozlova A.D., Koshkin F.A. Breast milk microbiota of healthy women living in the Russian Federation. Meditsinskiy sovet = Medical Council. 2024;(1):7–18. (In Russ.) https://doi.org/10.21518/ms2023-494
Conflict of interest: the authors declare no conflict of interest.
Введение
Грудное материнское молоко – идеальный образец персонализированного питания, удовлетворяющий индивидуальным потребностям ребенка по принципу «здесь и сейчас». Парадокс заключается в том, что, несмотря на внушительную доказательную базу бесспорных положительных эффектов, грудное молоко остается единственным продуктом из младенческого рациона, состав которого нам до сих пор полностью не известен. Непрерывно совершенствующиеся методы лабораторной диагностики приближают нас к расшифровке макро- и микронутриентной ценности грудного молока, но лишь в одной точке времени и пространства, оставляя в тени механизмы регуляции его изменчивости, о которых остается только догадываться [1, 2]. В ряде исследований продемонстрированы различия гормонального профиля и энергетической ценности грудного молока для мальчиков и девочек [3–6]; циркадный характер колебаний концентрации глюкокортикоидов в течение суток, влияющих на рост и активность ребенка [7]; различия профилей жирных и аминокислот в зависимости от стадии лактации, диеты матери, проживания в разных географических зонах, даже в пределах одной страны [8, 9] и др. Знаковым событием в эволюции наших знаний о составе грудного молока в начале XXI в. стало разрушение в 2003 г. мифов о его стерильности и присвоение материнскому молоку пробиотического статуса как источнику необходимых бактерий для становления кишечной микробиоты ребенка [10, 11].
За 20 лет плотного изучения этого вопроса можно проследить стремительную эволюцию методов идентификации бактерий от посева на питательные среды до полногеномного секвенирования. И подобно тому как приняты некие усредненные значения концентраций основных нутриентов в грудном молоке, сегодня предложена концепция коровьего бактериома, главные звенья которого представлены стрептококками и стафилококками в различных комбинациях с другими родами бактерий (Lactobacillus, Pseudomonas, Bifidobacterium, Corynebacterium, Enterococcus, Acinetobacter, Rothia, Gemella, Cutibacterium) [12]. Относительная численность, разнообразие и изменчивость бактериального пейзажа тестируются при разных вводных, включающих состояние здоровья матери и ребенка, прием антибиотиков и (или) пробиотиков, способ родоразрешения, географию проживания, диету матери, методы сбора/хранения молока и др. [12, 13]. На сегодняшний день доступны сведения о составе микробиоты грудного молока и (или) тканей молочных желез женщин из более чем 50 стран мира [12, 14]. В статье представлены результаты первого проведенного в России исследования.
Цель исследования – изучение микробиоты грудного молока здоровых женщин, проживающих в Российской Федерации, методом секвенирования бактериального фрагмента гена 16S рибосомальной РНК (рРНК) и определение степени влияния некоторых нормальных факторов, которые могли повлиять на качественный/количественный микробный потенциал грудного молока: национальность, возраст женщины, количество родов, пол ребенка, длительность госпитализации и стадию лактации.
Материалы и методы
Изучение микробиоты грудного молока было одобрено локальным этическим комитетом Российской медицинской академии непрерывного профессионального образования и проводилось в период с 28.10.2018 по 14.09.2020 г. на базе акушерского отделения Химкинской центральной клинической больницы.
Здоровым женщинам после срочных самостоятельных родов предлагалось участие в исследовании. Преждевременные роды, кесарево сечение, прием антибиотиков во время беременности, нахождение родильницы в обсервационной палате после родов, наличие тяжелой соматической патологии у матери и (или) новорожденного, требующей интенсивной или длительной терапии, а также матери детей с врожденными пороками развития составили критерии невключения.
Все женщины получили полную информацию об исследовании и подписали информированное добровольное согласие. Среди участниц были иностранные граждане. При наличии языкового барьера исследователь прибегал к помощи переводчика или родственника, владеющего родным и русским языками. С каждой женщиной, давшей согласие на участие, исследователь беседовал лично, анализировал данные обменной карты беременной, карты стационарного больного родильного отделения и карты новорожденного, где неонатолог указывал информацию о семейном анамнезе, течение беременности со слов матери.
Сбор молока. Сбор образцов проводился исследователем в стерильных перчатках в первые дни после родов (молозиво, n = 56) и через 1 мес. (зрелое грудное молоко, n = 12). Молозиво было собрано из одной молочной железы, противоположной той, из которой осуществлялось последнее кормление на 3-и сутки. Грудное молоко было собрано в стерильные одноразовые пластиковые контейнеры с закручивающейся крышкой (Medela) путем ручного сцеживания. Перед сбором грудную железу обтирали (обрабатывали) раствором хлоргексидина или фурацилина, осушали и удаляли первые несколько капель молока. Через 1 мес. после родов участницы, кормившие ребенка исключительно грудью, были приглашены на консультацию, в ходе которой был осуществлен сбор зрелого грудного молока ручным способом. После сбора образцы грудного молока замораживали при –23 °C и ниже и хранили до транспортировки в лабораторию, где образцы хранились при –80 °C до последующего анализа – выделения ДНК и секвенирования.
Пробоподготовка и секвенирование. Выделение тотальной бактериальной ДНК проводилось набором Milk Bacterial DNA Isolation Kit (Norgen) и последующим замером концентраций с использованием набора Qubit dsDNA HS (High Sensitivity) Assay Kit. Амплификация участков V3–V4 гена 16S рРНК производилась набором AmpliTaq Gold™ 360 DNA Polymerase (Termo Fisher Scientific) с использованием специфичных праймеров (прямой праймер 5’-TCGTCGGCAGCGTCAGATGTGTATAAGAGACAGCCTACGGGNGGCWG CAG-3’, обратный праймер 5’-GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAGGACTACHVGGGTAT CTAATCC-3’). Секвенирование проводилось на платформе Illumina.
Таксономический состав образцов. Анализ данных секвенирования был проведен с помощью платформы Кномикс-Биота [15]. В анализе с помощью программного пакета QIIME2 [16], был применен алгоритм очищения от шумоподобных последовательностей DADA [17], таксономическая принадлежность оставшихся уникальных последовательностей (ASV – amplicon sequence variants) определена с помощью сравнения с базой SILVA. Таблицы представленности на уровнях вида, рода, семейства и т. д. были получены путем суммирования ASV, принадлежащих соответствующей таксономической группе. На рисунках использованы короткие названия микробов без указания их полной таксономической принадлежности. В основном использовалась таблица состава на уровне рода, однако для некоторых иллюстраций – на уровне типа, в таких случаях к названию микроба приписано p_. У микробов, для которых не удалось определить таксономическую принадлежность к роду, указана их классификация на максимально низком уровне, а отсутствие классификации на более низких уровнях обозначено как -u. Из статистического анализа исключены образцы с низким покрытием (менее 2000 ридов на образец) и редкие и мало представленные микробы, т. е. те, которые были представлены менее чем в половине образцов и ни в одном образце не встречались в количестве более 10%.
Альфа-разнообразие характеризует разнообразие микробного сообщества внутри конкретного образца. Оно было оценено с помощью индекса Шеннона после пятикратного прореживания полученных таблиц представленности ASV (до фильтрации от редких и мало представленных микробов) до 1900 ридов, вычисления результатов и усреднения. Бета-разнообразие характеризует различие между двумя образцами микробиоты. Оно было оценено с помощью расстояния Эйтчисона по пропорциям превалирующих микробов (после исключения редких и мало представленных микробов).
Статистический анализ данных проводился в среде программирования R. Для всех сравнений был выбран порог значимости 0,05. Статистический анализ пропорций микробов проводился на уровне рода. Ассоциация пропорций с различными факторами проверялась с помощью метода PERMANOVA (функция adonis пакета vegan) по расстоянию Эйтчисона. Этот метод позволяет проверить, являются ли образцы со схожим значением фактора (например, из одной группы либо со схожим возрастом) более схожими по пропорциям микробов, чем образцы с различающимися значениями фактора (из разных групп, с различающимся возрастом). Поправка на множественное сравнение сделана с помощью метода Бенджамини – Хохберга.
Анализ связи факторов с наличием или отсутствием каждого микроба проводился с помощью точного критерия Фишера для сравнения несвязанных групп и критерия МакНемара для связанных групп (молоко – молозиво) и критерия Манна – Уитни для непрерывных факторов. Это сравнение проводилось с учетом всех найденных в образцах микробов вне зависимости от их частоты в популяции. Для того чтобы учесть влияние глубины секвенирования на точность детекции микробов, все данные были прорежены до 1900 ридов на образец. Анализ альфа-разнообразия был сделан с помощью непараметрических методов: сравнение групп проводилось с помощью критерия Манна – Уитни для несвязанных выборок, критерия Уилкоксона для связанных выборок (молоко – молозиво) и оценки значимости корреляции Спирмена для непрерывных факторов (возраст).
Результаты
Клинические характеристики участниц исследования приведены в табл. 1. Средний возраст составил 28,02 ± 5,86 года. Из них 47% были первородящими, 53% – повторнородящими. Все женщины родили в срок. 46% были русскими, 54% – представительницами другой национальности (киргизки, узбечки, таджички), приехавшими в Россию ради родов или проживающие на территории нашей страны в течение нескольких месяцев или лет и не имеющие гражданства. Все новорожденные имели нормальные массо-ростовые показатели и хорошую оценку по шкале Апгар (8–9 баллов), 54% из них были мальчиками и 46% – девочками.
Таблица 1. Клинические характеристики участниц исследования и их детей
| Показатель | Значение |
| Женщины (n = 56) | |
| Русские, n (%) | 26 (46%) |
| Другой национальности, n (%) | 30 (54%) |
| Возраст матери, M ± SD (min – max), лет | 28,02 ± 5,86 (17–42) |
| Индекс массы тела, M ± SD (min – max), кг/м2 | 21,4 ± 1,2 (18,13–24,99) |
| Первородящая, n (%) | 25 (47%) |
| Повторнородящая, n (%) | 31 (53%) |
| Койко-день стационара в день сбора молока, M ± SD (min – max), дни | 4,1 ± 1,4 (3–8) |
| Молозиво | 56 (100%) |
| Зрелое грудное молоко | 12 (21%) |
| Дети (n = 56) | |
| Мальчики, n (%) | 27 (48%) |
| Девочка, n (%) | 29 (52%) |
| Масса тела при рождении, M ± SD (min – max), кг | 3,43 ± 0,39 (2,46–4,33) |
| Длина тела при рождении, M ± SD (min – max), см | 51,95 ± 1,8 (48–56) |
В выборке из 56 образцов молозива были идентифицированы 22 типа и 242 рода бактерий. В анализ пропорций включены 40 видов микробов, которые встречались в половине образцов или хотя бы в одном образце и составляли более 10%. В среднем отобранные виды представляли до 96% прочтений, найденных в образцах (рис. 1).
А – столбчатая диаграмма состава образцов: каждый столбец относится к одному из образцов, цветом обозначена доля в нем каждого из 10 наиболее представленных родов; В – график «ящик с усами» для доли различных микробов в составе образцов.
Рисунок 1. Состав образцов молозива здоровых женщин
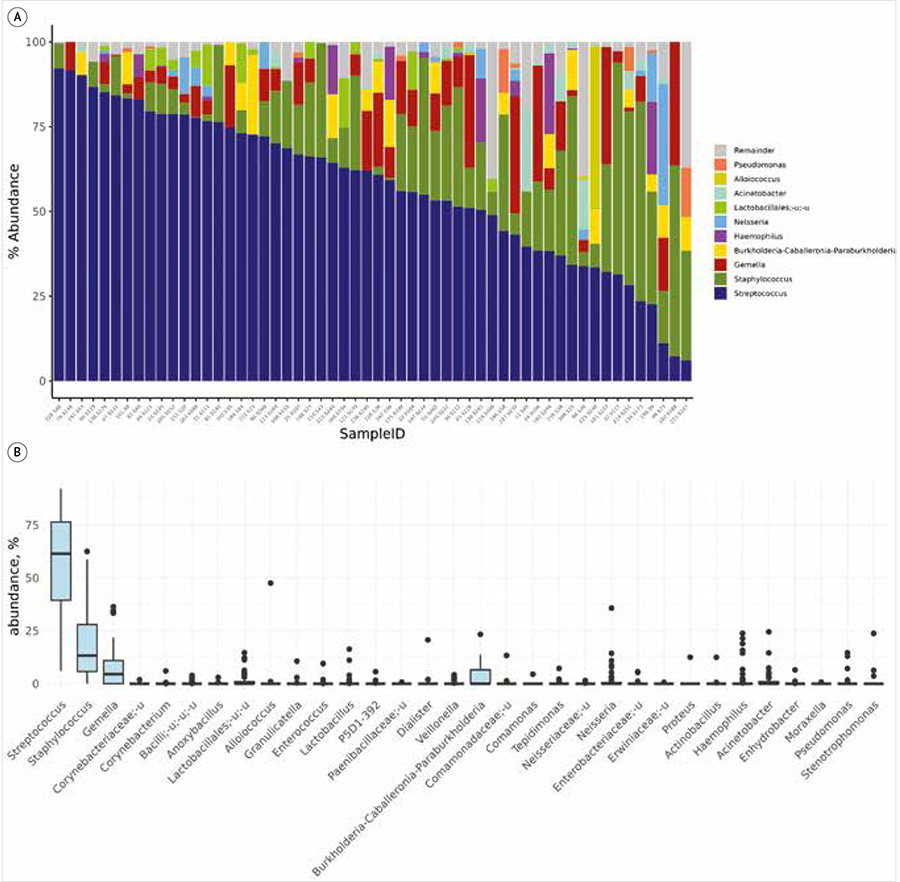
Состав микробиоты молозива здоровых женщин
У здоровых женщин с нормальным индексом массы тела, родоразрешенных в срок естественным путем, наиболее многочисленными типами бактерий оказались Firmicutes, Proteobacteria, Actinobacteriota, на уровне родов были наиболее распространены бактерии Streptococcus, Staphylococcus и Gemella.
Факторы, влияющие на состав молозива у здоровых женщин
Для того чтобы выяснить, какие факторы могли повлиять на бактериальный состав молозива здоровых матерей после естественных родов, мы проанализировали у них состав микробиоты в зависимости от их этнической принадлежности, возраста, количества детей в семье (первородящие и повторнородящие), пола ребенка, количества дней, проведенных в стационаре на момент забора молозива.
На рис. 2A, 2C, 2E, 2G видно, что точки одного цвета рассредоточены и не группируются на графике, что говорит об отсутствии влияния рассматриваемых факторов на бета-разнообразие микробиоты молозива. На рис. 2B, 2D, 2F, 2H проиллюстрировано отсутствие статистической значимости альфа-разнообразия микробиоты молозива в зависимости от перечисленных факторов.
A, B – в зависимости от количества детей, C, D – этнической принадлежности, E, F – возраста, G, H – количества дней, проведенных в стационаре на момент сбора образца.
2A, 2C, 2E, 2G – визуализация бета-разнообразия Эйтчисона между образцами с помощью метода главных координат: каждая точка относится к определенному образцу, цветом обозначено значение фактора, а расстояние между точками приближенно отображает бета-разнообразие (сходство пропорций по расстоянию Эйтчисона) между образцами; 2B, 2D, 2F, 2H – иллюстрация альфа-разнообразия микробиоты в зависимости от фактора и статистической значимости этой зависимости.
Рисунок 2. Сравнение альфа- и бета-разнообразия молозива участниц

А – визуализация бета-разнообразия Эйтчисона между образцами с помощью метода главных координат: каждая точка относится к определенному образцу, цветом обозначен пол ребенка. Статистический анализ сделан с помощью PERMANOVA, p > 0,05 означает, что пропорции микробов не зависят от пола ребенка; B – иллюстрация альфа-разнообразия микробиоты в зависимости от пола ребенка и статистическая значимость этой зависимости; С – состав образцов на уровне рода, образцы разделены по полу ребенка.
Рисунок 3. Сравнение молозива матерей мальчиков и девочек

Статистически значимая ассоциация найдена только для пола ребенка: у матерей девочек биоразнообразие (индекс Шеннона) молозива оказалось выше, чем у матерей мальчиков (рис. 3В). При этом такое различие не сказывалось на пропорциях основных таксонов. На рис. 3А видно, что образцы (точки) не образуют четко выраженных групп по цветам, маркирующим пол ребенка. Статистический анализ (PERMANOVA) также не выявил зависимости. Среди всех обнаруженных в образцах микробов, включая мало представленные и редкие, не выявлено связи наличия этих бактерий с полом ребенка. Возможно, это объясняется тем, что, хотя биологическое разнообразие молозива матерей девочек выше, в каждом случае отличие в составе молозива от матерей мальчиков индивидуально.
Таким образом, молозиво здоровых женщин после естественных родов обладает довольно однородным составом. Единственный фактор, который достоверно влияет на микробный пейзаж грудного молока в первые сутки после родов, – пол ребенка.
Изменение микробиоты молока в зависимости от стадии лактации
Известно, что химический состав грудного молока меняется с течением времени. В первые 5 суток после родов выделяется молозиво, а через 15 дней оно сменяется зрелым молоком, содержащим больше жира и лактозы [2]. Для выяснения различая в бактериальном составе мы сравнили образцы микробиоты зрелого молока и молозива у 12 женщин, от которых были получены оба образца (рис. 4).
A – визуализация бета-разнообразия Эйтчисона между образцами с помощью метода главных координат: каждая точка относится к определенному образцу, цветом обозначены тип образца (молоко или молозива), а расстояние между точками приближенно отображает бета-разнообразие (сходство пропорций по расстоянию Эйтчисона) между образцами. Стрелки соединяют образцы молока и молозива одних и тех же участниц. С помощью пермутационного многомерного анализа вариации (PERMANOVA) проверена гипотеза о том, что образцы молока и молозива отличаются друг от друга; B – альфа-разнообразие микробиоты молока и молозива; С – состав образцов молока и молозива: столбцы отображают один из образцов, цветом обозначена доля 10 самых представленных в нем микробов.
Рисунок 4. Сравнение микробиоты молока и молозива
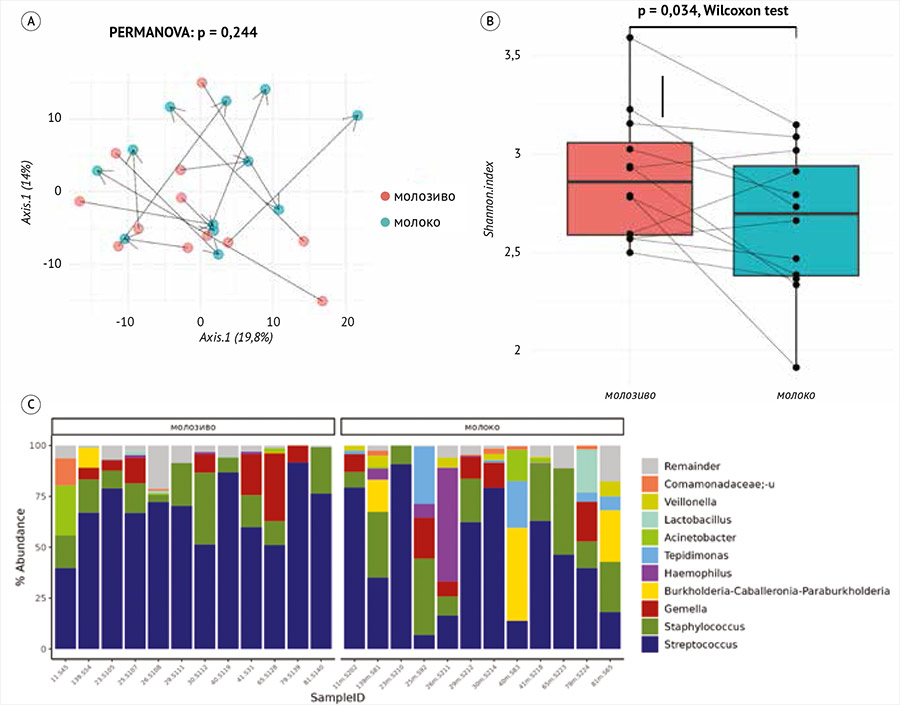
На рис. 4А продемонстрированы значительные различия в разнообразии микробиоты между молозивом и зрелым грудным молоком, оцененные по индексу Шеннона (р = 0,03). Зрелое молоко отличается более низким альфа-разнообразием по сравнению с молозивом. Однако отличия по бета-разнообразию не значимые. Также мы проверили, есть ли микробы, которые чаще встречаются (в любом количестве) в молоке, чем в молозиве, и наоборот. Таких микробов не было найдено (p.adj > 0,134 для всех микробов).
Обсуждение
Проводя параллели между полученными нами результатами и отчетами зарубежных коллег, мы выявили существенные сходства и отличия, которые, безусловно, объясняются рядом причин, связанных с методологическими и географическими различиями, способом, сроком и даже разницей во времени суток сбора образцов грудного молока и др. [18, 19].
Относительно наиболее распространенного типа (Firmicutes) и родов бактерий (Streptococcus, Staphylococcus) наши результаты согласуются с выводами крупных обзоров, посвященных описанию микробиоты грудного молока [12, 13, 20]. Вторым по распространенности типом бактерий в молоке обследованных нами женщин оказался Actinobacteria, за которым следуют Proteobacteria и Bacteroidetes, а третье место среди самых представленных родов бактерий занимает Gemella. Распределение относительной численности наиболее распространенных таксонов (для каждого таксономического ранга) в исследованиях других стран выглядит несколько иначе. Так, о доминировании типа Proteobacteria сообщили E. Jiménez et al. [21] и A. Boix-Amorós et al. (Испания) [22], T.L. Ward et al. (Канада) [23], S.H. Patel et al. (Индия) [24], тип Actinobacteria превалировал в молоке финок (H. Hermansson et al. [25]), род Pseudomonas оказался на первом месте в молоке швейцарок [26], а Weissella – в молозиве испанок (R. Cabrera-Rubio et al. [27]).
Учитывая, что наше внимание было сосредоточено на грудном молоке первых суток после родов и лабораторный анализ был выполнен с применением метода секвенирования участков V3–V4 гена 16S рРНК, Illumina (MiSeq), мы сузили круг сравнения с результатами зарубежных коллег, применив соответствующие фильтры. Аналогично полученным нами результатам, распределение типов и (или) родов бактерий выглядело в исследованиях J.E. Williams et al. (США) [28], M.R. Simpson et al. (Норвегия) [29], H. Tuominen et al. (Финляндия) [30]. Стоит, однако, отметить, что в норвежском исследовании женщины получали пробиотические добавки во время беременности (не оказавшие, по мнению авторов, влияния на общую картину микробиоты молока) [29], а молоко финок хоть и собирали в первый день после родов, но все они имели инфекционный статус вируса папилломы человека [30].
Преобладание рода Streptococcus, высокое содержание Gemella в молозиве, по нашим данным, также согласуется с рядом работ, в которых продемонстрировано поразительное сходство микробиоты двух локусов родственных организмов диады «мать – младенец» – грудного молока и ротовой полости ребенка [30–32]. Действительно, оба этих рода составляют основу микробиоты слизистой ротовой полости как детей, так и взрослых [33-35]. Таким образом, наши результаты в очередной раз доказывают жизнеспособность теории ретроградного заноса бактерий изо рта ребенка в молочную железу при грудном вскармливании [36, 37].
Интересным также является наблюдение J.E. Williams et al. о корреляции между высокоэнергетической белковой диетой и присутствием рода Gemella в грудном молоке, заключивших, что диета матери может играть ключевую роль в определении бактериального сообщества в молоке [28]. Здесь в качестве комментария добавим, что грудное молоко было собрано в холодный для нашего региона осенне-зимне-весенний период, когда доля более калорийных/питательных продуктов в рационе людей, как правило, возрастает, по сравнению с жарким летним сезоном. Несмотря на то что последний обзор литературы, посвященный влиянию фактора питания на состав микробиоты молока, не пришел к однозначным выводам, отрицать влияние диеты матери нельзя [38].
Мы не сравнивали рационы питания женщин, участвующих в исследовании целенаправленно. Однако, с одной стороны, образцы грудного молока были собраны на 3–5-е сутки на госпитальном этапе, когда рацион женщин был одинаковым и состоял из больничного меню для пациентов послеродового отделения, что, скорее, следует отнести к преимуществу, поскольку делает исследуемую группу более однородной. С другой – 30 из 56 женщин данной группы были мусульманками и не употребляли в пищу свинину. Здесь уместно перейти к обсуждению влияния другого фактора – этнической принадлежности. Именно эти 30 женщин и составили группу сравнения.
Мы не разделяли женщин по географическому признаку, учитывая, что включение в исследование и сбор грудного молока проводились на территории Российской Федерации, а также не имея достоверной информации о давности прибытия женщины в Россию. По собственному опыту работы с семьями мигрантов можем предположить, что, приехав из Киргизии, Узбекистана, Таджикистана (как правило, на заработки), подавляющее большинство, независимо от длительности проживания, сохраняет свои национальные традиции, культуру проживания, пищевые привычки. Часто на одной жилплощади скученно проживает сразу несколько многодетных семей. Дети дошкольного возраста не посещают детских садов и воспитываются матерями дома. Именно поэтому привычный географический фактор в нашем исследовании имеет более собирательное значение – культурный, национальный, этнический.
Влияние социальной среды, культуры, гигиенических привычек, плотности населения (сельской местности или города) широко обсуждается. По сообщению M. Taghizadeh et al. из Ирана, проживание в сельской местности положительно отражается на содержании в грудном молоке женщин Lactobacillus [39]. В грудном молоке сельских женщин из Индии оказались не характерные для городских жительниц Alphaproteobacteria, Betaproteobacteria, Actinobacteria [40]. В исследовании Н. Kumar et al., в котором географический фактор изучался целенаправленно, молоко женщин из разных стран/континентов значимо отличалось: испанки имели самый высокий уровень Bacteroidetes, финки – Firmicutes, молоко китаянок оказалось богато бактериями Actinobacteria, а молоко женщин из Южной Африки – Proteobacteria [41].
Вопреки ожиданиям, наша альтернативная гипотеза, заключающаяся в наличии существенной разницы в составе бактериома двух сравниваемых групп, не подтвердилась. Влияние этнической принадлежности женщин, проживающих на территории одной страны, также отвергли S. Moossavi et al. (Канада) и P.S. Pannaraj et al. (США) по результатам исследования микробиоты 343 и 107 диад «мать – ребенок» соответственно [42, 43]. Авторы канадского исследования также оказались солидарны с нами по поводу более высокого альфа-разнообразия микробиоты в грудном молоке для девочек, объяснив это отражением половых отличий кишечной микробиоты под влиянием половых гормонов [42], тем самым подчеркнув в очередной раз состоятельность ретроградного варианта колонизации грудного молока бактериями из начального отдела желудочно-кишечного тракта (ротовой полости) ребенка. И мы в свою очередь поддерживаем такую интерпретацию этой находки. На сегодняшний день достаточно аргументов, чтобы признать различия в составе и разнообразии кишечной микробиоты между мужчинами и женщинами под влиянием половых гормонов, в том числе тех, которые обусловливают особенности развития метаболических расстройств [44–47]. Есть также данные количественных измерений. У иранских женщин молоко для мальчиков оказалось богато Lactobacillus [39], а J.E. Williams et al. подсчитали, что уровень Streptococcus в молоке матерей мальчиков выше, а Staphylococcus – ниже, чем в молоке матерей девочек (51,7 ± 4,2% по сравнению с 36,0 ± 5,6%, 19,2 ± 3,7% по сравнению с 34,7 ± 6,1% соответственно; р < 0,05) [28].
Возраст женщины и количество детей в семье по данным J.E. Williams et al. не были связаны с относительной численностью наиболее распространенных таксонов, как и по результатам нашего анализа. Однако мнения в отношении этих факторов также расходятся. Молоко иранских женщин после 3 мес. лактации содержало значительно меньше лактобактерий [39]. A. Ojo-Okunola et al. сообщили, что у матерей старшего возраста индекс разнообразия выше, чем у молодых [48], что кажется вполне логичным. Профессор J.M. Rodríguez из Испании, на счету которого не менее десятка работ, посвященных изучению микробиоты грудного молока, не без оснований утверждает, что молочная железа хранит память о предыдущих детях: молоко многодетных более разнообразно, содержит больше Lactobacillus и Neisseria из слюны младенцев [49], видимо, по принципу явления микрохимеризма. В подтверждение S. Moossavi et al. сообщили о более низком бактериальном разнообразии микробиоты молока первородящих женщин [50]. На примере кишечной микробиоты показано, что старшие братья и сестры положительно влияют на становление микробиоты кишечника: чем выше у ребенка очередность рождения, тем больше среди представителей его кишечной микробиоты Lactobacilli (p < 0,001) и Bacteroides (p = 0,02) и меньше Clostridia (p < 0,001), что клинически выражается в снижении риска аллергических заболеваний, как показали результаты масштабного исследования микробиоты J. Penders et al. более 500 детей [51]. Мы не задавались вопросом, кормила ли женщина предыдущего ребенка грудью, и не можем судить о памяти молочной железы, но рекомендуем учесть это условие для будущих исследований.
Следуя вышеизложенной логике, увеличение частоты прямого контакта с ребенком при грудном вскармливании с течением времени должно положительно коррелировать с альфа-разнообразием молочной микробиоты. Однако мы получили обратный результат, подтвердив выводы более ранних работ команд R. Cabrera-Rubio et al. и G. Solís et al. [27, 52]. С другой стороны, высокое разнообразие микробиоты молозива кажется еще более логичным и в полной мере демонстрирует значение первого микробного инокулята для кишечника новорожденного, для которого степень разнообразия является одним из показателей здоровья [53].
Наконец, мы рассмотрели еще один фактор – длительность пребывания ребенка в стационаре. Опираясь на исследования, свидетельствующие об искажении кишечной микробиоты ребенка, рожденного путем кесарева сечения, условно-патогенной флорой, характерной для больничной среды (Enterococcus, Enterobacter и Klebsiella) [54], мы предположили, что микробиота грудного молока вносит свой вклад. Здоровые женщины, прибывшие в больницу за несколько дней до родов (например, по причине тренировочных схваток, как в нашем случае), могут быть контаминированы условно-патогенными больничными высокорезистентными штаммами бактерий в большей степени, чем те, которые поступили сразу в родильный блок [55, 56]. Однако ни альфа-разнообразие, ни пропорции сходства бактерий значимо не отличались у женщин, которые провели на госпитальном этапе разное количество койко-дней. Таким образом, грудное молоко как бы нейтрализует негативное воздействие микроэкологии окружающей среды, что особенно важно для новорожденных, в случае, когда выписка задерживается по разным причинам. На сколько нам известно, никто ранее не выделял этот фактор. Для будущих исследований с большой выборкой рекомендуем обратить внимание на это обстоятельство, что позволит разработать четкие показания к необходимости досрочной госпитализации женщины в родильный дом для ожидания родов.
Заключение
Мы продемонстрировали данные о бактериальном составе грудного молока здоровых женщин, которые в полной мере могут представлять здоровую микробиоту грудного молока женщин Российской Федерации на мировой арене. Обсудили, как некоторые объективные условия (этническая принадлежность матери, ее возраст, количество родов, пол ребенка и стадия лактации) влияют на биоразнообразие микробиоты женского молока. Интересная находка о различиях молока для мальчиков и девочек требует дальнейшего изучения, их более тщательный анализ может пролить свет на особенности полового дисморфизма при развитии кардиометаболических расстройств и преждевременного полового созревания, а также профилактику этих состояний через микробиоту кишечника [57, 58].
Также
хочется отметить, что несмотря на отсутствие значимых отличий молока по
этническому признаку, этот фактор требует внимания. Так, показано, что люди
разной этнической принадлежности, проживающие на одной территории, имеют схожие
характеристики кишечной микробиоты [59]. Наши выводы опирались на качественное и
количественное сравнение наиболее распространенных таксонов в грудном молоке
женщин. Возможно, имеет смысл, напротив, сосредоточиться на более редких
последовательностях. Такой подход позволит определить географически/этнически наиболее «выгодную» микробиоту грудного молока и изучить
ее состав более детально. Наглядный тому пример – знаменитая Lactobacillus
reuteri, которую в 1990 г. Иван Касас выделил из грудного
молока женщины, проживающей в Андах, и которая теперь активно используется
педиатрами для лечения и профилактики функциональных нарушений
желудочно-кишечного тракта у младенцев
[60].
Список литературы / References
- Kim SY, Yi DY. Components of human breast milk: from macronutrient to microbiome and microRNA. Clin Exp Pediatr. 2020;63(8):301-309. https://doi.org/10.3345/cep.2020.00059.
- Garwolińska D, Namieśnik J, Kot-Wasik A, Hewelt-Belka W. Chemistry of Human Breast Milk-A Comprehensive Review of the Composition and Role of Milk Metabolites in Child Development. J Agric Food Chem. 2018;66(45):11881-11896. https://doi.org/10.1021/acs.jafc.8b04031.
- Galante L, Milan AM, Reynolds CM, Cameron-S mith D, Vickers MH, Pundir S. Sex-Specific Human Milk Composition: The Role of Infant Sex in Determining Early Life Nutrition. Nutrients. 2018;10(9):1194. https://doi.org/10.3390/nu10091194.
- Hahn WH, Song JH, Song S, Kang NM. Do gender and birth height of infant affect calorie of human milk? An association study between human milk macronutrient and various birth factors. J Matern Fetal Neonatal Med. 2017;30(13):1608-1612. https://doi.org/10.1080/14767058.2016.1219989.
- Powe CE, Knott CD, Conklin-Brittain N. Infant sex predicts breast milk energy content. Am J Hum Biol. 2010;22(1):50-54. https://doi.org/10.1002/ajhb.20941.
- Bzikowska-Jura A, Sobieraj P, Szostak-Węgierek D, Wesołowska A. Impact of Infant and Maternal Factors on Energy and Macronutrient Composition of Human Milk. Nutrients. 2020;12(9):2591. https://doi.org/10.3390/nu12092591.
- Pundir S, Wall CR, Mitchell CJ, Thorstensen EB, Lai CT, Geddes DT, Cameron-Smith D. Variation of Human Milk Glucocorticoids over 24 hour Period. J Mammary Gland Biol Neoplasia. 2017;22(1):85-92. https://doi.org/10.1007/s10911-017-9375-x.
- Jiang J, Wu K, Yu Z, Ren Y, Zhao Y, Jiang Y et al. Changes in fatty acid composition of human milk over lactation stages and relationship with dietary intake in Chinese women. Food Funct. 2016;7(7):3154-3162. https://doi.org/10.1039/c6fo00304d.
- Van Sadelhoff JHJ, van de Heijning BJM, Stahl B, Amodio S, Rings EHHM, Mearin ML et al. Longitudinal Variation of Amino Acid Levels in Human Milk and Their Associations with Infant Gender. Nutrients. 2018;10(9):1233. https://doi.org/10.3390/nu10091233.
- Martín R, Langa S, Reviriego C, Jimínez E, Marín ML, Xaus J et al. Human milk is a source of lactic acid bacteria for the infant gut. J Pediatr. 2003;143(6):754-758. https://doi.org/10.1016/j.jpeds.2003.09.028.
- Rodríguez JM, Fernández L, Verhasselt V. The Gut - Breast Axis: Programming Health for Life. Nutrients. 2021;13(2):606. https://doi.org/10.3390/nu13020606.
- Zimmermann P, Curtis N. Breast milk microbiota: A review of the factors that influence composition. J Infect. 2020;81(1):17-47. https://doi.org/10.1016/j.jinf.2020.01.023.
- Selma-Royo M, Calvo Lerma J, Cortés-Macías E, Collado MC. Human milk microbiome: From actual knowledge to future perspective. Semin Perinatol. 2021;45(6):151450. https://doi.org/10.1016/j.semperi.2021.151450.
- Togo A, Dufour JC, Lagier JC, Dubourg G, Raoult D, Million M. Repertoire of human breast and milk microbiota: a systematic review. Future Microbiol. 2019;14(7):623-641. https://doi.org/10.2217/fmb-2018-0317.
- Efimova D, Tyakht A, Popenko A, Vasilyev A, Altukhov I, Dovidchenko N et al. Knomics-Biota - a system for exploratory analysis of human gut microbiota data. BioData Min. 2018;11:25. https://doi.org/10.1186/s13040018-0187-3.
- Bolyen E, Rideout JR, Dillon MR, Bokulich NA, Abnet CC, Al-Ghalith GA et al. Reproducible, interactive, scalable and extensible microbiome data science using QIIME 2. Nat Biotechnol. 2019;37(8):852-857. https://doi.org/10.1038/s41587-019-0209-9.
- Callahan BJ, McMurdie PJ, Rosen MJ, Han AW, Johnson AJ, Holmes SP. DADA2: High-resolution sample inference from Illumina amplicon data. Nat Methods. 2016;13(7):581-583. https://doi.org/10.1038/nmeth.3869.
- LeMay-Nedjelski L, Copeland J, Wang PW, Butcher J, Unger S, Stintzi A, O’Connor DL. Methods and Strategies to Examine the Human Breastmilk Microbiome. In: Beiko R, Hsiao W, Parkinson J (eds.). Microbiome Analysis. Methods in Molecular Biology. Vol. 1849. New York: Humana Press; 2018, pp. 63-86. https://doi.org/10.1007/978-1-4939-8728-3_5.
- Corona-C ervantes K, Zavala-Torres NG, García-Gutiérrez R, Piña-Escobedo A, Hernández-Quiroz F, García-Mena J. Variation of the Human Milk Bacterial Diversity during the Time of the Day. Proceedings. 2020;66(1):33. https://doi.org/10.3390/proceedings2020066033.
- Fitzstevens JL, Smith KC, Hagadorn JI, Caimano MJ, Matson AP, Brownell EA. Systematic Review of the Human Milk Microbiota. Nutr Clin Pract. 2017;32(3):354-364. https://doi.org/10.1177/0884533616670150.
- Jiménez E, de Andrés J, Manrique M, Pareja-Tobes P, Tobes R, Martínez-Blanch JF et al. Metagenomic Analysis of Milk of Healthy and Mastitis-Suffering Women. J Hum Lact. 2015;31(3):406-415. https://doi.org/10.1177/0890334415585078.
- Boix-Amorós A, Collado MC, Mira A. Relationship between Milk Microbiota, Bacterial Load, Macronutrients, and Human Cells during Lactation. Front Microbiol. 2016;7:492. https://doi.org/10.3389/fmicb.2016.00492.
- Ward TL, Hosid S, Ioshikhes I, Altosaar I. Human milk metagenome: a functional capacity analysis. BMC Microbiol. 2013;13:116. https://doi.org/10.1186/1471-2180-13-116.
- Patel SH, Vaidya YH, Patel RJ, Pandit RJ, Joshi CG, Kunjadiya AP. Culture independent assessment of human milk microbial community in lactational mastitis. Sci Rep. 2017;7(1):7804. https://doi.org/10.1038/s41598017-08451-7.
- Hermansson H, Kumar H, Collado MC, Salminen S, Isolauri E, Rautava S. Breast Milk Microbiota Is Shaped by Mode of Delivery and Intrapartum Antibiotic Exposure. Front Nutr. 2019;6:4. https://doi.org/10.3389/fnut.2019.00004.
- Jost T, Lacroix C, Braegger C, Chassard C. Assessment of bacterial diversity in breast milk using culture-dependent and culture-independent approaches. Br J Nutr. 2013;110(7):1253-1262. https://doi.org/10.1017/S0007114513000597.
- Cabrera-Rubio R, Collado MC, Laitinen K, Salminen S, Isolauri E, Mira A. The human milk microbiome changes over lactation and is shaped by maternal weight and mode of delivery. Am J Clin Nutr. 2012;96(3):544-551. https://doi.org/10.3945/ajcn.112.037382.
- Williams JE, Carrothers JM, Lackey KA, Beatty NF, York MA, Brooker SL et al. Human Milk Microbial Community Structure Is Relatively Stable and Related to Variations in Macronutrient and Micronutrient Intakes in Healthy Lactating Women. J Nutr. 2017;147(9):1739-1748. https://doi.org/10.3945/jn.117.248864.
- Simpson MR, Avershina E, Storrø O, Johnsen R, Rudi K, Øien T. Breastfeeding-associated microbiota in human milk following supplementation with Lactobacillus rhamnosus GG, Lactobacillus acidophilus La-5, and Bifidobacterium animalis ssp. lactis Bb-12. J Dairy Sci. 2018;101(2):889-899. https://doi.org/10.3168/jds.2017-13411.
- Tuominen H, Rautava S, Collado MC, Syrjänen S, Rautava J. HPV infection and bacterial microbiota in breast milk and infant oral mucosa. PLoS ONE. 2018;13(11):e0207016. https://doi.org/10.1371/journal.pone.0207016.
- Drell T, Štšepetova J, Simm J, Rull K, Aleksejeva A, Antson A et al. The Influence of Different Maternal Microbial Communities on the Development of Infant Gut and Oral Microbiota. Sci Rep. 2017;7(1):9940. https://doi.org/10.1038/s41598-017-09278-y.
- Biagi E, Quercia S, Aceti A, Beghetti I, Rampelli S, Turroni S et al. The Bacterial Ecosystem of Mother’s Milk and Infant’s Mouth and Gut. Front Microbiol. 2017;8:1214. https://doi.org/10.3389/fmicb.2017.01214.
- Hendricks-Muñoz KD, Xu J, Parikh HI, Xu P, Fettweis JM, Kim Y et al. Skin-to-Skin Care and the Development of the Preterm Infant Oral Microbiome. Am J Perinatol. 2015;32(13):1205-1216. https://doi.org/10.1055/s-0035-1552941.
- Zaura E, Nicu EA, Krom BP, Keijser BJ. Acquiring and maintaining a normal oral microbiome: current perspective. Front Cell Infect Microbiol. 2014;4:85. https://doi.org/10.3389/fcimb.2014.00085.
- Li K, Bihan M, Methé BA. Analyses of the stability and core taxonomic memberships of the human microbiome. PLoS ONE. 2013;8(5):e63139. https://doi.org/10.1371/journal.pone.0063139.
- Родригеc ХМ. Микробиота женского молока. Consilium Medicum. Педиатрия (Прил.). 2016;(4):35-40. Режим доступа: https://omnidoctor.ru/library/izdaniya-dlya-vrachey/pediatriya-consilium-medicum/ped2016/ped2016_4/mikrobiota-zhenskogo-moloka.
- Ramsay DT, Kent JC, Owens RA, Hartmann PE. Ultrasound imaging of milk ejection in the breast of lactating women. Pediatrics. 2004;113(2):361-367. https://doi.org/10.1542/peds.113.2.361.
- Taylor R, Keane D, Borrego P, Arcaro K. Effect of Maternal Diet on Maternal Milk and Breastfed Infant Gut Microbiomes: A Scoping Review. Nutrients. 2023;15(6):1420. https://doi.org/10.3390/nu15061420.
- Taghizadeh M, Mirlohi M, Poursina F, Madani G, Khoshhali M, Bahreini N, Safaei HG. The influence of impact delivery mode, lactation time, infant gender, maternal age and rural or urban life on total number of Lactobacillus in breast milk Isfahan - Iran. Adv Biomed Res. 2015;4(1):141. https://doi.org/10.4103/2277-9175.161546.
- Vaidya YH, Patel SH, Patel RJ, Pandit RJ, Joshi CG, Kunjadia AP. Human milk microbiome in urban and rural populations of India. Meta Gene. 2017;13:13-22. https://doi.org/10.1016/j.mgene.2017.04.001.
- Kumar H, du Toit E, Kulkarni A, Aakko J, Linderborg KM, Zhang Y et al. Distinct Patterns in Human Milk Microbiota and Fatty Acid Profiles Across Specific Geographic Locations. Front Microbiol. 2016;7:1619. https://doi.org/10.3389/fmicb.2016.01619.
- Moossavi S, Sepehri S, Robertson B, Bode L, Goruk S, Field CJ et al. Composition and Variation of the Human Milk Microbiota Are Influenced by Maternal and Early-Life Factors. Cell Host Microbe. 2019;25(2):324-335. e4. https://doi.org/10.1016/j.chom.2019.01.011.
- Pannaraj PS, Li F, Cerini C, Bender JM, Yang S, Rollie A et al. Association Between Breast Milk Bacterial Communities and Establishment and Development of the Infant Gut Microbiome. JAMA Pediatr. 2017;171(7):647-654. https://doi.org/10.1001/jamapediatrics.2017.0378.
- Markle JG, Frank DN, Mortin-Toth S, Robertson CE, Feazel LM, Rolle-Kampczyk U et al. Sex differences in the gut microbiome drive hormone-dependent regulation of autoimmunity. Science. 2013;339(6123):1084-1088. https://doi.org/10.1126/science.1233521.
- Santos-Marcos JA, Mora-Ortiz M, Tena-Sempere M, Lopez-Miranda J, Camargo A. Interaction between gut microbiota and sex hormones and their relation to sexual dimorphism in metabolic diseases. Biol Sex Differ. 2023;14(1):4. https://doi.org/10.1186/s13293-023-00490-2.
- Park CH, Lee EJ, Kim HL, Lee YT, Yoon KJ, Kim HN. Sex-specific associations between gut microbiota and skeletal muscle mass in a population-b ased study. J Cachexia Sarcopenia Muscle. 2022;13(6):2908-2919. https://doi.org/10.1002/jcsm.13096.
- Maffei S, Forini F, Canale P, Nicolini G, Guiducci L. Gut Microbiota and Sex Hormones: Crosstalking Players in Cardiometabolic and Cardiovascular Disease. Int J Mol Sci. 2022;23(13):7154. https://doi.org/10.3390/ijms23137154.
- Ojo-Okunola A, Claassen-Weitz S, Mwaikono KS, Gardner-Lubbe S, Stein DJ, Zar HJ et al. Influence of Socio-Economic and Psychosocial Profiles on the Human Breast Milk Bacteriome of South African Women. Nutrients. 2019;11(6):1390. https://doi.org/10.3390/nu11061390.
- Rodríguez JM. The origin of human milk bacteria: is there a bacterial entero-mammary pathway during late pregnancy and lactation? Adv Nutr. 2014;5(6):779-784. https://doi.org/10.3945/an.114.007229.
- Moossavi S, Sepehri S, Robertson B, Bode L, Goruk S, Field CJ et al. Composition and Variation of the Human Milk Microbiota Are Influenced by Maternal and Early-Life Factors. Cell Host Microbe. 2019;25(2):324-335.e4. https://doi.org/10.1016/j.chom.2019.01.011.
- Penders J, Gerhold K, Stobberingh EE, Thijs C, Zimmermann K, Lau S, Hamelmann E. Establishment of the intestinal microbiota and its role for atopic dermatitis in early childhood. J Allergy Clin Immunol. 2013;132(3):601-607.e8. https://doi.org/10.1016/j.jaci.2013.05.043.
- Solís G, de Los Reyes-Gavilan CG, Fernández N, Margolles A, Gueimonde M. Establishment and development of lactic acid bacteria and bifidobacteria microbiota in breast-milk and the infant gut. Anaerobe. 2010;16(3):307-310. https://doi.org/10.1016/j.anaerobe.2010.02.004.
- Dominguez-Bello MG, Godoy-Vitorino F, Knight R, Blaser MJ. Role of the microbiome in human development. Gut. 2019;68(6):1108-1114. https://doi.org/10.1136/gutjnl-2018-317503.
- Shao Y, Forster SC, Tsaliki E, Vervier K, Strang A, Simpson N et al. Stunted microbiota and opportunistic pathogen colonization in caesarean-section birth. Nature. 2019;574(7776):117-121. https://doi.org/10.1038/s41586-019-1560-1.
- Ben Maamar S, Hu J, Hartmann EM. Implications of indoor microbial ecology and evolution on antibiotic resistance. J Expo Sci Environ Epidemiol. 2020;30(1):1-15. https://doi.org/10.1038/s41370-019-0171-0.
- Lax S, Sangwan N, Smith D, Larsen P, Handley KM, Richardson Met al. Bacterial colonization and succession in a newly opened hospital. Sci Transl Med. 2017;9(391):eaah6500. https://doi.org/10.1126/scitranslmed.aah6500.
- He S, Li H, Yu Z, Zhang F, Liang S, Liu H et al. The Gut Microbiome and Sex Hormone-Related Diseases. Front Microbiol. 2021;12:711137. https://doi.org/10.3389/fmicb.2021.711137.
- Calcaterra V, Rossi V, Massini G, Regalbuto C, Hruby C, Panelli S et al. Precocious puberty and microbiota: The role of the sex hormone-gut microbiome axis. Front Endocrinol (Lausanne). 2022;13:1000919. https://doi.org/10.3389/fendo.2022.1000919.
- Deschasaux M, Bouter KE, Prodan A, Levin E, Groen AK, Herrema H et al. Depicting the composition of gut microbiota in a population with varied ethnic origins but shared geography. Nat Med. 2018;24(10):1526-1531. https://doi.org/10.1038/s41591-018-0160-1.
- Захарова ИН, Бережная ИВ, Кучина АЕ, Дедикова ОВ. Пробиотик Lacto bacil lus reuteri DSM 17938: что известно о нем сегодня? Медицинский совет. 2019;(17):236-242. https://doi.org/10.21518/2079-701X-2019-17-236-242.








