
Журнал "Медицинский совет" №11/2024
DOI: 10.21518/ms2024-306
И.В. Бережная1, ORCID: 0000-0002-2847-6268
Л.В. Гончарова2, ORCID: 0000-0002-6482-010X
И.Н. Захарова1, ORCID: 0000-0003-4200-4598
1 Российская медицинская академия непрерывного профессионального образования; 125993, Россия, Москва, ул. Баррикадная, д. 2/1, стр. 1
2 Детская городская клиническая больница имени З.А. Башляевой; 125373, Россия, Москва, ул. Героев Панфиловцев, д. 28
Капризы в еде, отказ от некоторых продуктов, избирательность в еде ребенка – проблемы, с которыми часто обращаются к педиатру родители. За несколько минут на приеме трудно разобраться в причинах проблемы. Но наибольшие трудности в диагностике возникают, когда родители жалуются, что не могут накормить ребенка первых месяцев жизни как на грудном, так и на искусственном вскармливании. Анорексия у детей раннего возраста может иметь психологический и/или органический генез. Наиболее сложные и ранние формы часто имеют смешанную этиологию. При сборе анамнеза часто отмечаются случаи насильственного кормления, частая смена смесей, эмоциональная неустойчивость мамы. В статье приводится несколько клинических случаев с разными причинами отказа от еды детей, с которыми обращались родители к врачу. Первый клинический случай: мальчик Н., 11 лет, с жалобами на отсутствие прибавки массы тела – вес не превышал 6,8 кг, крайне низкие темпы роста. У ребенка выявлена умеренная эозинофильная инфильтрация пищевода эозинофилами до 10–12 в поле зрения. Второй клинический пример: девочка М., 7 мес., с жалобами на снижение аппетита, отказ от еды, отсутствие пищевого интереса и жажды, срыгивания на фоне кормления. Эозинофильная инфильтрация в двенадцатиперстной кишке до 50 эозинофилов в поле зрения. В желудке до 5 эозинофилов в поле зрения. Третий пример: мальчик Я. с жалобами на беспокойство, больше в вечернее и ночное время, часто просыпается ночью, появились срыгивания, икота, периоды вздутия живота. В зависимости от причины анорексии в статье приведены современные возможности использования специализированных продуктов питания для этой категории детей.
Для цитирования: Бережная ИВ, Гончарова ЛВ, Захарова ИН. Анорексия младенца: как не ошибиться в диагнозе? Медицинский совет. 2024;18(11):210–218. https://doi.org/10.21518/ms2024-306.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Согласие пациентов на публикацию: родители пациентов подписали информированное согласие на публикацию своих данных.
Infantile anorexia: how to avoid diagnostic errors?
Irina V. Berezhnaya1, ORCID: 0000-0002-2847-6268
Liudmila V. Goncharova2, ORCID: 0000-0002-6482-010X
Irina N. Zakharova1, ORCID: 0000-0003-4200-4598
1 Russian Medical Academy of Continuing Professional Education; 2/1, Bldg. 1, Barrikadnaya St., Moscow, 125993, Russia
2 Bashlyaeva Children’s City Clinical Hospital; 28, Geroev Panfilovtsev St., Moskow, 125373, Russia
Food whims, some food refusals, food selectivity are issues for which parents often seek advice from a paediatrician. It is difficult to identify the reasons of the issues for just a few minutes of a visit. But the greatest challenges in the diagnosis arise when parents complain that they fail to feed both breastfed and non-breastfed young infants. Anorexia in young infants may be of a psychological and/or organic origin. The most complex and early forms often have a mixed etiology. A detailed history taking reveals cases of forced feeding, frequent changes of formula, and mother’s emotional instability. The article presents several clinical cases with different reasons for food refusals in children for which parents sought advice from a doctor. The first clinical case: a 11-year-old boy with complaints about lack of weight gain, as his weight did not exceed 6.8 kg, extremely slow growth rates. The child was diagnosed with moderate eosinophilic infiltration of the esophagus with eosinophils up to 10–12 per high-power field (hpf). Second clinical case: a 7-month-old girl M. with complaints about decreased appetite, food refusal, lack of interest in food and thirst, regurgitation during feeding. The examination showed eosinophilic infiltration of the duodenum up to 50 eosinophils per hpf. In the stomach there were up to 5 eosinophils per hpf. Third case: a boy Ya. with complaints about restlessness, more in the evening and at night, waking up frequently at night, regurgitation, hiccups, and periods of bloating. The article presents modern options for using specialized food products for this category of children according to the cause of anorexia.
For citation: Berezhnaya IV, Goncharova LV, Zakharova IN. Infantile anorexia: how to avoid diagnostic errors? Meditsinskiy Sovet. 2024;18(11):210–218. (In Russ.) https://doi.org/10.21518/ms2024-306.
Conflict of interest: the authors declare no conflict of interest.
Basic patient privacy consent: parents of patients signed informed consent regarding publishing their data.
Введение
«Ребенок ничего не ест!» – говорит мама на приеме у педиатра. Примерно каждая третья мама считает, что ребенок ест плохо, мало, избирательно, отказывается от правильных продуктов. Причины отказа от еды могут иметь органическую природу и/или психологическую. Расстройства пищевого поведения (РПП) у детей не имеют общепринятого определения. РПП обычно проявляются в виде отказа от пищи или уменьшения объема порции, чем необходимо по возрасту, и могут быть связаны с проблемами поведения и воспитания и/или органическим заболеванием. Эта ситуация касается в основном детей раннего и младшего возраста и значительно отличается от РПП у подростков и взрослых (нервная анорексия или булимия).
По литературным данным, от 10 до 25–50% родителей здоровых детей младше 3 лет беспокоятся в связи с РПП и от 1 до 5–10% младенцев и детей младшего возраста страдают от серьезных проблем с кормлением, приводящих к задержке развития, недостаточности питания и задержке роста [1–3]. Особая группа детей с РПП – это недоношенные и дети с серьезными неврологическими диагнозами. Эксперты оценивают, что проблемы с питанием возникают у 30% недоношенных детей и у 80% пациентов с неврологическими нарушениями или пороками развития, что приводит к развитию соматических заболеваний [4–6].
Детское расстройство питания: этиология, патогенез, диагностика
Международная классификация функционирования, инвалидности и здоровья (МКФ) определяет детское расстройство питания (ДРП) как нарушение перорального приема пищи, которое не соответствует возрасту и связано с медицинскими, пищевыми, психосоциальными дисфункциями и/или навыками кормления. В течение последних десятилетий данной проблемой занимаются педиатры, психологи, психиатры, гастроэнтерологи, неврологи, педагоги. В результате исследований предложены различные концепции по диагностике и коррекции расстройств кормления. Навыки приема пищи у ребенка возникают постепенно, при созревании центральной нервной системы, желудочно-кишечного тракта (ЖКТ), осознанности взаимодействия с мамой и четко связаны с возрастом ребенка. Период введения прикорма от 4,5 до 6,5 мес. приходится на исчезновение рефлекса выталкивания ложки языком, появление пищевого интереса и адекватное состояние ферментных систем пищеварения [7].
Детские расстройства питания (ДРП) предложено условно разделить на острые с продолжительностью менее трех месяцев и хронические с продолжительностью более трех месяцев [8]. Причины ДРП, связанные с поражением органов и систем организма, в англоязычной литературе определяются как медицинские: недостаточность калорийности и питательности рациона (пищевые факторы), нарушение приема пищи или отрицательные факторы кормления и психосоциальные факторы влияния (табл. 1) [9].
Таблица 1. Обобщенные критерии для диагностики детского расстройства питания [10–16]
| Причины | Проявления |
|---|---|
| Медицинские | • Аномалии или заболевания ЖКТ. Аномалии ротоглотки и гортани могут нарушить механику нормального жевания и глотания. Воспалительные заболевания пищевода: ГЭРБ с эзофагитом, эозинофильный эзофагит. Воспалительные заболевания желудка: гастрит, эозинофильный гастрит, аутоиммунный гастрит, болезнь Крона и др. Патологии двенадцатиперстной и тонкой кишки, в т.ч. СИБР, целиакия, энтеропатия и др. Хронические колиты: ВЗК, постинфекционный колит, эозинофильный колит и др. • Заболевания дыхательных путей и легких являются другими компонентами «аэродигестивной болезни» и также могут приводить к ДРП. Состояние легких у недоношенных часто вызывает учащенное дыхание и одышку, которые влияют на приобретение навыков глотания и кормления. Проблема выражена особенно у маленьких детей с хроническим тахипноэ, у которых координация сосания-глотания-дыхания особенно затруднена. Аспирация, возникающая в результате ДРП, может проявляться в виде пневмонии, но часто может быть случайной находкой у детей с отказом от еды в младенчестве. • Патология сердца и сосудов: дети с рожденными пороками сердца с длительной госпитализаций с интенсивными медицинскими вмешательствами могут задержать и/или потерять уже приобретенные навыки кормления. Операции на сердце могут сопровождаться редким, но тяжелым осложнением: рецидивирующее повреждение гортанного нерва с параличом левой голосовой связки и нарушением защиты дыхательных путей. Хроническая гипоксия и возможное повреждение блуждающего нерва могут проявляться рвотой, дисфагией и уменьшением объема питания. • Нейрогенная дисфагия может проявиться как в раннем возрасте, так и позже, являясь вторичной по отношению к церебральному параличу, и может приводить к частым инфекциям и даже смертности от острой и хронической аспирации. • Расстройства аутистического спектра часто связаны с ДРП. • Вторичное снижение аппетита у некоторых детей связано с расстройством сигнальных механизмов аппетита, вызывающим ДРП. |
| Недостаточность калорийности рациона | • Недоедание и недостаточная калорийность рациона затрагивают от 25 до 50% детей с ДРП и часто распространены среди детей с медицинскими причинами. • Исключение целых групп продуктов: фруктов и овощей – может привести к дефициту микроэлементов, несмотря на адекватное потребление калорий. Вегетарианство/веганство родителей не редко проецируется на детей, которые в своем рационе не получают достаточного количества белков и жиров. Избыточное употребление недетских продуктов, напитков или пищевых добавок может приводить к токсичности (глутамат натрия, ортофосфорная кислота, красители, консерванты, простые сахара и др.) и ожирению. |
| Нарушение приема пищи или отрицательные факторы кормления | • Изменение привычных правил кормления из-за болезни, травмы может привести к нарушению или потере приобретенных уже навыков кормления и/или извращению вкуса, что влечет за собой отказ от еды. • Нарушение сенсорной функции полости рта препятствует/ограничивает восприятие и переносимость текучести и текстуры пищи. Это может быть связано с конкретными характеристиками пищи: вкусом, температурой, размером ложки, вязкостью, текстурой, запахом или внешним видом. Часто гиперчувствительность сопровождается рвотными движениями при использовании более плотных кусочков, длительным жеванием, держанием пищи во рту и затем выплевыванием. Эти дети обычно предпочитают мягкий вкус, мелкозернистую текстуру, небольшие порции пищи и пищу комнатной температуры. • Неэффективное пероральное питание может проявляться в виде увеличения продолжительности приема пищи (более 30 мин) и уменьшения объема съеденной пищи за каждое кормление. |
| Психосоциальные факторы влияния | • Факторы задержки развития ребенка, приводящие к задержкам моторики, речи, социализации и познания, могут способствовать развитию ДРП. То есть возникает несоответствие между возможностями ребенка по кормлению и ожиданиями взрослых лиц, осуществляющих уход за ребенком. Например, если ожидания мамы относительно того, что должен есть ребенок, не совпадают с тем, что ребенок может есть, развивается негативный опыт кормления, приводящий к ДРП (насильственное кормление). • У ребенка неуправляемый темперамент, расстройства настроения, тревожность или расстройство мышления могут увеличить частоту деструктивного пищевого поведения, что приводит к стрессу родителей, и изменить взаимодействие с ребенком во время приема пищи. • Факторы окружающей среды могут способствовать развитию ДРП – это использование телевизора или других электронных гаджетов во время еды или кормление ребенка в темной комнате во время сна и т.д. |
В физиологических условиях у здоровых младенцев и детей раннего возраста длительность прима пищи должна занимать около 20–30 мин без дискомфорта для мамы и ребенка. Промежуток времени между приемами пищи должен составлять не менее 2,5–3,5 ч, чтобы ребенок успел проголодаться и осознать чувство голода и ритма кормления [17, 18].
Наибольшие трудности в диагностике РПП возникают у педиатра, когда необходимо разграничить проблемы ребенка и проблемы мамы (родителей, опекунов) (табл. 2) [19].
Таблица 2. Основные проблемы ребенка и родителей при расстройствае пищевого поведения
| Проблемы со стороны ребенка | Проблемы со стороны мамы | |
|---|---|---|
| Физические | Психологические | Психологические |
| • Боль при глотании • Боль в животе во время или после еды • Дискомфорт во время приема определенной пищи |
• Страх кормления • Страх при введении новых продуктов • Привычные рвоты, особенно при стрессе • Неофобия • Аносмия и агевзия • Насилие со стороны родителей во время кормления |
• Чувство вины • Страх перед началом кормления ребенка • Беспокойство • Стресс и раздражение, когда ребенок отказывается от еды • Насильственное кормление |
Наиболее часто РПП рассматривают психологи и психиатры, которые на данный момент создали диагностические критерии ARFID («Расстройства избегания/ограничения потребления пищи»), подчеркивая измененное пищевое поведение, особенно избирательность, плохой аппетит и отвращение к еде, одновременно уменьшая роль медицинских или психологических сопутствующих заболеваний в проблемах питания. В некоторых обзорах приводятся новые определения, основанные на трех клинических проявлениях: отсутствии аппетита, чувствительности и посттравматическом отвращении к пище, которые могут возникать в любой возрастной период [20–22]. В литературе описано, что РПП (ARFID) представляют собой большую коморбидную психиатрическую патологию: расстройства настроения, тревожные расстройства, обсессивные расстройства, посттравматические стрессовые расстройства и нарушения нервного развития, среди которых аутистический спектр и синдром дефицита внимания с гиперактивностью [23]. При этом внимание к соматическим заболеваниям у детей с РПП ослаблено. Клинические проявления могут выглядеть как сильная эмоциональная реакция, крик, особенно при введении новой пищи или предложении еды, которая им не нравится, например, отталкивание еды, поворот головы, вставание из-за стола, бросание еды и агрессивное поведение. Однако именно данные варианты РПП могут быть проявлением серьезного заболевания у ребенка: целиакии, пищевой аллергии, эозинофильного поражения органов ЖКТ как у неврологически здоровых, так и у детей с поражением ЦНС.
Представлены клинические случаи, родители пациентов подписали добровольное информированное согласие на обработку данных и их публикацию.
Клинический случай 1
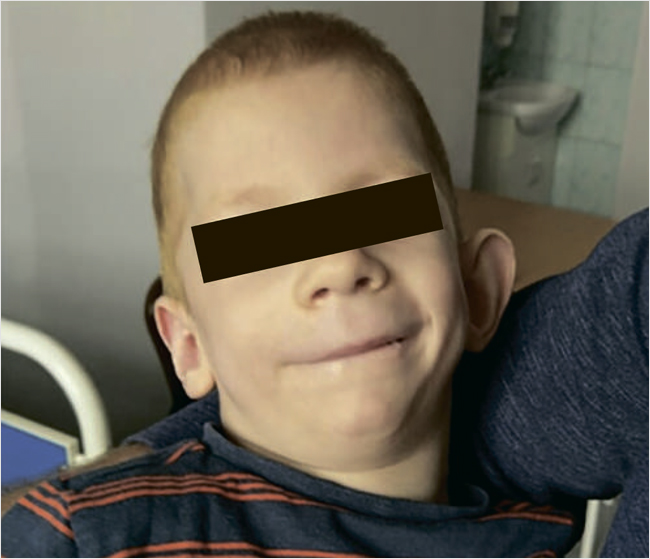
Мальчик Н., 11 лет (рис. 1). Жалобы при обращении на недостаточность питания – вес 4 800 г. Подкожно-жировой слой фактически отсутствует. SDS роста – 9,29, SDS веса –25,34, BMI SDS – 7,4.
Рисунок 1. Мальчик Н., 11 лет

Анамнез жизни. Ребенок от второй беременности (первый ребенок здоров), протекавшей на фоне ОРВИ в I триместре, ЖДА во II–III триместре, многоводия по результатам УЗИ в III триместре.
От вторых срочных родов (39–40 нед.) путем КС (выпадение петель пуповины). Апгар 5/6 баллов. Вес 3 100 г, длина 51 см.
Крайне тяжелое течение неонатального периода: Острая асфиксия в родах. Гипоксически-ишемическое поражение ЦНС. Судорожный синдром. Отек вещества головного мозга.
С рождения наблюдается неврологом с тяжелым органическим поражением ЦНС. ДЦП: двойная гемиплегия, бульбарно-псевдобульбарный синдром. Грубая задержка ПМР.
Анамнез заболевания. С раннего возраста жалобы на отсутствие прибавки массы тела – вес не превышал 6,8 кг, крайне низкие темпы роста, не сидит, не ползает, не переворачивается, активной речи нет, аппетит сохранен, однако объем питания снижен, не более 600 мл/сут.
Коррекция питания. В анамнезе неоднократно предпринимались попытки коррекции питания с применением высокобелковых, высококалорийных смесей (Клинутрен, Нутрини), на этом фоне – снижение веса, снижение аппетита, отказ от еды, крик.
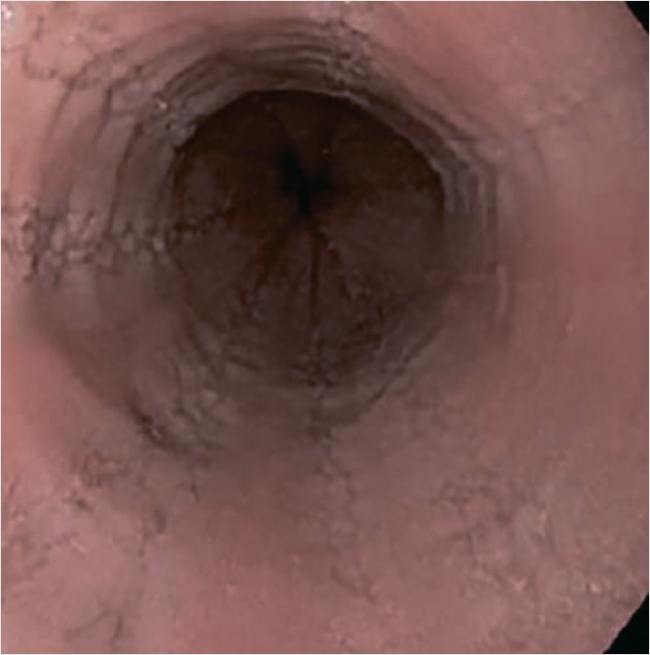
Эзофагогастродуоденоскопия (ЭГДС): недостаточность кардии. Умеренная деформация просвета пищевода (вероятно, за счет деформации позвоночника). Бульбит. Дуоденит (рис. 2). По данным морфологии – эозинофильная инфильтрация в средней и нижней трети пищевода до 10–12 в поле зрения.
Рисунок 2. Эзофагогастродуоденоскопия, мальчик Н., 11 лет
Рекомендации по терапии и питанию. Рекомендовано продолжить зондовое кормление аминокислотной смесью, увеличив разовое кормление до 120 мл, суточный объем – до 900 мл = 900 ккал/сут. Показана постановка гастростомы и оформление паллиативного статуса.
Комментарии
Ребенок. Ограничивающие факторы кормления у ребенка – это серьезная неврологическая симптоматика, отсутствие навыков приема пищи, невозможность есть из ложки. В связи с патологией ЦНС ребенок питается через соску или через зонд. С раннего возраста нарастает белково-энергетическая недостаточность, которая усугубляется с возрастом.
Мама. Отсутствие навыков кормления ребенка с органическим поражением ЦНС, недостаточность знаний в потребностях макрои микронутриентов у детей с ДЦП.
Педиатр. Недооценка соматического статуса ребенка с органическим поражением ЦНС и рисков осложнений, отсутствия эффективности применения высококалорийных специализированных продуктов в питании ребенка.
При проведении обследования у ребенка выявлена умеренная эозинофильная инфильтрация пищевода эозинофилами до 10–12 в поле зрения, что не является диагностически достаточным для постановки диагноза «эозинофильный эзофагит». Критерии диагностики эозинофильного эзофагита (ЭоЭ) – инфильтрация выше 15 эозинофилов в поле зрения [24, 25].
Однако, учитывая ограниченный и безмолочный рацион ребенка и периодически использование глюкокортикоидов, количество эозинофилов может быть ниже порогового значения.
Эозинофильное поражение пищевода на данный момент расценивается как поздний вариант атопического марша наряду с аллергическим ринитом, бронхиальной астмой, атопическим дерматитом и пищевой аллергией [26].
В рационе ребенку введена аминокислотная смесь для детей старше года – Неокейт Джуниор, что является клинически эффективным вариантом лечения детского ЭоЭ [27].
Суточный объем смеси 900 мл = 900 ккал/сут, что является недостаточным для полной коррекции нутритивной и микроэлементной недостаточности. При этом через 4 мес. прибавка в массе 1 кг, поставлена гастростома.
Дополнительно будесонид 1 000 мкг/сут в 2 приема на носителе (сироп агавы) – курс 12 нед.
Эффекты коррекции терапии и питания. Через год вес 12,5 кг, стал более спокойным, при предложении питания открывает рот, при глотании не беспокоится, ребенок стал улыбаться на обращение к нему родителей (рис. 3).
Рисунок 3. Мальчик Н. через год после лечения
Клинический случай 2
Девочка М., 7 мес. Жалобы на снижение аппетита, отказ от еды, отсутствие пищевого интереса и жажды (со слов мамы, не просит даже воду), срыгивания на фоне кормления, употребления воды и сосания соски, эпизоды отрыжки во время еды.
Анамнез жизни. Ребенок от второй беременности, протекавшей на фоне токсикоза I триместра, гипотиреоза и приема левотироксина, железодефицитной анемии. Роды срочные, самостоятельные, вторые, без осложнений. Масса при рождении 3 370 г, рост 53 см, оценка по Апгар 8/9 баллов.
Анамнез заболевания. Со слов мамы, с первой недели жизни ребенок плохо берет грудь, сосание вялое, во время сосания выгибается, плачет, бросает грудь. Мама перевела ребенка на искусственное вскармливание самостоятельно. Смесь молочная стандартная, однако ребенок от смеси отказывался, мама кормила только во сне. В кале появилась слизь и кровь периодически, в копрограмме белок +++, скрытая кровь +++.
За первый месяц жизни прибавка 1 000 г, за второй месяц 950 г – вариант возрастной нормы прибавки в массе. При этом мама очень насторожена, нервная, считает, что ребенок ест плохо, нет пищевого интереса. В 2,5 мес. самостоятельно установила ребенку назогастральный зонд и кормила так до 7 мес. Прибавка в массе: 3 мес. – 840 г, 4 мес. – 665 г, 5 мес. – 510 г, 6 мес. – 420 г, 7 мес. – 305 г. Последние 3 мес. зонд стоит постоянно, мама его переставляет один раз в неделю, но без зонда ребенок совсем не находится. Даже через зонд ребенок отказывается от еды, срыгивания нарастают, кричит во время кормлений. Мама предлагает ребенку еду: кашу, овощи или фрукты – даже в руки не берет, сразу плачет.
Семейный анамнез. Старший ребенок 3 лет, с раннего возраста отказ от еды, беспокойство, ребенок до года питался через назогастральный зонд. В возрасте 1 года диагностирована пищевая аллергия к белку коровьего молока. В стационаре ребенку проведена колоноскопия, выявлен эозинофильный колит. Девочка переведена на специализированное питание аминокислотной смесью, на фоне чего улучшение состояния.
Мама. Женщина в постоянном эмоциональном напряжении, постоянно плачет, ведет строго пищевой дневник, считает, что дети имеют нарушение пищевого поведения и накормить их можно только через зонд.
Маме проведена консультация психиатра: обсессивно-компульсивное расстройство (психическое расстройство, которое характеризуется наличием в клинической картине навязчивых мыслей и навязчивых действий).
ЭГДС. Эрозия в пищеводе (с большей вероятностью на фоне длительного стояния зонда), эзофагит, гастрит, дуоденит (рис. 4).
Рисунок 4. Эзофагогастродуоденоскопия, девочка М., 7 мес. Линейная эрозия в нижней трети пищевода
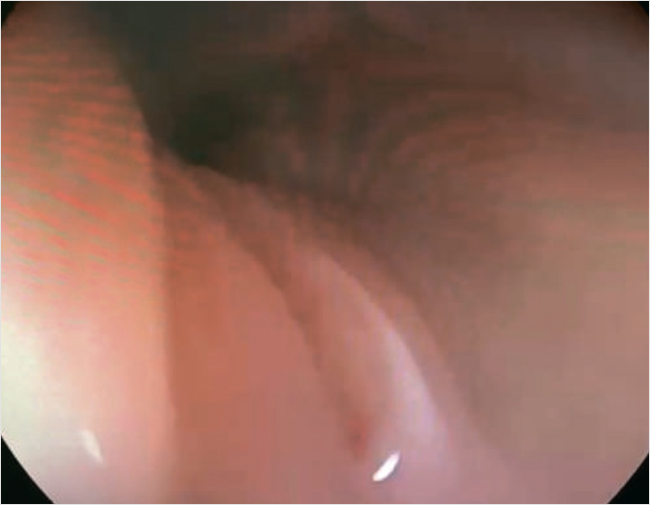
Морфологически: в пищеводе эозинофильной инфильтрации не выявлено, воспалительные изменения всей глубины слизистого слоя. Эозинофильная инфильтрация в двенадцатиперстной кишке до 50 эозинофилов в поле зрения. В желудке до 5 эозинофилов в поле зрения.
Коррекция питания. Назогастральный зонд удален под слезы мамы и ее отчаяние. В питание введена смесь на основе аминокислот Nutrilon Аминокислоты Syneo. Данный продукт специально разработан для диетического питания младенцев с аллергией на коровье молоко, множественной пищевой аллергией и связанными с этим желудочно-кишечными и аллергическими состояниями, включая синдром энтероколита, вызванного пищевым белком (FPIES), эозинофильный эзофагит и гастроэзофагеальный рефлюкс.
Терапия. Глюкокортикостероиды в дозе 0,8 мг/кг массы тела 3 дня парентерально, далее перорально топический стероид в дозе 300 мкг 3 раза в день на носителе (сироп агавы) каждые 8 ч.
Комментарии
Ребенок. Девочка с семейным отягощенным анамнезом по пищевой аллергии, с ранней сенсибилизацией отказывается от еды в связи с аллергическим воспалением слизистой пищевода, желудка и двенадцатиперстной кишки. Желудочно-пищеводные расстройства являются одним из проявлений аллергии к белку коровьего молока.
Мама. В связи с повышенной материнской ответственностью и анамнезом первого ребенка у женщины сформировался доминантный комплекс вины с дальнейшим развитием обсессивно-компульсивного расстройства с проявлением навязчивых мыслей (обсессий) и действий (компульсий). Исследования показали, что послеродовая депрессия матери отрицательно влияет на пищевое поведение ребенка и может иметь длительные негативные последствия для здоровья.
Педиатр. Недооценка минимальных пищеварительных дисфункций у ребенка раннего возраста с отягощенным семейным анамнезом. Ребенку назначена молочная формула мамой самостоятельно, однако педиатром формула не заменена на лечебную. Маме не даны рекомендации по вскармливанию ребенка.
Использование специализированных продуктов на основе аминокислот позволяет восстановить нутритивный, микроэлементный и витаминный статус детей с РПП на фоне аллергического (эозинофильного) поражения ЖКТ. Современные продукты с дополнительными компонентами в виде синбиотика – смеси прои пребиотика, которые могут взаимно дополнять благоприятные эффекты друг друга или оказывать синергический эффект, способны влиять на дисбиоз кишечника. Синбиотический комплекс позволяет восстановить баланс микробиоты, приводит к нормализации иммунного ответа. В данном случае использована лечебная смесь Nutrilon Аминокислоты Syneo — это полноценная смесь на основе аминокислот с Bifidobacterium breve M-16V и фруктоолигосахаридами. Штамм Bifidobacterium breve M-16V — один из наиболее частых пробиотических штаммов грудного молока, который был выделен из кишечника здорового ребенка. Доказана его безопасность и эффективность для различных возрастных групп, включая недоношенных новорожденных с низкой массой тела.
Эффект терапии первые 7 дней в стационаре. Первые 3 дня ребенок отказывался от еды, отталкивал соску, отворачивался. Бутылочку завернули в красную варежку, и ребенок стал более спокойно относиться к предложению еды. Очень медленно через ложку, пипетку или через соску стала есть смесь. Прибавка за 7 дней 250 г.
Клинический случай 3
Мальчик Я., 11 мес. (рис. 5). Жалобы на беспокойство, больше в вечернее и ночное время, стал часто просыпаться. Появились срыгивания, икота, периоды вздутия живота.
Рисунок 5. Мальчик Я., 11 мес.
Анамнез жизни. Беременность первая, протекала физиологично, роды самостоятельные, срочные, 18 ч. Вес при рождении 3 350 г, рост 50 см. К груди приложен до перерезания пуповины. Вскармливание грудное до 4 мес.
Анамнез заболевания. До 2,5–3 мес. отмечались младенческие колики, больше в вечернее время. Интенсивные приступы беспокойства у ребенка мама отмечала на фоне своих стрессов. К двум месяцам усиление колик совпадало с введением в питание мамы свежего или сгущенного молока. На этом фоне в кале малыша примесь слизи и прожилок крови однократно.
Обратились к педиатру.
Назначения:
1) диета мамы с исключением красных продуктов, цельного молока, свежего хлеба,
2) ребенку: Эспумизан бэби, пробиотик, нифуроксозид, энтеросорбент.
Эффекта от назначений мало. Колики сохраняются, больше в вечернее и ночное время.
По назначению гастроэнтеролога в питании мамы полностью исключены все продукты, содержащие говядину и молоко коровы и козы. Самостоятельно мама еще исключила из своего рациона глютен.
К 4 мес. состояние улучшилось значительно. Стул без патологических примесей, развитие ребенка по возрасту, срыгиваний нет. Колики редкие, только при перемене погоды.
В 4,5 мес. в питание ввели овощное пюре (брокколи, картофель, цветную капусту). Стул стал до 4–5 раз в сутки, зеленоватого цвета. За месяц прибавка в массе 650 г.
В 5 мес. в питание введена каша овсяная безмолочная, в 6 мес. — мультизлаковая каша безмолочная, в 8,5 мес. — баранки, хлебные палочки. С 8 мес. интенсивное беспокойство, вздутие живота, появился жидкий стул, со слов мамы, объемом больше, чем объем съеденной пищи (рис. 6, 7).
Рисунок 6. Консистенция и цвет кала мальчика Я., 8,5 мес.
Рисунок 7. Схема ведения пищевого дневника, мальчик Я.
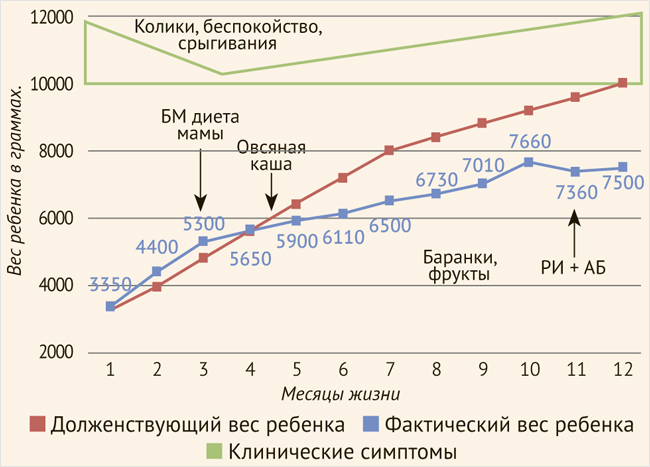
БМ – белок молока; РИ – респираторная инфекция; АБ – антибактериальная терапия.
Лабораторные данные. Анемия гипохромная, железодефицитная легкой степени тяжести (Hb 99 г/л, цв. показатель 0,78, формула не изменена, железо сывороточное 4,4 мкмоль/л). В копрограмме: йодофильная флора +++, слизь ++, жирные кислоты ++.
Ультразвуковое исследование (УЗИ). УЗИ желудка с функциональной сифонной пробой проведено с молочным продуктом: регистрируется гастроэзофагеальный рефлюкс до 1/3 пищевода при использовании воды и не нарастает при использовании молочного продукта, толщина слизистой не нарастает при контакте с молочным белком. Это позволяет сделать вывод, что реакция на молочный продукт отсутствует.
ЭГДС. Слизистая пищевода, желудка не изменена, в двенадцатиперстной кишке атрофия слизистой, единичные петехии. Морфологически атрофия слизистой двенадцатиперстной кишки 3С по Марш.
Дополнительно анализ крови: АТ к тканевой трансглутаминазе Ig A > 200 (норма < 20), Ig G > 20 (норма < 20).
Данные обследования подтвердили диагноз «целиакия».
Коррекция питания. В рационе полностью исключены все продукты, содержащие глютен. За 6 мес. прибавка в весе не более 350 г. При этом стул наладился, колик и вздутия живота не отмечено, сон спокойный. Аппетит избирательный, очень капризен, от специализированного безглютенового питания отказывается.
Комментарии
Ребенок. Избирательность в питании до назначения безглютенового рациона имеет несколько причин: воспаление в двенадцатиперстной кишке, дискомфорт от приема пищи у ребенка раннего возраста, железодефицитная анемия (ЖДА), нарушение правил кормления ребенка (бегает с едой по всей квартире, за столом не сидит), гиперреактивность.
В литературе описаны данные развития ЖДА у детей, которые имеют избирательный аппетит и не едят мясо, и варианты отказа от приема мяса на фоне уже резвившейся ЖДА [28, 29].
Мама. Мама после прекращения грудного вскармливания вышла на работу. Ребенок находится с бабушкой, которая всеми силами пытается накормить ребенка и идет ему навстречу – разрешает есть на улице, бегать с едой по квартире, есть только то, что ребенок хочет. Нет четкого режима питания и сна. Когда в выходные мама пытается наладить режим, в семье конфликт. Мама получает антидепрессанты.
Педиатр. Доктор расценила нарастание колик и нарушение сна после 4 мес. как вариант воспаления в ЖКТ, направила ребенка на обследование. Однако по настоянию бабушки обследование проведено только спустя 2,5 мес. от получения направления.
Коррекция питания. Ребенок получает правильное питание без глютена, строго. Ребенок входит в регистр детей с целиакией, и родители прошли обучение по организации питания.
Учитывая недостаточную прибавку в массе, дефицитные состояния (дефицит витамина Д, железа, цинка) и избирательность в питании, необходимо ввести в рацион специализированные продукты питания с повышенной калорийностью, не содержащие глютен.
Комментарии по питанию
В питание введена дополнительно смесь Нутринидринк (Nutrinidrink) с пищевыми волокнами («Нутриция»). Специализированный продукт для детского лечебного питания содержит комплекс растворимых и нерастворимых пищевых волокон MF6. Комплекс пищевых волокон способствует правильному развитию кишечной микробиоты, снижению риска возникновения инфекций, формированию иммунитета, нормализации перистальтики и частоты стула. Высокое содержание белка и калорий позволяет в небольшом объеме питания компенсировать дефициты нутриентов.
Смесь эссенциальных жирных кислот ω6:ω3 для оптимизации развития и функционирования ЦНС и органа зрения, макро- и микроэлементы, витамины, биологически активные вещества для оптимального роста ребенка и антиоксидантной защиты – данный вариант продукта подходит для ребенка с 1 года, т.к. не содержит лактозу, глютен, холестерин и генетически модифицированные компоненты. Смесь высококалорийная, на 100 мл смеси приходится 153 ккал, следовательно, из 400 мл продукта ребенок получит 600 ккал, т. е. ½ суточного рациона. При этом продукт полностью полноценный для развития ребенка.
Заключение
На нескольких клинических примерах мы показали, что отказ от еды ребенком может оказаться первым проявлением серьезной патологии и требует полного диагностического поиска.
Первым шагом является базовая медицинская оценка:
- сбор анамнеза, оценка физического развития,
- наблюдение за процессом кормления,
- планирование диагностических тестов.
Еще одним важным шагом является пищевой дневник, который ведет мама от 3 до 7 дней, по которому можно оценить не только набор продуктов (детское или недетское питание предлагают ребенку), но и пищевую ценность суточного рациона.
Наблюдение должно проводиться многопрофильной командой, включающей педиатра, по возможности диетолога и психолога. Важно работать с родителями ребенка и близкими родственниками, если они проживают совместно с ребенком. Несколько итальянских исследований показали, что тандем «мать – ребенок» в процессе организации питания детей с РПП менее эффективен, чем трио «мать – ребенок – отец» [30, 31].
Родительский психотип является значимым предиктором неадаптивных поведенческих реакций у их детей и формирует долгосрочные эффекты на нейронные системы, ответственные за регуляцию стресса, эмоциональную функцию и нейропластичность детей [32]. Предположительно эпигенетические механизмы, на которые влияет качество родительского ухода, могут опосредовать связь между родительской психопатологией и развитием депрессивных состояний у их детей в подростковом возрасте. Тесное взаимодействие родителей и ребенка с РПП имеет основополагающее значение для эмоциональной и поведенческой регуляции у детей, тем самым выступая в качестве защитного фактора против развития неадаптивных симптомов [33].
Основным положительным фактором в организации питания детей с РПП является введение в рацион специализированных продуктов лечебного питания с учетом соматической патологии в каждом конкретном случае.
Выбор смеси для питания ребенка зависит от выявленного заболевания. Так, для детей с тяжелыми формами пищевой аллергии и эозинофильным поражением органов ЖКТ основным продуктом являются аминокислотные смеси. Для детей первого года жизни целесообразно использовать Неокейт LCP — специализированную смесь с длинноцепочечными полиненасыщенными жирными кислотами для диетического лечебного питания c рождения детей с аллергией и пищевой непереносимостью в тяжелых формах. Смесь имеет полноценный, сбалансированный состав, который приближен к грудному молоку для обеспечения нормального роста и развития малыша. Неокейт LCP не содержит белок, лактозу, фруктозу, сахарозу, глютен, холестерин и генетически модифицированные компоненты. Для детей от 1 до 10 лет у компании «Нутриция» разработана формула Неокейт Джуниор – специализированный продукт диетического лечебного питания на основе аминокислот с нейтральным вкусом. Формула содержит витамины и микроэлементы. Данный вариант лечебного питания можно использовать у детей с пищевой поливалентной аллергией и эозинофильным поражением ЖКТ, при синдроме короткой кишки, синдроме мальабсорбции у детей с целиакией, аутоиммунным энтеритом, хроническим энтероколитом, панкреатитом и др.
Смесь Nutrilon Аминокислоты Syneo – специализированный продукт для лечебного питания детей с тяжелой пищевой и поливалентной пищевой аллергией. Смесь содержит уникальный запатентованный комплекс Syneo, который состоит из пробиотиков и пребиотиков, схожих с синбиотиками грудного молока. Клинически доказано, что смесь облегчает симптомы тяжелой аллергии, укрепляет иммунитет, способствует восстановлению микробиоты кишечника, поддерживает нормальный рост, снижает частоту инфекционных заболеваний.
В питании детей старше 1 года с недостаточностью питания, у которых отсутствует аллергия к белкам коровьего молока, может быть использована смесь Нутринидринк (Nutrinidrink) с пищевыми волокнами. Формула без лактозы и глютена содержит повышенное количество белка и энергии, а также все необходимые нутриенты в небольшом объеме. Нутринидринк (Nutrinidrink) с пищевыми волокнами обеспечивает снижение нутритивного дефицита, улучшает показатели роста ребенка, облегчает симптомы со стороны ЖКТ за счет пищевых волокон и хорошо переносится у детей с непереносимостью лактозы и глютена.
Список литературы / References
Развернуть
- Lindberg L, Bohlin G, Hagekull B. Early feeding problems in the normal population. Int J Eat Disord. 1991;10(4):395–405. doi: 10.1002/1098-108X(199107)10:4%3c395::AID-EAT2260100404%3e3.0.CO;2-A.
- Rybak A. Organic and Nonorganic Feeding Disorders. Ann Nutr Metab. 2015;66(Suppl. 5):16–22. doi: 10.1159/000381373.
- Павловская ЕВ. Нарушения пищевого поведения у детей раннего возраста: современные подходы к диагностике и коррекции. Медицинский совет. 2021;(17):32–39. doi: 10.21518/2079-701X-2021-17-2. / Pavlovskaya EV. Feeding disorders in children: modern approaches to diagnosis and management. Meditsinskiy Sovet. 2021;(17):32–39. (In Russ.) doi: 10.21518/2079-701X-2021-17-2.
- Jamroz E, Głuszkiewicz E, Grzybowska-Chlebowczyk U, Woś H. Feeding problems in children with neurological disorders. Wiad Lek. 2012;65(2):77–83. Available at: https://pubmed.ncbi.nlm.nih.gov/.
- Aldridge WC, Dovey TM, Martin CI, Meyer K. Identifying clinically significant feeding problems and disorders. J Child Health Care. 2010;14:261–270. doi: 10.1177/1367493510370456.
- Schedler G, Suess-Burghart H, Toschke AM, von Voss H, von Kries R. Feeding disorders in premature infants: causes – response to therapy - long-term results. European Journal of Pediatrics. 2007;166:803–808. doi: 10.1007/s00431-006-0322-x.
- Баранов АА, Тутельян ВА. Программа оптимизации вскармливания детей первого года жизни в Российской П78 Федерации. М.; 2019. 112 с. Режим доступа: https://nczd.ru/.
- Current estimates from the National Health Interview Survey. United States. 1983. Vital Health Stat 10. 1986;(154):1–182. Available at: https://pubmed.ncbi.nlm.nih.gov/.
- Goday PS, Huh SY, Silverman A, Lukens CT, Dodrill P, Cohen SS et al. Pediatric Feeding Disorder: Consensus Definition and Conceptual Framework. J Pediatr Gastroenterol Nutr. 2019;68(1):124–129. doi: 10.1097/MPG.0000000000002188.
- Uher R, Rutter M. Classification of feeding and eating disorders: review of evidence and proposals for ICD-11. World Psychiatry. 2012;11(2):80–92. doi: 10.1016/j.wpsyc.2012.05.005.
- Goday PS, Huh SY, Silverman A, Lukens CT, Dodrill P, Cohen SS et al. Pediatric Feeding Disorder: Consensus Definition and Conceptual Framework. J Pediatr Gastroenterol Nutr. 2019;68(1):124–129. doi: 10.1097/MPG.0000000000002188.
- Noel RJ, Putnam PE, Rothenberg ME. Eosinophilic esophagitis. N Engl J Med. 2004;351(9):940–941. doi: 10.1056/NEJM200408263510924.
- Jadcherla S. Dysphagia in the high-risk infant: potential factors and mechanisms. Am J Clin Nutr. 2016;103(2):622S–8S. doi: 10.3945/ajcn.115.110106.
- Sharp WG, Berry RC, McCracken C, Nuhu NN, Marvel E, Saulnier CA et al. Feeding problems and nutrient intake in children with autism spectrum disorders: a meta-analysis and comprehensive review of the literature. J Autism Dev Disord. 2013;43(9):2159–2173. doi: 10.1007/s10803-013-1771-5.
- Ammaniti M, Lucarelli L, Cimino S, D’Olimpio F, Chatoor I. Feeding disorders of infancy: a longitudinal study to middle childhood. Int J Eat Disord. 2012;45(2):272–280. doi: 10.1002/eat.20925.
- Sharp WG, Berry RC, McCracken C, Nuhu NN, Marvel E, Saulnier CA et al. Feeding problems and nutrient intake in children with autism spectrum disorder: a meta-analysis and comprehensive review of the literature. J Autism Dev Disord. 2013;43(9):2159–2217. doi: 10.1007/s10803-013-1771-5.
- Rybak A. Organic and Nonorganic Feeding Disorders. Ann Nutr Metab. 2015;66(Suppl. 5):16–22. doi: 10.1159/000381373.
- Баранов АА, Тутельян ВА. Программа оптимизации питания детей в возрасте от 1 года до 3 лет в Российской Федерации. М.; 2019. 36 с. Режим доступа: https://nczd.ru/.
- De Toro V, Aedo K, Urrejola P. Trastorno de Evitación y Restricción de la Ingesta de Alimentos (ARFID): Lo que el pediatra debe saber [Avoidant/Restrictive Food Intake Disorder (ARFID): What the pediatrician should know]. Andes Pediatr. 2021;92(2):298–307. (In Spanish) doi: 10.32641/andespediatr.v92i2.2794.
- Bryant-Waugh R, Markham L, Kreipe RE, Walsh BT. Feeding and eating disorders in childhood. Int J Eat Disord. 2010;43(2):98–111. doi: 10.1002/eat.20795.
- Milano K, Chatoor I, Kerzner B. A Functional Approach to Feeding Difficulties in Children. Curr Gastroenterol Rep. 2019;21(10):51. doi: 10.1007/s11894-019-0719-0.
- Kreipe RE, Palomaki A. Beyond picky eating: avoidant/restrictive food intake disorder. Curr Psychiatry Rep. 2012;14(4):421–431. doi: 10.1007/s11920-012-0293-8.
- Kambanis PE, Kuhnle MC, Wons OB, Jo JH, Keshishian AC, Hauser K et al. Prevalence and correlates of psychiatric comorbidities in children and adolescents with full and subthreshold avoidant/restrictive food intake disorder. Int J Eat Disord. 2020;53(2):256–265. doi: 10.1002/eat.23191.
- Ивашкин ВТ, Маев ИВ, Трухманов АС, Андреев ДН, Лапина ТЛ, Баранская ЕК и др. Клинические рекомендации российской гастроэнтерологической ассоциации по диагностике и лечению эозинофильного эзофагита. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2018;28(6):84–98. doi: 10.22416/1382-4376-2018-28-6-84-98. / Ivashkin VT, Maev IV, Trukhmanov AS, Lapina TL, Andreev DN, Baranskaya EK et al. Clinical Guidelines of the Russian Gastroenterological Association on the Diagnostics and Treatment of Eosinophilic Esophagitis. Russian Journal of Gastroenterology, Hepatology, Coloproctology. 2018;28(6):84–98. (In Russ.) doi: 10.22416/1382-4376-2018-28-6-84-98.
- Драпкина ОМ, Кайбышева ВО, Кашин СВ, Куваев РО, Лохматов ММ, Макарова СГ и др. Эозинофильный эзофагит: клинические рекомендации. 2022. Режим доступа: https://www.rnmot.ru/.
- Hill DA, Grundmeier RW, Ramos M, Spergel JM. Eosinophilic Esophagitis Is a Late Manifestation of the Allergic March. J Allergy Clin Immunol Pract. 2018;6(5):1528–1533. doi: 10.1016/j.jaip.2018.05.010.
- Atwal K, Hubbard GP, Venter C, Stratton RJ. The use of amino acid-based nutritional feeds is effective in the dietary management of pediatric eosinophilic oesophagitis. Immun Inflamm Dis. 2019;7(4):292–303. doi: 10.1002/iid3.273.
- Moshe G, Amitai Y, Korchia G, Korchia L, Tenenbaum A, Rosenblum J, Schechter A. Anemia and iron deficiency in children: association with red meat and poultry consumption. J Pediatr Gastroenterol Nutr. 2013;57(6):722–727. doi: 10.1097/MPG.0b013e3182a80c42.
- López-Ruzafa E, Vázquez-López MA, Galera-Martínez R, Lendínez-Molinos F, Gómez-Bueno S, Martín-González M. Prevalence and associated factors of iron deficiency in Spanish children aged 1 to 11 years. Eur J Pediatr. 2021;180(9):2773–2780. doi: 10.1007/s00431-021-04037-8.
- Brytek-Matera A, Ziółkowska B, Ocalewski J. Symptoms of Avoidant/Restrictive Food Intake Disorder among 2-10-Year-Old Children: The Significance of Maternal Feeding Style and Maternal Eating Disorders. Nutrients. 2022;14(21):4527. doi: 10.3390/nu14214527.
- Lucarelli L, Ammaniti M, Porreca A, Simonelli A. Infantile Anorexia and Co-parenting: A Pilot Study on Mother-Father-Child Triadic Interactions during Feeding and Play. Front Psychol. 2017;8:376. doi: 10.3389/fpsyg.2017.00376.
- Cerniglia L. An Update on the Special Issue “Parent-Child Interactions: Paths of Intergenerational Transmission of Psychopathological Risk”. Int J Environ Res Public Health. 2024;21(3):328. doi: 10.3390/ijerph21030328.
- Niu L, Brown J, Hoyt L, Salandy A, Nucci-Sack A, Shankar V et al. Profiles of childhood maltreatment: associations with risky sexual behavior in adolescence age using girls from racial/ethnic minorities. Child Dev. 2021;92:1421–1438. doi: 10.1111/cdev.13498.








