Язвенная болезнь широко распространена и в развитых странах встречается у 3-5% взрослого населения. У мужчин язвенная болезнь наблюдается чаще, чем у женщин. В последнее время снизить распространенность этого заболевания позволили новые методы диагностики и успешное лечение хеликобактериальной инфекции.
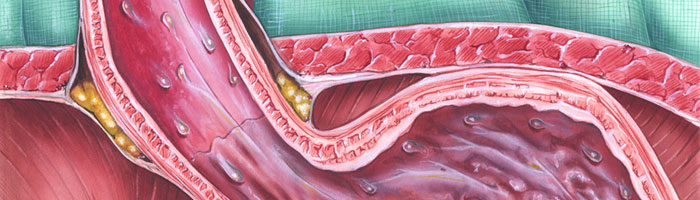
Язвы разрушают не только слизистую оболочку, но и расположенную под ней мышечную ткань. Серьезными осложнениями язвенной болезни являются кровотечения, прободение и перитонит (воспаление брюшины).
Язвы разрушают не только слизистую оболочку, но и расположенную под ней мышечную ткань.
Данное заболевание имеет склонность к рецидивирующему течению и сезонным обострениям. Существенно изменяют клиническую картину различного рода осложнения (кровотечения, воспалительный процесс, прободение язвы, стеноз привратника, злокачественное перерождение, реактивный гепатит и др.).
Патогенез язвенной болезни
Причинами язвенной болезни являются стрессы, нарушение питания, курение, алкоголизм, действие химических и токсических веществ и др. Однако в настоящее время основной причиной этого заболевания считают инфекцию Helicobacter pylori (Н.р.). На рисунке 1 представлена картина распространения Н.р. инфекции на 100 000 человек населения.
H.р. – этиологический фактор, который у большинства пациентов с пептической язвой в зрелом возрасте может приводить к развитию рака желудка (рис. 2). Инфекция Н.р. обычно приобретается в детстве. Острая инфекция Н.р. вызывает переходный процесс hypochlorhydria и диагностируется редко. Практически у всех инфицированных Н.р. развивается хронический гастрит, но в 80-90% случаев он не имеет клинических признаков. Дальнейшее развитие инфекции зависит от бактериальной флоры инфицированного. У пациентов с более высокой кислотной продукцией возможно развитие гастрита в антральном отделе желудка, а затем дуоденальной язвы. Пациенты с более низкой кислотной продукцией склонны к гастриту в теле желудка, предрасполагающему к развитию язвы желудка, в редких случаях приводящей к желудочной карциноме.
Инфекция Н.р. также вызывает формирование лимфатической ткани в желудочной слизистой оболочке (MALT), приводящей к злокачественной лимфоме.
Практически у всех инфицированных Н.р. развивается хронический гастрит, но в 80–90% случаев он не имеет клинических признаков.
H.р. образуют колонии в желудке (рис. 3). Метод передачи H.р. пока неясен, но предполагается, что распространение от человека к человеку происходит фекально-оральным путем. Распространенность H.р. у взрослых пациентов зависит от социально-экономического статуса. Также считается, что инфекция H.р. может передаваться через воду при купании в бассейне.
Причиной язвенной болезни также является нарушение механизмов, регулирующих секреторную, двигательную функции желудка и двенадцатиперстной кишки, кровообращение в них, питание слизистых оболочек. Образование язвы в желудке или двенадцатиперстной кишке является следствием расстройств указанных выше функций. Также часто к развитию язвенной болезни приводят отрицательные эмоции, длительные психические перенапряжения, патологические импульсы из пораженных внутренних органов при хроническом аппендиците, хроническом холецистите, желчнокаменной болезни и др. Определенную роль играют гормональные нарушения и наследственные факторы (наследственная предрасположенность встречается в 15-40% случаев). Язва формируется в результате нарушения равновесия между факторами риска (Н.р., соляная кислота, пепсин, НПВП) и факторами защиты (бикарбонаты, простагландины, желудочная и дуоденальная слизь, клеточная регенерация, нормальное состояние местного кровотока, защитное действие некоторых гормонов, а также щелочная реакция слюны и панкреатического сока) (рис. 4).
Важную роль в формировании язв в желудке играет уменьшение защитных свойств слизистой оболочки, ослабление ее сопротивляемости повреждающему воздействию кислого желудочного сока. В механизме развития язв в выходном отделе желудка, особенно в двенадцатиперстной кишке, решающим фактором является усиление агрессивности желудочного сока. Предрасполагающими факторами являются нарушения режима питания, злоупотребление острой, грубой, раздражающей пищей, употребление крепких спиртных напитков и их суррогатов, курение.
Лечение язвенной болезни
Наиболее эффективными антисекреторными средствами, применяемыми для лечения кислотозависимых заболеваний желудка, являются ингибиторы протонной помпы. Препараты этой группы дозозависимым образом угнетают базальную и стимулированную секрецию соляной кислоты в желудке путем ингибирования Н+/К+-аденозинтрифосфатазы (АТФазы), известной также как протонная помпа, локализованная на высококислой поверхности обкладочной клетки, обращенной в просвет желудочных желез [1]. В кислой среде ингибиторы протонной помпы присоединяют протоны и преобразуются в циклические сульфенамиды. Эти активные метаболиты ковалентно связываются с Н+/К+-АТФазой и в результате необратимо угнетают активность протонной помпы. Таким образом, ингибиторы протонной помпы вызывают выраженное угнетение секреции соляной кислоты, продолжающееся в течение более длительного периода, чем время их наличия в плазме крови. В связи с необратимым характером ингибирования восстановление действия Н+/К+-АТФазы требует синтеза протонной помпы de novo [2]. У пациентов с положительными результатами тестов на H.p. после прекращения приема ингибитора протонной помпы обычно не возникает рикошетная гиперсекреция, хотя она была отмечена у пациентов после эрадикации H.p. [3].
Наиболее эффективными антисекреторными средствами, применяемыми для лечения кислотозависимых заболеваний желудка, являются ингибиторы протонной помпы.
Пантопразол (PAN) является необратимым ингибитором протонного насоса (H+/K+-аденозинтрифосфотазы — H+/K+-ATФазы) (ИПН) группы замещенных бензимидазолов, уменьшающих секрецию соляной кислоты париетальными клетками желудка [1,2]. В данной статье представлен обзор фармакологических свойств и терапевтической эффективности пантопразола в лечении кислотозависимых заболеваний [3] и рассмотрена роль тройной терапии, в схему которой входит пантопразол, в эрадикации H.p.
При приеме п/о пантопразола 20–40 мг/сут в течение 5–7 дней отмечалось дозозависимое снижение базальной, ночной и 24-часовой желудочной секреции соляной кислоты [3].
Оптимальное ингибирование секреции соляной кислоты достигается при п/о приеме 40 мг PAN утром по сравнению с приемом препарата вечером (19.00) в той же дозе [5]. Длительное действие при приеме п/о PAN 40 мг/сут (медиана внутрижелудочного pH в течение 24 ч составляет 4,2) [6]. После повторного приема PAN в дозе 40 мг/сут ингибирование секреции соляной кислоты: сходно с таковым при приеме п/о OMP 40 мг/сут [7,8]; больше, чем таковое при приеме OMP MUPS 20 мг/сут [9,10]; меньше или сходно с таковым при приеме п/о LAN 30 мг/сут [11–14] или ESO 40 мг/сут [15-16] и больше, чем при приеме п/о RAN 300 мг/сут [6] или OMP 20 мг/сут [17-19].
Пантопразол (Контролок) в/в
Отмечено одинаковое уменьшение максимальной кислотопродукции [23] и повышение желудочного pH, среднего 24-часового pH и среднего процента 24-часового цикла, при котором желудочный pH был ?4 или ?3, при в/в или п/о применении PAN в одинаковой дозе [24]. Наблюдалось дозозависимое угнетение пентагастр-индуцированной секреции соляной кислоты при в/в введении PAN в дозе 20–120 мг [25].
Время до начала ингибирующей активности при в/в введении PAN 80 мг составляло <1 ч [25].
При в/в введении PAN 80 мг отмечалось поддержание угнетения соляной кислоты длительностью приблизительно до 21 ч [25].
При в/в введении 16 здоровым добровольцам с резистентностью к действию RAN начальной дозы PAN 80 мг с последующей инфузией со скоростью 8 мг/ч повышало желудочный pH на 314% (исходное значение не указано); в/в введение RAN не позволило достичь того же эффекта [26].
Влияние на сывороточный уровень гастрина
Отмечено значительное увеличение (p<0,05) продукции гастрина после приема п/о PAN в дозах 40, 80 или 120 мг/сут по сравнению с отсутствием лечения [27]. Через 6 месяцев медианный уровень гастрина в плазме крови (его значение до лечения составило 52 нг/л) достигал максимальных значений (108 нг/л) и оставался стабильным через 9 месяцев (92 нг/л) и 12 месяцев (94 нг/л) продолжающегося приема п/о PAN 40 мг/сут у пациентов с ГЭРБ [28]. Наблюдалось значительно (p<0,05 или 0,01) меньшее повышение сывороточного уровня гастрина при приеме п/о PAN 40 мг/сут в сравнении с приемом п/о OMP 40 мг/сут.
Другие эффекты
Длительный (до 5 лет) прием п/о PAN (в основном в дозе 40 или 80 мг/сут) незначительно или умеренно повышал плотность ECL-клеток в слизистой оболочке желудка [3]. При этом отсутствовало клинически значимое влияние на функции сердечно-сосудистой и центральной нервной системы при п/о или в/в применении PAN в дозе 40 или 80 мг у здоровых добровольцев [3].
В таблице представлены результаты рандомизированных исследований у H. pylori-позитивных пациентов с пептической язвой (ПЯ) или неязвенной диспепсией (НЯД). Эрадикацию подтверждали с помощью дыхательного теста с 13C-мочевиной и/или тестов на основе изучения биопсийного материала (экспресс-тест на уреазу, гистологическое или культуральное исследование) через 4-8 недель после прекращения антибактериальной терапии.
Примечание. Если не указано иное, в таблице представлены данные ITT-анализа.
a) Пациенты, которые продолжали лечение PAN в дозе 40 мг/сут в течение 7, 14 или 21 дня.
b) Пациенты, которым проводили предварительное лечение в течение 7 дней PAN в дозе 40 мг/сут.
c) Модифицированный ITT-анализ, из которого исключены данные пациентов с отсутствием результатов гистологического исследования или теста с 13C-мочевиной
на 4–5-й неделе после прекращения лечения.
d) Резюме.
e) Применяли в течение 10 дней.
f) Высокий уровень резистентности к метронидазолу в популяции пациентов.
g) Пациенты с язвой желудка или осложнениями язвы двенадцатиперстной кишки получали пантопразол внутрь (доза не указана) до момента полного
заживления по данным эндоскопического исследования.
h) Модифицированный ITT-анализ, из которого исключены данные пациентов, не принявших ни одного препарата или которые были H. pylori-негативными.
i) Общий объем ITT-выборки. Количество пациентов в каждой группе лечения не указано.
AMX — амоксициллин; AZI — азитромицин; 2РС — два раза в сутки; CLR — кларитромицин; дс — двойное слепое; нс — неслепое; EIC — эйкозапен; мс —
многоцентровое; MET — метронидазол; 1РС — один раз в сутки; PL — плацебо; 3РС — три раза в сутки; TIN — тинидазол; * p<0,05; ** p<0,001 по отношению к
препарату(ам) сравнения.
100 из 134 пациентов с ПЯ или ГЭРБ, лечившихся пантопразолом, которых наблюдали в рамках программы постмаркетингового надзора Германии. Из числа всех включенных пациентов 91,9% принимали пантопразол в дозе 40 мг/сут в среднем в течение 17 дней (по поводу язвы двенадцатиперстной кишки).
Дозы и способ применения
Пантопразол выпускают в лекарственных формах как для перорального, так и для внутривенного применения. Форма для приема внутрь, представляющая собой таблетку с энтеросолюбильным покрытием, зарегистрирована во многих странах мира для применения при кислотозависимых заболеваниях, хотя рекомендуемые показания к применению и схемы дозирования в разных странах отличаются. В Европе пантопразол для приема внутрь показан для лечения пациентов с язвой двенадцатиперстной кишки (рекомендованная доза 40 мг/сут в течение 2 или 4 недель, в зависимости от рубцевания язвы) или с язвой желудка (40 мг/сут в течение 4 или 8 недель, в зависимости от рубцевания язвы).
Для эрадикации H. Pylori в Европе рекомендуется лечение пантопразолом в течение 7 дней в дозе 40 мг 2 раза в сутки в сочетании со следующими комбинациями: амоксициллин 1000 мг 2 раза в сутки и кларитромицин 500 мг 2 раза в сутки; метронидазол 500 мг 2 раза в сутки и кларитромицин 500 мг 2 раза в сутки; амоксициллин 1000 мг 2 раза в сутки и метронидазол 500 мг 2 раза в сутки.
Необходимость в удвоении дозы Контролока возникает намного реже по сравнению с другими ИПП, что снижает расходы на приобретение препарата и уменьшает число посещений врача в связи с неэффективностью лечения. При лечении 20 мг омепразола или 30 мг лансопразола удваивать дозы приходится значительно чаще, чем при использовании пантопразола. Повышение доз ведет к повышению расходов на лечение.
Благодаря высокой биодоступности (77%), начиная с первого приема, пантопразол быстро оказывает выраженное подавление секреции соляной кислоты. Например, в течение первых 3 суток лечения препаратом Контролок (40 мг) отмечено более быстрое проявление действия и более выраженное снижение желудочной кислотной секреции, чем при лечении омепразолом (20 мг). При удвоении дозы ИПП, имеющих нелинейную фармакокинетику, их концентрация в сыворотке крови буде либо ниже, либо выше ожидаемой, т.е. она непредсказуема. Это может привести к неадекватному контролю секреции кислоты или оказать влияние на безопасность использования препарата. Применение пантопразола, обладающего линейной фармакокинетикой, дает возможность оптимального лечения, которое соответствует тяжести заболевания и общему состоянию больного.
Контролок обладает самым длинным полупериодом угнетения секреции соляной кислоты (до 45,9 ч) по сравнению с омепразолом (до 27,5 ч) и лансопразолом (до 12,9 ч). Такое свойство обусловлено специфическим связыванием его с расположенным в 822 положении цистеином, который погружен в транспортный домен желудочного кислотного насоса, что и определяет самое длительное действие пантопразола по сравнению с другими ИПП. Таким образом, препарат длительно подавляет образование соляной кислоты, что дает возможность добиться снижения ее секреции на протяжении суток.
Многие больные наряду с антисекретоными принимают также и другие лекарственные средства. Наиболее серьезными последствиями полипрагмазии являются повышение риска развития побочных реакций и взаимодействие принятых препаратов. Так, при приеме двух препаратов потенциальный риск их взаимодействия составляет 6%, а при приеме пяти — 50%. Для предотвращения этих неблагоприятных последствий (вне зависимости от количества одновременно принимаемых лекарств) предпочтительно принимать препарат, потенциально слабо взаимодействующий с другими медикаментами. Контролок — это единственный препарат из ИПП, который не включается в известные метаболические пути взаимодействия с другими лекарственными средствами, благодаря специфичности I и II фаз биотрансформации в меньшей степени влияет на систему цитохрома Р-450. В частности, он в меньшей степени угнетает систему цитохрома Р-450, чем омепразол или лансопразол.
Таким образом, пантопразол (Контролок) является эффективным средством для лечения кислотозависимых заболеваний. В качестве компонента схем тройной терапии для эрадикации H. pylori. Контролок хорошо переносится, а вероятность развития лекарственных взаимодействий является минимальной. Доступность лекарственных форм Контролока как для перорального, так и для внутривенного применения обеспечивает гибкость терапии, когда пероральный путь введения не оптимален. В связи с этим Контролок является весомой альтернативой другим ИПН в лечении язвенной болезни желудка и двенадцатиперстной кишки.
Литература
1. Sachs G. Proton pump inhibitors and acid-related diseases. Pharmacotherapy 1997; 17 (1): 22–37.
2. Huang J.-Q., Hunt R.H. Pharmacological and pharmacodynamic essentials of H2-receptor antagonists and proton pump inhibitors for the practising physician. Best Pract Res Clin Gastroenterol 2001 Jun; 15 (3): 355–70.
3. Fitton A., Wiseman L. Pantoprazole: a review of its pharmacological properties and therapeutic use in acidrelated disorders. Drugs 1996 Mar; 51 (3): 460–82.
4. Treiber G., Lambert J.R. The impact of Helicobacter pylori eradication on peptic ulcer healing. Am J
Gastroenterol 1998 Jul; 93 (7): 1080–4.
5. Mussig S., Witzel L., Luhmann R., et al. Morning and evening administration of pantoprazole: a study to compare the effect on 24-hour intragastric pH. Eur J Gastroenterol Hepatol 1997 Jun; 9 (6): 599–602.
6. Reill L., Erhardt F., Fischer R., et al. Effect of oral pantoprazole on 24-hour intragastric pH, serum gastrin profile and drug metabolising enzyme activity in man - a placebo-controlled comparison with ranitidine [abstract no F252]. Gut 1993; 34 Suppl. 4: S63.
7. Koop H., Kuly S., Flug M., et al. Comparison of 24-h intragastric pH and 24-h gastrin profiles during therapy with the proton pump inhibitors pantoprazole and omeprazole [abstract no. 1172]. Gut 1994; 35 Suppl. 4: A79.
8. Brunner G., Danz-Neeff H., Athmann C., et al. Comparison of pantoprazole (40 mg sid) versus omeprazole (40 mg sid) on intragastric pH and serum gastrin in healthy volunteers. Gastroenterology 1997 Apr; 112 (Suppl.): A78.
9. Geus W.P., Mathot R.A., Mulder P.G., et al. Pharmacodynamics and kinetics of omeprazole MUPS 20 mg and pantoprazole 40 mg during repeated oral administration in Helicobacter pylori- negative subjects. Aliment Pharmacol Ther 2000Aug; 14 (8): 1057–64.
10. Ehrlich A., Lucker P.W.,Wiedemann A., et al. Comparison of the pharmacodynamics and pharmacokinetics of pantoprazole (40 mg) as compared to omeprazole MUPS (20 mg) after repeated oral dose administration. Methods Find Exp Clin Pharmacol 1999; 21 (1): 47–51.
11. Huang J.-Q., Goldwater D.R., Thomson A.B.R., et al. Acid suppression in healthy subjects following lansoprazole or pantoprazole. Aliment Pharmacol Ther 2002 Mar; 16 (3): 425–33.
12. Florent C., Forestier S. Twenty-four-hour monitoring of intragastric acidity: comparison between lansoprazole 30mg and pantoprazole 40mg. Eur J Gastroenterol Hepatol 1997 Feb; 9 (2): 195-200
13. Meyer M., Meier R. Effect of lansoprazole and pantoprazole on gastric acidity in Helicobacter pylori negative volunteers [abstract]. Gastroenterology 1998 Apr 15; 114 (Suppl. Pt 2): A226–7.
14. Tutuian R., Katz P.O., Castell D.O., et al. A PPI is a PPI is a PPI: lessons from prolonged intragastric pH monitoring [abstract no. 332]. Gastroenterology 2000; 118 (4 Suppl. 2): A17.
15. Wilder-Smith C., Rohss K., Lundin C., et al. Esomeprazole (E) 40 mg provides more effective acid control than pantoprazole (P) 40mg. Gastroenterology 2000 Apr; 118 (Suppl. 2 Pt 1): 22–3.
16. Simon B., Mueller P., Gatz G., et al. Equivalent effect of pantoprazole 40 mg o.d. and esomeprazole 40 mg o.d. on intra-esophageal pH in patients with symptomatic GERD [abstract]. Am J Gastroenterol 2001 Sep; 96 Suppl.: S35.
17. Hartmann M., Theiss U., Huber R., et al. Twenty-four-hour intragastric pH profiles and pharmacokinetics following single and repeated oral administration of the proton pump inhibitor pantoprazole in comparison to omeprazole. Aliment Pharmacol Ther 1996 Jun; 10 (3): 359–66.
18. Scholtz H.E.,Meyer B.H., Luus H.G. Comparison of the effects of lansoprazole, omeprazole and pantoprazole on 24-hour gastric pH in healthymales [abstract]. S AfrMed J 1995; 85 (9): 915.
19. Dammann HG, Burkhardt F. Pantoprazole versus omeprazole: influence on meal-stimulated gastric acid secretion. Eur J Gastroenterol Hepatol 1999 Nov; 11 (11): 1277–82.
20. Bornman P.C., Radebold K., De Baere H.J., et al. Efficacious longterm maintenance therapy with pantoprazole (PAN) in patients with Zollinger-Ellison syndrome [abstract no. 3114]. Gastroenterology 2001 Apr; 120 Suppl. 1: A613.
21. Desir B., Poitras P. Oral pantoprazole for acid suppression in the treatment of patients with Zollinger-Ellison syndrome. Can J Gastroenterol 2001 Dec; 15 (12): 795–8.
22. Ramdani A., Mignon M., Samoyeau R., et al. Effects of pantoprazole versus reference PPIs on 24-hour gastric acidity and basal acid output in patients with Zollinger-Ellison syndrome. Gastroenterol Clin Biol 2002; 26: 355–9.
23. Metz D.C., Pratha V., Martin P., et al. Oral and intravenous dosage forms of pantoprazole are equivalent in their ability to suppress gastric acid secretion in patients with gastroesophageal reflux disease. Am J Gastroenterol 2000 Mar; 95 (3): 626–33.
24. Buscaglia J., Kalloo A.N., Choti M., Norwitz L., Hendrix T.R. Peptic ulcer disease. Digestive disease library. www.hopkinsgi.org. 2008.
25. Hemadeh Ghassan, Pathogenesis of H Pylori Infection, 2005.
26. Altana Pharma AG. Summary of product characteristics (SPC) - tablet - H.p. - eradication [online]. Available from URL: www.altanapharma.com [Accessed 2002 Nov 8]
Рисунки, таблицы - в приложении








