Журнал "Медицинский совет" № 6/2024
DOI: 10.21518/ms2024-136
Т.С. Душина*, https://orcid.org/0000-0002-6329-593Х
Л.А. Суплотова, https://orcid.org/0000-0001-9253-8075
С.М. Кляшев, https://orcid.org/0000-0001-7739-3859
Н.Н. Федосеева, https://orcid.org/0009-0005-3397-9264
ФГБОУ ВО Тюменский ГМУ Минздрава России; 625023, Россия, Тюмень, ул. Одесская, д 54
Введение. Глобальное экономическое и социальное бремя ожирения требует четкого понимания причин и основных факторов, способствующих его развитию, что позволит разработать и эффективно реализовать потенциальные терапевтические пути для непосредственного воздействия на патологию. В последнее время в патогенезе ожирения все большее значение придается состоянию и разнообразию кишечной микробиоты, основное взаимодействие которой с человеком осуществляется через короткоцепочечные жирные кислоты (КЦЖК) – биологически активные вещества, образующиеся при анаэробной ферментации неперевариваемых углеводов.
Цель. Оценить метаболическую активность микробиоты толстой кишки по количеству и доле уровней короткоцепочечных жирных кислот у молодых пациентов с ожирением с учетом степени ожирения в сравнении со здоровыми лицами.
Материалы и методы. В исследовании приняли участие 87 пациентов с ожирением и 31 человек с нормальной массой тела. Все участники исследования соответствовали критериям включения и подписали информированное согласие. Помимо заполнения анкеты, специально разработанной под цели и задачи данного исследования, проведены антропометрические измерения и определен уровень КЦЖК в фекалиях методом газожидкостной хроматографии на оборудовании «Хромос» ГХ-1000 в независимой лаборатории INVITRO.
Результаты. У молодых пациентов с ожирением отмечается более высокая концентрация КЦЖК и изоформ КЦЖК в фекалиях, по сравнению со здоровыми лицами, при этом статистически значимо выше в группе пациентов с ИМТ более 40 кг/м2. Доля ацетата была статистически значимо выше в группе пациентов с нормальным весом, в то время как доля пропионата была выше в группе пациентов с ожирением. В отношении доли бутирата статистических различий получено не было. Кроме того, были выявлены ассоциации КЦЖК с антропометрическими параметрами.
Выводы. Результаты исследования подтверждают возможную роль КЦЖК в патогенезе ожирения.
Для цитирования: Душина ТС, Суплотова ЛА, Кляшев СМ, Федосеева НН. Метаболическая активность микробиоты толстой кишки у пациентов с ожирением (пилотное исследование). Медицинский Совет. 2024;(6):217-225. https://doi.org/10.21518/ms2024-136
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Metabolic activity of the colon microbiota in patients with obesity (pilot research)
Tatiana S. Dushina*, https://orcid.org/0000-0002-6329-593ХLyudmila А. Suplotova, https://orcid.org/0000-0001-9253-8075
Sergey M. Klyashev, https://orcid.org/0000-0001-7739-3859
Natalya N. Fedoseeva, https://orcid.org/0009-0005-3397-9264
Tyumen State Medical University; 625023, Russia, Tyumen, Odesskaya str., 54
Introduction. The global economic and social burden of obesity requires a clear understanding of the causes and underlying factors contributing to its development which will allow to develop and implement effectively the potential therapeutic pathways to direct influence on the pathology.
Recently, in the pathogenesis of obesity, great attention is paid to the state and diversity of the intestinal microbiota, its main interaction with men is performed through short-chain fatty acids (SCFAs) - biologically active substances being formed during the anaerobic fermentation of indigestible carbohydrates.
Aim. To assess the metabolic activity of the colon microbiota, in terms of quantity and proportion of short-chain fatty acid levels in young obese patients taking into account the degree of obesity in comparison with healthy individuals.
Materials and methods. 87 obese patients and 31 subjects with the normal body weight were included in the study. All study participants met the inclusion criteria and signed the informed consent.
In addition to filling out a questionnaire specially designed for the goals and objectives of this study, anthropometric measurements were carried out and the level of SCFAs in feces was determined with the help of gas-liquid chromatography using Chromos GC-1000 equipment in the independent INVITRO laboratory.
Results. Young obese patients have a higher concentration of SCFAs and SCFA isoforms in feces compared to healthy individuals, while it is statistically significantly higher in the group of patients with BMI more than 40 kg/m2. The proportion of acetate was statistically significantly higher in the normal weight group, while the proportion of propionate was higher in the obese group. No statistical differences were found regarding the proportion of butyrate. In addition, the associations of SCFAs with anthropometric parameters were identified.
Conclusion. The results of the study confirm the possible role of SCFA in in pathogenesis of obesity.
For citation: Dushina TS, Suplotova LA, Klyashev SM, Fedoseeva NN. Metabolic activity of the colon microbiota in patients with obesity (pilot research). Meditsinskiy sovet = Medical Council. 2024;(6):217-225. (In Russ.) https://doi.org/10.21518/ms2024-136
Conflict of interest: the authors declare no conflict of interest.
Введение
Введение. Распространенность ожирения принимает характер эпидемии. Согласно Всемирной организации здравоохранения (ВОЗ), ожирение представляет собой состояние, характеризующееся аномальным или чрезмерным накоплением жира, которое может привести к ухудшению здоровья (WHO). По прогнозам ВОЗ, к 2030 году ожирением будут страдать около 1,12 миллиарда человек [1]. Помимо косметического дефекта, ожирение таит в себе огромную угрозу для человека, значительно повышая риск возникновения таких заболеваний и нарушений, как: артериальная гипертония, дислипидемия, инсулинорезистентность (ИР), сахарный диабет 2 типа, ишемическая болезнь сердца, НАЖБП, артрит, апноэ во сне и некоторые виды рака. Основная масса перечисленных заболеваний является основной причиной смертности во всем мире, что объясняет срочную необходимость в изучении основных механизмов развития ожирения, с целью разработки более эффективных методов лечения и профилактики.Основным этиологическим фактором возникновения ожирения традиционно считают дисбаланс в системе поступления и траты калорий [1], к которому приводит малоподвижный образ жизни, вестернизация питания, с превалированием в рационе рафинированных углеводов и трансжиров, с одновременным дефицитом пищевых волокон. Данные особенности питания не могут не сказаться на состоянии и разнообразии кишечной микробиоты, которой, в последнее время, придается все большее значение в патогенезе ожирения. Известно, что метаболизируя непереваренные пищевые волокна, микроорганизмы толстого кишечника способны синтезировать короткоцепочечные жирные кислоты (КЦЖК) – вещества, представляющие собой органические линейные карбоновые кислоты, состоящие из алифатической цепи, содержащей от 1 до 6 атомов углерода, выступающие медиаторами между микробным сообществом и организмом человека. Они принимают участие во многих физиологических процессах жизнедеятельности организма, включая регуляцию обмена веществ, иммунных и воспалительных реакций, поддержание кишечного гомеостаза, энергетическом процессе, антиоксидантным и противораковым действием [2, 3, 4].
К основным КЦЖК, образующимся в результате сахаролитической ферментации относятся уксусная (С2, ацетат), пропионовая (С3, пропионат), масляная (С4, бутират), валериановая (С5, валерат) и капроновая кислоты (С6, капроат). В толстой кишке человека и фекалиях, от 90% до 95% КЦЖК, приходится на уксусную, пропионовую и масляную кислоты, в приблизительном молярном соотношении 60:20:20, соответственно [5]. Однако, существует альтернативный путь синтеза КЦЖК. Так, в случае, снижения поступление ферментируемой клетчатки с пищей, микроорганизмы толстой кишки начинают ферментировать белки (пептиды) и продукты их метаболизма (незаменимые аминокислоты с разветвленной цепью: валин, лейцин и изолейцин), образуя при этом короткоцепочечные жирные кислоты с разветвленной цепью – иКЦЖК (англ. Branched short chain fatty acids, BSCFA), таких как изовалерат (iC5), изобутират (iC4), и 2-метилбутират 7, а так же фенольные и индольные химикаты, аммиак и амины [6, 7]. Протеолитический путь синтеза КЦЖК используется микробиотой кишечника только в менее 1%. На сегодняшний день иКЦЖК изучены недостаточно, но складывается представление об их токсическом действии на кишечник [8], которое скорее всего обусловлено воздействием метаболитов, таких как аммиак, фенолы и сероводород, действие которых активно изучается в настоящее время при синдроме раздраженного кишечника, воспалительных заболеваниях кишечника и раке [9, 10].
Недавний мета-анализ показал, что среди семи оцениваемых исследований люди с ожирением имели значительно более высокое содержание КЦЖК в фекалиях по сравнению с контрольной группой [11]. Другие исследования показывают, что фекальные КЦЖК отрицательно связаны с ИМТ, окружностью талии и висцеральным ожирением у людей [6, 7, 12]. Таким образом, участие КЦЖК в энергетическом балансе человека неясно и требует дальнейшего изучения.
Цель - оценить метаболическую активность микробиоты толстой кишки, по количеству и доли уровней короткоцепочечных жирных кислот, у молодых пациентов с ожирением, с учетом степени ожирения в сравнении с здоровыми лицами.
Материалы и методы
Место и время проведения исследования
Место проведения. Университетская многопрофильная клиника ФГБОУ ВО «Тюменский государственный медицинский университет» Министерства здравоохранения Российской Федерации, Тюмень, Россия
Время проведения. Апрель 2023 г. – сентябрь 2023 г.
Изучаемые популяции
Изучалось две популяции: лица с ожирением (ИМТ 37,2 [34,1;42,05] кг/м2) и лица с нормальной массой тела (ИМТ 21,9 [20,2;23,5] кг/м2).
В исследование были включены пациенты, пришедшие на амбулаторный приём.
Критерии включения для больных с ожирением: возраст от 18 до 44 лет, подписание информированного согласия, стабильная масса тела (изменение менее 10% массы тела за 3 месяца до исследования), отсутствие тяжелой соматической патологии.
Критерии включения для лиц группы сравнения: возраст от 18 до 44 лет, подписание информированного согласия, нормальная масса тела (ИМТ 18,5 – 24,9 кг/м2), отсутствие соматической патологии.
Критерии невключения: возраст младше 18 лет, и старше 44 лет, хроническая соматическая патология, острые воспалительные заболевания в течение последнего месяца, применение про-, пре-, син-, мета-, анти- биотиков, слабительных препаратов, а также препаратов влияющих на моторику за последние 3 месяца, вакцинация за последние 6 месяцев, травмы/оперативные вмешательства за последние 6 месяцев, злоупотребление алкоголем (потребление в неделю более 70 г этанола у женщин, или 140 г этанола у мужчин), вегетарианство, беременность/лактация.
Дизайн исследования
Проводилось одноцентровое, поперечное, одномоментное, контролируемое исследование.
Методы
Все участники исследования заполняли анкету, специально разработанную под цели и задачи данного проекта. Анкета включала в себя вопросы, касающиеся особенностей динамики массы тела, питания, наличия вредных привычек, хронических заболеваний, приёма медикаментозных средств. Всем участникам исследования проводилось антропометрическое обследование с измерением веса, роста, окружности талии (ОТ) и окружности бедер (ОБ), артериального давления (АД). Проводился расчет ИМТ, который определялся как отношение массы тела в килограммах к квадрату роста в метрах (кг/м2). Дефициту массы тела соответствовали значения ИМТ менее18,5 кг/м2, нормальной массе тела – 18,5 – 24,9 кг/м2, избыточной массе тела – 25,0 – 29,9 кг/м2, ожирению ≥ 30,0 кг/м2. Значения ИМТ 30,0 – 34,9 кг/м2 соответствовали ожирению I степени, 35,0 – 39,9 кг/м2 - II степени и ≥ 40,0 кг/м2 – III степени (по ВОЗ, 1997 г.).
Забор кала осуществлялся в стерильный контейнер, содержащий специальную ложечку, который каждому пациенту предоставляла исследовательская группа. Для исследования собиралась порция кала естественной дефекации, с соблюдением асептических условий. Количество КЦЖК в фекалиях определялось методом газожидкостной хроматографии на оборудовании "Хромос" ГХ-1000 в независимой лаборатории INVITRO.
Статистический анализ
Для статистических расчетов был использован пакет прикладных программ Microsoft Exel 2010, IBM SPSS Statistics 26.0. Качественные переменные представлены в виде абсолютных значений и частот (процентов). Количественные переменные описывались с помощью медианы и межквартильного интервала. Анализ взаимосвязей между двумя количественными переменными проводился с использованием корреляционного анализа, с расчетом коэффициента корреляции Спирмена. Результаты оценивались, как статистически значимые при уровне р<0,05.
Этическая экспертиза
Протокол исследования был одобрен Этическим комитетом ФГБОУ ВО «Тюменский государственный медицинский университет» Министерства здравоохранения Российской Федерации на заседании от 13.03.23 г. № 113 (выписка из протокола заседания). Участниками было подписано информированное согласие.
Результаты
Объекты (участники) исследования
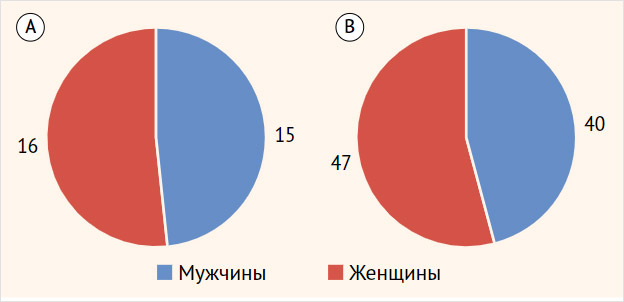
В исследовании приняли участие 118 человек, из них 87 пациентов с ожирением ИМТ 37,2 [34,1;42,05] кг/м2 и 31 человек - группа сравнения с ИМТ 21,9 [20,2;23,5] кг/м2 (таблица 1). Средний возраст людей группы сравнения составлял 29 [26,0;34,0] лет, группы ожирения 28 [23,0;37,0] лет (р=0,542). Группы статистически значимо не отличались по полу (р=0,900) (рисунок 1).
Рисунок 1. Соотношение пациентов по полу в группе сравнения (А) и в группе ожирения (B)
Пациенты с ожирением в соответствии с классификацией ВОЗ (1997 г.) были распределены на 3 группы с учетом ИМТ: 1 группа – 29 человек, ИМТ 31,0 [30,5; 34,0] кг/м2, 2 группа – 30 человек, ИМТ 37,4 [35,8; 38,7] кг/м2, 3 группа – 28 человек, ИМТ 44,50 [42,15; 47,75] кг/м2.
Таблица 1. Антропометрические характеристики пациентов с ожирением и группы сравнения
| Антопометрические характеристики | Контроль n=31 | Ожирение n=87 | p |
| Вес (кг), Me [Q1;Q3] | 65,0 [58,5;74,5] | 109 [99,0;125,5] | <0,001* |
| ИМТ (кг/м2), Me [Q1;Q3] | 21,9 [20,2;23,5] | 37,2 [34,1;42,05] | <0,001* |
| Окружность талии (ОТ, см), Me [Q1;Q3] | 76,0 [69,5;83,0] | 111,0 [104,0; 121,5] | <0,001* |
| Окружность бедер (ОБ, см), Me [Q1;Q3] | 98,0 [94,5;100,5] | 124,0 [117,0;131,0] | <0,001* |
| ОТ/ОБ, Me [Q1;Q3] | 0,78 [0,73;0,84] | 0,92 [0,83;0,97] | <0,001* |
Длительность избыточной массы тела, пациентов в группе ожирения, составляла в среднем 14 [9; 18] лет. У 32,9% людей (28 человек) избыточная масса тела наблюдалась с детского возраста. 76,2% участников, отмечали наличие ожирения у ближайших родственников. Участники двух групп статистически значимо не отличались по способу рождения, массе тела при рождении, наличию и продолжительности грудного вскармливания. В обеих группах, основная масса участников отметила (74,2% в группе сравнения, и 54,7% в группе ожирения), что в сутки имеют 3-4 основных приёма пищи. При этом, основной приём пищи, у 57 (67,9%) пациентов группы ожирения, приходится на вечернее время, в отличии от группы сравнения, в которой только 11 (35,5%) человек предпочитают более объемный ужин (р=0,002).
Основные результаты исследования
Концентрация фекальных КЦЖК отображена в таблице 2.
Общее количество КЦЖК, включая их изоформы, было значительно выше у людей с ожирением 6,733 [4,004; 8,991], чем у людей с нормальным весом 2,577 [1,841; 4,168] (р=0,001), при этом наиболее распространенными КЦЖК были ацетат, за которым следовали пропионат и бутират в обеих группах (рисунок 2). Общее количество КЦЖК положительно коррелировало с ИМТ (r=0,226, p=0,038), ОТ (r=0,330, p=0,002), ОТ/ОБ (r=0,267, p=0,013), систолическим (r=0,316, p=0,003) и диастолическим (r=0,283, p=0,009) АД, длительностью ожирения (r=0,285, p=0,009).
Рисунок 2. Уровень короткоцепочечных жирных кислот у пациентов с ожирением и группы сравнения
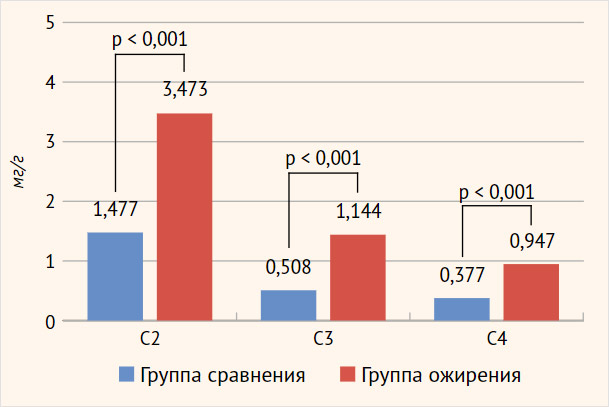
Таблица 2. Уровень короткоцепочечных жирных кислот у пациентов с ожирением и пациентов из группы сравнения
| Короткоцепочечные жирные кислоты | Контроль n=31 | Ожирение n=87 | p |
| С2 (уксусная) Абсолютное содержание (мг/г) Относительное содержание (ед,) | 1,477 [1,150; 2,338] 0,665[0,627; 0,709] | 3,473 [2,231; 5,078] 0,623 [0,585; 0,649] | <0,001* <0,001* |
| С3 (пропионовая) Абсолютное содержание (мг/г) Относительное содержание (ед,) | 0,5075 [0,269; 0,746] 0,1795 [0,155; 0,198] | 1,144 [0,728; 1,968] 0,220 [0,186; 0,244] | <0,001* <0,001* |
| С4 (масляная) Абсолютное содержание (мг/г) Относительное содержание (ед,) | 0,377 [0,213; 0,554] 0,1555 [0,117; 0,179] | 0,947 [0,422; 1,418] 0,155 [0,127; 0,186] | <0,001* 0,702 |
| Суммарное содержание ИзоCn изоС4+изоС5+изоС6 Абсолютное содержание (мг/г) Относительное содержание (ед,) | 0,1795 [0,141; 0,301] 0,0765 [0,057; 0,096] | 0,304 [0,205; 0,431] 0,060 [0,027; 0,078] | 0,003* 0,004* |
| ИзоCn/Cn | 0,470 [0,303; 0,696] | 0,322 [0,204; 0,456] | 0,002* |
| ИзоС5/С5 | 1,3555 [1,031; 1,761] | 1,297 [0,878; 1,587] | 0,573 |
| Суммарное содержание | 2,577 [1,841; 4,168] | 6,733 [4,004; 8,991] | <0,001* |
| Анаэробный индекс (С2-С4) | -0,5045 [-0,596; -0,411] | -0,606 [-0,709; -0,540] | <0,001* |
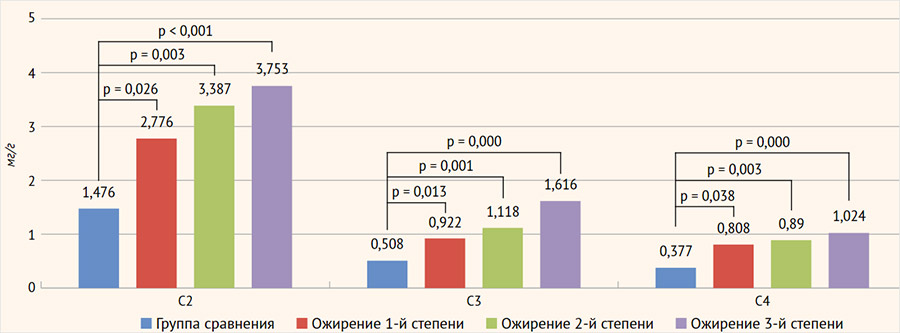
Абсолютный уровень уксусной кислоты (С2) статистически был значимо выше в группе пациентов с ожирением, составляя 3,473 [2,231; 5,078] мг/г против 1,477 [1,150; 2,338] мг/г в группе сравнения, при этом самая высокая концентрация отмечалась в группе лиц с ожирением 3 степени, составляя 3,752 [3,255; 5,745] мг/г (р=0,001) (рисунок 3). Абсолютный уровень С2 положительно коррелировал с ОТ (r=0,317, p=0,003), ОТ/ОБ (r=0,252, p=0,020), систолическим (r=0,342, p=0,001) и диастолическим (r=0,304, p=0,005) АД, длительностью ожирения (r=0,269, p=0,013).
Рисунок 3. Уровень короткоцепочечных жирных кислот у пациентов с учетом степени ожирения и группы сравнения
Относительный уровень уксусной кислоты (С2) статистически был значимо выше в группе пациентов с нормальным весом 0,665[0,627; 0,709], против 0,623 [0,585; 0,649] группы ожирения, наибольшая разница при этом была с пациентами 3 степени ожирения 0,610 [0,565; 0,632] (р=0,002). При этом отмечалась отрицательная корреляция с ОТ (r=-264, p=0,015), ОТ/ОБ (r=-0,254, p=0,019).
Абсолютный уровень пропионовой кислоты (С3) в группе сравнения составил 0,508 [0,269; 0,746] мг/г против группы ожирения 1,144 [0,728; 1,968] мг/г, в которой максимум был достигнут у людей с ожирением 3 степени 1,616 [1,040; 2,510] мг/г (р=0,000). Статистически значимая, положительная корреляция наблюдалась с теми же параметрами, что и у С2 в абсолютных значениях, но в отличии от С2, была обнаружена дополнительная положительная корреляция с ИМТ (r=0,234, p=0,03).
Относительный уровень пропионовой кислоты (С3) аналогично, достоверно превалировал в группе ожирения 0,220 [0,186; 0,244], достигая максимума в группе лиц с ожирением 3 степени (р=0,001). В отличии от абсолютного уровня положительная корреляция наблюдалась только с ОТ (r=0,237, p=0,029).
Похожая с абсолютными значениями С2 и С3 динамика определялась и по абсолютному уровню масляной кислоты (С4), который в группе ожирения составил 0,947 [0,422; 1,418] мг/г, против 0,377 [0,213; 0,554] мг/г в группе сравнения, наиболее высокий ее уровень также приходился на группу людей с третьей степенью ожирения, составляя 1,024 [0,823; 1,587] мг/г (р=0,000). Положительные корреляции просматривались с теми же параметрами, что у С3 в абсолютных значениях.
Кроме того, в группах достоверно отличалось абсолютное суммарное содержание короткоцепочечных жирных кислот с разветвленной цепью (изовалериановая (iC5), изомасляная (iC4), и изокапроновая (iC6)), составляя в группе сравнения 0,1795 [0,141; 0,301], против группы ожирения 0,304 [0,205; 0,431] (р=0,003), достигая наибольших значений в группе лиц с ожирением 3 степени, 0,3635 [0,225; 0,521] (р=0,009). Изоформы КЦЖК положительно коррелировали с ИМТ (r=0,217, p=0,046), ОТ (r=0,243, p=0,025), ОТ/ОБ (r=0,206, p=0,059).
В отношении параметра ИзоCn/Cn, отражающего усиление протеолитической активности микробиоты, показатели составляли 0,470 [0,303; 0,696] в группе сравнения, 0,322 [0,204; 0,456] в группе ожирения (р=0,002). Была выявлена отрицательная корреляция этого параметра с систолическим (r=-0,407, p=0,000) и диастолическим (r=-0,331, p=0,002) АД, в то же время, с массой тела при рождении корреляция была положительной (r=0,248, p=0,025).
Соотношение активности строгих анаэробов и аэробов отображает анаэробный индекс. В нашем исследовании он распределялся аналогичным образом, составляя в группе сравнения -0,505 [-0,596; -0,411], а в группе ожирения -0,606 [-0,709; -0,540] (р=0,001). Анаэробный индекс отрицательно коррелировал с ОТ (r=-262, p=0,015), ОТ/ОБ (r=-0,253, p=0,019), ЧСС (r=-0,233, p=0,032) и весом, который наблюдался у пациентов 1 год назад (r=-0,219, p=0,045).
Обсуждение
КЦЖК образуясь в толстом кишечнике, выступают, своего рода, сигнальными молекулами, регулирующими множество биологических процессов в организме хозяина. Существует 2 основных сигнальных механизма, посредством которых КЦЖК влияют на физиологию хозяина: активация трансмембранных рецепторов, связанных с G-белком (англ. G-protein-coupled receptors, GPCRs) [13], которые также называются рецепторами свободных жирных кислот (англ. Free-fatty-acid receptors, FFARs), и ингибирование фермента гистондеацетилазы (англ. Histone deacetylase, HDAC) [14]. Ингибирование HDAC оказывает широкое влияние на экспрессию генов макроорганизма. За счёт данного механизма действия происходит регуляция метаболизма, дифференцировки, пролиферации, а также апоптоза клеток.
Наиболее важными рецепторами КЦЖК в семействе GPCR считаются GPR43 (также известный, как рецептор свободных жирных кислот 2 FFAR2), и GPR41 (FFAR3). Связывание КЦЖК, в частности, ацетата и пропионата с рецепторами FFA2/GPR43 и FFAR3/GPR41 [15], приводит к синтезу эндокринными L-клетками кишечника (ЭКК) пептид тирозин-тирозина (англ. Peptide tyrosine tyrosine, PYY) и глюкагоноподобного пептида-1 (англ. Glucagon-like peptide-1, GLP-1) [15, 16, 17]. Данные гормоны помимо антидиабетического действия, вызывают снижение аппетита и потребление энергии, способствуя насыщению, за счет замедления перистальтики кишечника и желудка [18, 19]. Кроме того, путем активации GPCR, особенно FFAR2 и FFAR3, КЦЖК эпигенетически регулируют экспрессию адипокинов, таких как лептин, адипонектин и резистин [20, 21]. Лептин, являясь модулятором расхода энергии играет важнейшую роль в регуляции жировой массы, расходе энергии. В дополнение к этим энтероэндокринным путям недавняя работа также продемонстрировала нейроактивные свойства метаболитов КЦЖК, позволяющие напрямую модулировать контроль аппетита. В частности, ацетат может преодолевать гематоэнцефалический барьер и усиливать гипоталамическую ГАМКергическую нейротрансмиссию, подавляя аппетит и снижая потребление энергии [22].
В совокупности эти данные позволяют предположить, что КЦЖК могут влиять на развитие ожирения путём регуляции аппетита, энергообмена, пролиферации жировой ткани. Об этом может свидетельствовать более высокая концентрации КЦЖК в фекалиях людей с избыточным весом и ожирением по сравнению с лицами, имеющими нормальную массу тела, что подтверждается, как в нашем, так и ряде других исследований [23, 24], а также в недавнем метаанализе, охватившем семь исследований, и показавшем, что у людей с ожирением содержание КЦЖК в фекалиях было значительно выше по сравнению с худыми людьми из контрольной группы [11].
В нескольких перекрестных исследованиях сообщалось о положительной связи между уровнями КЦЖК в фекалиях и ожирением [6, 11, 25]. Наши результаты согласуются с данными La Cuesta-Zuluaga et al., которые провели исследование группы из 441 взрослых колумбийцев и продемонстрировали, что более высокий уровень фекального бутирата, ацетата, пропионата и общего количества КЦЖК связан с ИМТ, количеством жира в организме и окружностью талии [25]. Различие с нашим исследованием в том, что мы не обнаружили корреляция между С2 и ИМТ. Однако, мы продемонстрировали положительную корреляцию между С2, С3, С4 и суммарным содержанием КЦЖК с ОТ, ОТ/ОБ, АД и длительностью ожирения. Возможно, причина расхождения данных в возрасте участников. Мы работали с людьми молодого возраста, тогда как колумбийцы были в возрасте от 18–62 лет. Кроме того, имеются различия в национальности, в характере питания, климатических условиях.
Положительная корреляция сывороточных КЦЖК с двумя показателями ожирения - ИМТ и соотношением талии к росту была обнаружена Yiqing Wang и коллегами при обследовании популяционной когорты взрослых китайцев. Группа исследователей обнаружила, что бутират/изобутират положительно связан с ИМТ; а бутират/изобутират, изовалерат и общее количество КЦЖК были положительно связаны с соотношением талии к росту [26].
Потенциальная причина положительной связи между КЦЖК и ожирением заключается в том, что кишечная микробиота людей с ожирением может иметь более высокую способность собирать энергию за счет производства КЦЖК, которые являются дополнительным источником калорий для хозяина. Как известно, КЦЖК обеспечивают до 10% общих ежедневных энергетических потребностей хозяина. Так же существует предположение, что повышенный уровень КЦЖК в кале лиц с ожирением, по сравнению с людьми группы сравнения можно объяснить менее эффективной абсорбции КЦЖК в колоноциты и системный кровоток [27], или состоянием «резистентности к КЦЖК» и, следовательно, большей экскреции КЦЖК с калом, к которой может привести микробный дисбиоз кишечника при ожирении [25] или изменении сетей экспрессии генов эпителиальных клеток в кишечнике, координирующих метаболизм питательных веществ и воспаление, а также КЦЖК и цитокин-опосредованное подавление транспортеров КЦЖК [28]. Таким образом, в условиях воспаления и ожирения КЦЖК, вырабатываемые в кишечнике, могут быть менее способны опосредовать свои системные эффекты вторичного мессенджера. С данной теорией согласуется работа Kim KN в которой сообщалось, что люди с ожирением имеют большее количество КЦЖК в фекалиях, но относительно низкие уровни КЦЖК в плазме [11]. Однако Рахат-Розенблум и др. [29] измерившие абсорбцию КЦЖК, методом ректального диализного мешка, опровергают данную теорию. Так же, как и Yiqing Wang [26], который измерял уровень КЦЖК в плазме, и получил положительную их связь с показателями ожирения. Повидимому, для полного выяснения этой гипотезы необходимы дальнейшие исследования с использованием как циркулирующих, так и фекальных КЦЖК.
Несмотря на наличие множества информации, подтверждающей положительную корреляцию КЦЖК с ИМТ, имеются и другие сообщения, подтверждающие, что введение экзогенного ацетата, пропионата или бутирата предотвращает увеличение веса у мышей, вызванных диетой, и людей с избыточным весом [30, 31]. В исследованиях на людях и животных демонстрируется защитная роль КЦЖК при ожирении и метаболических заболеваниях. В экспериментальных моделях на животных добавление КЦЖК снижает массу тела, улучшает чувствительность к инсулину и уменьшает воспаление, связанное с ожирением [32]. Другие исследования показывают, что фекальные КЦЖК отрицательно связаны с ИМТ, окружностью талии и висцеральным ожирением у людей [6, 33].
Нужно так же отметить, что при обсуждении КЦЖК, не отводится должного внимания КЦЖК с разветвленной цепью (англ. Branched-chain fatty acid, BCFA), или, так называемым, изоформам КЦЖК (иКЦЖК), хотя они могут играть решающую роль в кишечной среде и могут считаться потенциальными маркерами микробного метаболизма [34]. иКЦЖК на сегодняшний день рассматриваются в качестве маркеров протеолитический ферментации в толстой кишке, которая начинает преобладать над сахаролитической ферментацией в случае дефицита в рационе клетчатки. Как отметили Fan L. и David Rios-Covian уровень иКЦЖК в образцах фекалий обратно коррелируют с потреблением клетчатки (пищевых нерастворимых волокон, особенно нерастворимой) [34, 35].
Хотя иКЦЖК участвуют во многих биохимических процессах, они остаются недостаточно изученными, а исследования на людях ограничены [36, 37]. В литературе складывается представление о токсическом действии иКЦЖК на кишечник [8], хотя, скорее всего, токсическое действие на колоноциты, с развитием воспалительных состояний, обусловлено воздействием азотистых метаболитов, таких как амины, сероводород, п-крезол, фенолы и аммиак, образующихся совместно с иКЦЖК при протеолитической ферментации. О защитной роли иКЦЖК, при воспалении кишечника, свидетельствуют данные Chaima Ezzine, который изучал роль иКЦЖК в воспалительной реакции и их влияние на целостности эпителия кишечника. В течение 3 недель они выращивали клетки CACO2 (American Type Culture Collection (ATCC)-HTB-37) в камерах Transwell, чтобы воссоздать in vitro модель дифференцированного кишечного эпителия, с последующим инкубированием клеток с TNFα и контролировали проницаемость полученного эпителия путем измерения трансэпителиального электрического сопротивления (англ. transepithelial electrical resistance, TEER) между апикальным и базальным отсеками. Опыт показал, что иКЦЖК ингибируют путь NF-κB, уменьшают экспрессию провоспалительных цитокинов и способствуют целостности эпителия кишечника [38].
Кроме того, ранее Ран-Ресслер и др. оценивали влияние иКЦЖК на некротический энтероколит (НЭК) у новорожденных крыс линии Sprague Dawley. Крысы, получавшие иКЦЖК, имели более низкую частоту НЭК и более высокую экспрессию противовоспалительного цитокина IL-10. иКЦЖК повлияли на состав кишечной микробиоты кишечника крыс, способствуя распространению Bacillus subtilis, что сопровождалось более низкими уровнями провоспалительных и более высокими уровнями противовоспалительных цитокинов, а также улучшением работы иммунной системы и общим состоянием животных [39].
Помимо противовоспалительного действия, иКЦЖК принимают участие в энергетическом обмене. Основным источником энергии колоноцитов, обеспечивая 70–80% их энергетических потребностей является бутират. В случае, когда бутират недоступен, в качестве альтернативного источника энергии может использоваться изобутират [38, 40, 41]. Статистически значимое преобладание иКЦЖК в группе ожирения, в нашем исследовании, возможно, связано со снижением доступности ферментируемых углеводов в толстой кишке, из-за снижения их поступления с пищей, что способствовало переходу к более интенсивной ферментации белка и, как следствие, увеличению выработки иКЦЖК в кишечнике. Так же, причиной может быть увеличение количества белков в толстой кишке, что может быть связано с увеличением относительного количества белка в рационе или незначительной мальабсорбцией белка [42]. На выработку иКЦЖК кишечной микробиотой, по-видимому, влияют несколько факторов, которые могут влиять на доступность ферментируемых аминокислот в кишечнике, например, диета, эндогенный метаболизм хозяина, микробный состав кишечника и метаболические предпочтения различных микробных групп.
Наши данные согласуются с результатами исследования David Rios-Covian [34] который показал, что у субъектов с морбидным ожирением наблюдались значительно более высокие концентрации ( p < 0,05) общих КЦЖК и иКЦЖК в кале, чем у лиц других весовых групп: с нормальным весом, добровольцев с ожирением. Однако, в отличии от нас, он не получил значимой связи между иКЦЖК и ИМТ. В нашем исследовании корреляционный анализ между суммой иКЦЖК проводился со всеми изученными антропометрическими и анамнестическими параметрами. В результате прослеживается чёткая корреляция иКЦЖК с ИМТ, ОТ и ОТ/ОБ. Что говорит о том, что необходимы дальнейшие исследования, для выяснения механизмов действия иКЦЖК на здоровье и болезни.
На сегодняшний день множественные исследования показали, что показатели как циркулирующих, так и фекальных КЦЖК могут быть точными прогностическими маркерами статуса ожирения [26,27,43], хотя, в исследовании Ecklu-Mensah G. и соавторов [44], приводятся доказательства того, что концентрации КЦЖК в фекалиях не являются прогностическим фактором статуса ожирения и что фекальные КЦЖК могут функционировать как плохой биомаркер ожирения. Однако авторы признаются, что необходимы дальнейшие контролируемые исследования на людях, включая количественную оценку скорости оборота КЦЖК в организме, вследствие чего становится ясна необходимость дальнейших изучений возможной роли КЦЖК в этиологии ожирения.
Заключение
Глобальное экономическое и социальное бремя ожирения, требует четкого понимания причин и основных факторов, способствующих его развитию, что позволит разработать и эффективно реализовать потенциальные терапевтические пути для непосредственного воздействия на патологию. Насколько нам известно, мы являемся первым исследованием, изучающим связи между фекальными КЦЖК и иКЦЖК с показателями ожирения в популяционной когорте лиц молодого возраста. В ходе нашего исследования мы выявили, что у молодых пациентов с ожирением отмечается более высокая концентрация общего количества КЦЖК и иКЦЖК в фекалиях, по сравнению с здоровыми лицами. Абсолютное количество ацетата, пропионата и бутирата увеличивается пропорционально увеличению ИМТ, при этом доля ацетата ниже, а доля пропионата выше в группе ожирения. Доля бутирата не имеет статистически значимой разницы в группах контроля и ожирения. Продемонстрирована связь общего количества КЦЖК, а также их фракций с ИМТ, ОТ, ОТ/ОБ, систолическим и диастолическим АД, длительностью ожирения. Полученные данные подтверждают, возможную роль КЦЖК в патогенезе ожирения.
[1] World Obesity Atlas. World Obesity Federation; 2022. Available et: https://www.worldobesity.org/resources/resource-library/world-obesity-atlas-2022
Развернуть
- Blüher M. Obesity: Global epidemiology and pathogenesis. Nature Reviews Endocrinology. 2019;15:288-298. https://doi.org/10.1038/s41574-019-0176-8.
- Amiri P, Hosseini SA, Ghaffari S, Tutunchi H, Ghaffari S, Mosharkesh E et al. Role of Butyrate, a Gut Microbiota Derived Metabolite, in Cardiovascular Diseases: A comprehensive narrative review. Front Pharmacol. 2022;12:837509. https://doi.org/10.3389/fphar.2021.837509.
- Parada Venegas D, De la Fuente MK, Landskron G, González MJ, Quera R, Dijkstra G et al. Short Chain Fatty Acids (SCFAs)-Mediated Gut Epithelial and Immune Regulation and Its Relevance for Inflammatory Bowel Diseases. Front Immunol. 2019;10:277. https://doi.org/10.3389/fimmu.2019.00277.
- Luu M, Visekruna A. Short-chain fatty acids: Bacterial messengers modulating the immunometabolism of T cells. Eur J Immunol. 2019;49(6):842-848. https://doi.org/10.1002/eji.201848009.
- Deleu S, Machiels K, Raes J, Verbeke K, Vermeire S. Short chain fatty acids and its producing organisms: An overlooked therapy for IBD? EBioMedicine. 2021;66:103293. https://doi.org/10.1016/j.ebiom.2021.103293.
- Miranda VPN, Dos Santos Amorim PR, Bastos RR, de Faria ER, de Castro Moreira ME, do Carmo Castro Franceschini S et al. Abundance of Gut Microbiota, Concentration of Short-Chain Fatty Acids, and Inflammatory Markers Associated with Elevated Body Fat, Overweight, and Obesity in Female Adolescents. Mediators Inflamm. 2019:7346863. https://doi.org/10.1155/2019/7346863.
- Курмангулов АА, Дороднева ЕФ, Исакова ДН. Функциональная активность микробиоты кишечника при метаболическом синдроме. Ожирение и метаболизм. 2016;13(1):16-19. https://doi.org/10.14341/omet2016116-19.
- Blakeney BA, Crowe MS, Mahavadi S, Murthy KS, Grider JR. Branched ShortChain Fatty Acid Isovaleric Acid Causes Colonic Smooth Muscle Relaxation via cAMP/PKA Pathway. Dig Dis Sci. 2019;64:1171-1181. https://doi.org/10.1007/s10620-018-5417-5.
- Canfora EE, Meex RCR, Venema K, Blaak EE. Gut microbial metabolites in obesity, NAFLD and T2DM. Nat Rev Endocrinol. 2019;15:261-273. https://doi.org/10.1038/s41574-019-0156-z.
- Diether NE, Willing BP. Microbial Fermentation of Dietary Protein: An Important Factor in Diet-Microbe-Host Interaction. Microorganisms. 2019;7(1):19. https://doi.org/10.3390/microorganisms7010019.
- Kim KN, Yao Y, Ju SY. Short Chain Fatty Acids and Fecal Microbiota Abundance in Humans with Obesity: A Systematic Review and MetaAnalysis. Nutrients. 2019;11(10):2512. https://doi.org/10.3390/nu11102512.
- Murugesan S, Ulloa-Martínez M, Martínez-Rojano H, Galván-Rodríguez FM, Miranda-Brito C, Romano MC et al. Study of the diversity and short-chain fatty acids production by the bacterial community in overweight and obese Mexican children. Eur J Clin Microbiol Infect Dis. 2015;34(7):1337-1346. https://doi.org/10.1007/s10096-015-2355-4.
- Hosseinkhani F, Heinken A, Thiele I, Lindenburg PW, Harms AC, Hankemeier T. The contribution of gut bacterial metabolites in the human immune signaling pathway of non-communicable diseases. Gut Microbes. 2021;13(1):1-22. https://doi.org/10.1080/19490976.2021.1882927.
- Mishra SP, Karunakar P, Taraphder S, Yadav H. Free Fatty Acid Receptors 2 and 3 as Microbial Metabolite Sensors to Shape Host Health: Pharmacophysiological View. Biomedicines. 2020;8(6):154. https://doi.org/10.3390/biomedicines8060154.
- Wiciński M, Gębalski J, Gołębiewski J, Malinowski B. Probiotics for the treatment of overweight and obesity in humans-A review of clinical trials. Microorganisms. 2020;8(8):1148. https://doi.org/10.3390/microorganisms8081148.
- He J, Zhang P, Shen L, Niu L, Tan Y, Chen L et al. Short-chain fatty acids and their association with signalling pathways in inflammation, glucose and lipid metabolism. Int J Mol Sci. 2020;21(17):6356. https://doi.org/10.3390/ijms21176356.
- Silva YP, Bernardi A, Frozza RL. The role of short-chain fatty acids from gut microbiota in gut-brain communication. Front Endocrinol. 2020;11:25. https://doi.org/10.3389/fendo.2020.00025.
- Koliaki C, Liatis S, Dalamaga M, Kokkinos A. The Implication of Gut Hormones in the Regulation of Energy Homeostasis and Their Role in the Pathophysiology of Obesity. Curr Obes Rep. 2020;9(3):255-271. https://doi.org/10.1007/s13679-020-00396-9.
- Alhabeeb H, AlFaiz A, Kutbi E, AlShahrani D, Alsuhail A, AlRajhi S et al. Gut Hormones in Health and Obesity: The Upcoming Role of Short Chain Fatty Acids. Nutrients. 2021;13(2):481. https://doi.org/10.3390/nu13020481.
- Yao H, Fan C, Fan X, Lu Y, Wang Y, Wang R et al. Effects of gut microbiota on leptin expression and body weight are lessened by high-fat diet in mice. Br J Nutr. 2020;124(4):396-406. https://doi.org/10.1017/S0007114520001117.
- Yao H, Fan C, Lu Y, Fan X, Xia L, Li P et al. Alteration of gut microbiota affects expression of adiponectin and resistin through modifying DNA methylation in high-fat diet-induced obese mice. Genes Nutr. 2020;15(1):12. https://doi.org/10.1186/s12263-020-00671-3.
- Rekha K, Venkidasamy B, Samynathan R, Nagella P, Rebezov M, Khayrullin M et al. Short-chain fatty acid: An updated review on signaling, metabolism, and therapeutic effects. Crit Rev Food Sci Nutr. 2024;64(9):2461-2489. https://doi.org/10.1080/10408398.2022.2124231.
- Martínez-Cuesta MC, Del Campo R, Garriga-García M, Peláez C, Requena T. Taxonomic Characterization and Short-Chain Fatty Acids Production of the Obese Microbiota. Front Cell Infect Microbiol. 2021;11:598093. https://doi.org/10.3389/fcimb.2021.598093.
- Petraroli M, Castellone E, Patianna V, Esposito S. Gut Microbiota and Obesity in Adults and Children: The State of the Art. Front Pediatr. 2021;9:657020. https://doi.org/10.3389/fped.2021.657020.
- De la Cuesta-Zuluaga J, Mueller NT, Álvarez-Quintero R, Velásquez-Mejía EP, Sierra JA, Corrales-Agudelo V et al. Higher Fecal Short-Chain Fatty Acid Levels Are Associated with Gut Microbiome Dysbiosis, Obesity, Hypertension and Cardiometabolic Disease Risk Factors. Nutrients. 2018;11(1):51. https://doi.org/10.3390/nu11010051.
- Wang Y, Wang H, Howard AG, Meyer KA, Tsilimigras MCB, Avery CL et al. Circulating Short-Chain Fatty Acids Are Positively Associated with Adiposity Measures in Chinese Adults. Nutrients. 2020;12(7):2127. https://doi.org/10.3390/nu12072127.
- Müller M, Hernández MAG, Goossens GH, Reijnders D, Holst JJ, Jocken JWE et al. Circulating but not faecal short-chain fatty acids are related to insulin sensitivity, lipolysis and GLP-1 concentrations in humans. Sci Rep. 2019;9(1):12515. https://doi.org/10.1038/s41598-019-48775-0.
- Ferrer-Picón E, Dotti I, Corraliza AM, Mayorgas A, Esteller M, Perales JC et al. Intestinal Inflammation Modulates the Epithelial Response to Butyrate in Patients With Inflammatory Bowel Disease. Inflamm Bowel Dis. 2020;26(1):43-55. https://doi.org/10.1093/ibd/izz119.
- Rahat-Rozenbloom S, Fernandes J, Gloor GB, Wolever TM. Evidence for greater production of colonic short-chain fatty acids in overweight than lean humans. Int J Obes (Lond). 2014;38(12):1525-1531. https://doi.org/10.1038/ijo.2014.46.
- Lin HV, Frassetto A, Kowalik EJJr, Nawrocki AR, Lu MM, Kosinski JR et al. Butyrate and propionate protect against diet-induced obesity and regulate gut hormones via free fatty acid receptor 3-independent mechanisms. PLoS ONE. 2012;7(4):e35240. https://doi.org/10.1371/journal.pone.0035240.
- Chambers ES, Viardot A, Psichas A, Morrison DJ, Murphy KG, Zac-Varghese SE et al. Effects of targeted delivery of propionate to the human colon on appetite regulation, body weight maintenance and adiposity in overweight adults. Gut. 2015;64(11):1744-1754. https://doi.org/10.1136/gutjnl-2014-307913.
- Bonomo RR, Cook TM, Gavini CK, White CR, Jones JR, Bovo E et al. Fecal transplantation and butyrate improve neuropathic pain, modify immune cell profile, and gene expression in the PNS of obese mice. Proc Natl Acad Sci USA. 2020;117(42):26482-26493. https://doi.org/10.1073/pnas.2006065117.
- Yin XQ, An YX, Yu CG, Ke J, Zhao D, Yu K. The Association Between Fecal Short-Chain Fatty Acids, Gut Microbiota, and Visceral Fat in Monozygotic Twin Pairs. Diabetes Metab Syndr Obes. 2022;15:359-368. https://doi.org/10.2147/DMSO.S338113.
- Rios-Covian D, González S, Nogacka AM, Arboleya S, Salazar N, Gueimonde M, de Los Reyes-Gavilán CG. An Overview on Fecal Branched Short-Chain Fatty Acids Along Human Life and as Related With Body Mass Index: Associated Dietary and Anthropometric Factors. Front Microbiol. 2020;11:973. https://doi.org/10.3389/fmicb.2020.00973.
- Fan L, Xia Y, Wang Y, Han D, Liu Y, Li J et al. Gut microbiota bridges dietary nutrients and host immunity. Sci China Life Sci. 2023;66(11):2466-2514. https://doi.org/10.1007/s11427-023-2346-1.
- Gozdzik P, Magkos F, Sledzinski T, Mika A. Monomethyl branched-chain fatty acids: Health effects and biological mechanisms. Prog Lipid Res. 2023;90:101226. https://doi.org/10.1016/j.plipres.2023.101226.
- Ramos Meyers G, Samouda H, Bohn T. Short Chain Fatty Acid Metabolism in Relation to Gut Microbiota and Genetic Variability. Nutrients. 2022;14(24):5361. https://doi.org/10.3390/nu14245361.
- Ezzine C, Loison L, Montbrion N, Bôle-Feysot C, Déchelotte P, Coëffier M et al. Fatty acids produced by the gut microbiota dampen host inflammatory responses by modulating intestinal SUMOylation. Gut Microbes. 2022;14(1):2108280. https://doi.org/10.1080/19490976.2022.2108280.
- Ran-Ressler RR, Khailova L, Arganbright KM, Adkins-Rieck CK, Jouni ZE, Koren O et al. Branched chain fatty acids reduce the incidence of necrotizing enterocolitis and alter gastrointestinal microbial ecology in a neonatal rat model. PLoS ONE. 2011;6(12):e29032. https://doi.org/10.1371/journal.pone.0029032.
- Van den Abbeele P, Ghyselinck J, Marzorati M, Koch AM, Lambert W, Michiels J et al. The Effect of Amino Acids on Production of SCFA and bCFA by Members of the Porcine Colonic Microbiota. Microorganisms. 2022;10(4):762. https://doi.org/10.3390/microorganisms10040762.
- Gasaly N, Hermoso MA, Gotteland M. Butyrate and the Fine-Tuning of Colonic Homeostasis: Implication for Inflammatory Bowel Diseases. Int J Mol Sci. 2021;22(6):3061. https://doi.org/10.3390/ijms22063061.
- Mahawar KK, Sharples AJ. Contribution of Malabsorption to Weight Loss After Roux-en-Y Gastric Bypass: a Systematic Review. Obes Surg. 2017;27(8):2194-2206. https://doi.org/10.1007/s11695-017-2762-y.
- Sanna S, van Zuydam NR, Mahajan A, Kurilshikov A, Vich Vila A, Võsa U et al. Causal relationships among the gut microbiome, short-chain fatty acids and metabolic diseases. Nat Genet. 2019;51(4):600-605. https://doi.org/10.1038/s41588-019-0350-x.
- Ecklu-Mensah G, Choo-Kang C, Maseng MG, Donato S, Bovet P, Viswanathan B et al. Gut microbiota and fecal short chain fatty acids differ with adiposity and country of origin: the METS-microbiome study. Nat Commun. 2023;14(1):5160. https://doi.org/10.1038/s41467-023-40874-x.








