
Журнал "Медицинский совет" №11/2024
DOI: 10.21518/ms2024-247
Г.А. Полев1,2, https://orcid.org/0000-0002-7175-6417
Н.С. Грачев1, https://orcid.org/0000-0002-4451-3233
Р.С. Оганесян1, https://orcid.org/0000-0002-1698-2956
Е.Ю. Яременко1, https://orcid.org/0000-0003-1196-5070
1 Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева; 117997, Россия, Москва, ул. Саморы Машела, д. 1
2 Ильинская больница; 143421, Россия, Московская область, Красногорск, д. Глухово, ул. Рублевское предместье, д. 2, корп. 2
Введение. Улучшение и прогнозирование функционального состояния пациентов с лимфатической мальформацией головы и шеи, включая внеорганную шейную локализацию, остается важной социально-экономической проблемой. На момент публикации данной статьи не было обнаружено научных работ, посвященных комплексному анализу причинно-следственных связей изменения функционального состояния данной группы пациентов.
Цель. Выявить причинно-следственные связи изменения функционального состояния пациентов с лимфатической мальформацией внеорганной шейной локализации и создать прогностическую модель ухудшения их функционального состояния.
Материалы и методы. В ходе ретроспективного выборочного исследования выполнен комплексный анализ функционального состояния 115 пациентов детского и подросткового возраста от 1 мес. до 17 лет с медианой возраста 2,1 (0,4; 5,5) года, перенесших хирургическое лечение и (или) склеротерапию лимфатической мальформации внеорганной шейной локализации в условиях Национального медицинского исследовательского центра детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева в период с мая 2012 по декабрь 2022 г. включительно согласно шкале Cologne Disease Score в зависимости от гистологического типа лимфатических мальформаций (микро-, макроцистный или смешанный) и стадии по классификации de Serres.
Результаты и обсуждение. В ходе исследования было выявлено, что переменные «смешанный тип лимфатической мальформации», «V стадия по классификации de Serres» и «необходимость хирургического лечения» являлись клинически и статистически значимыми прогностическими факторами ухудшения функционального состояния пациентов с лимфатической мальформацией внеорганной шейной локализации, снижая показатели шкалы CDS на 0,976–4,514 балла соответственно, что позволило создать прогностическую модель ухудшения функционального состояния данной группы пациентов.
Заключение. Сформулированная в ходе исследования прогностическая модель ухудшения функционального состояния пациентов с лимфатической мальформацией внеорганной шейной локализации учитывает влияние гистологического типа, локализации, а также метода лечения и может быть рекомендована для применения в клинической практике специализированных лечебных учреждений.
Для цитирования: Полев ГА, Грачев НС, Оганесян РС, Яременко ЕЮ. Факторы риска ухудшения функционального состояния пациентов с лимфатической мальформацией внеорганной шейной локализации. Медицинский Совет. 2024;(11):202–209. https://doi.org/10.21518/ms2024-247
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Risk factors for functional state deterioration in patients with lymphatic malformation occuring in the neck region
Georgiy A. Polev1,2, https://orcid.org/0000-0002-7175-6417
Nikolai S. Grachev1, https://orcid.org/0000-0002-4451-3233
Raisa S. Oganesyan1, https://orcid.org/0000-0002-1698-2956
Ekaterina Yu. Yaremenko1, https://orcid.org/0000-0003-1196-5070
1 Dmitry Rogachev National Medical Research Center of Pediatric Hematology, Oncology and Immunology; 1, Samora Mashel St., Moscow, 117997, Russia
2 Ilyinskaya Hospital; 2, Bldg. 2, Rublevskoe Predmestie St., Glukhovo Settlement, Krasnogorsk, Moscow Region, 143421, Russia
Introduction. The improvement and prediction of functional status in patients with lymphatic malformations of the head and neck, particularly in neck masses, remains a pressing socio-economic concern. As of the publication of this article, no comprehensive scientific studies have explored the cause-and-effect relationships that impact the functional status of this specific patient demographic.
Aim. To elucidate the cause-and-effect relationships impacting the functional status of patients with cervical lymphatic malformations and to develop a predictive model for their functional decline.
Materials and methods. A retrospective cohort study was conducted, involving a detailed analysis of the functional status of 115 paediatric and adolescent patients aged 1 month to 17 years, treated for cervical lymphatic malformations at the Dmitry Rogachev National Medical Research Center for Pediatric Hematology, Oncology, and Immunology, from May 2012 to December 2022. The analysis utilised the Cologne Disease Score (CDS), varying according to the histological type of the lymphatic malformations (microcystic, macrocystic, or mixed) and the staging of the de Serres classification.
Results and discussion. The study involved 115 patients with a median age of 2.1 years (ranging from 0.4 to 5.5 years). It was determined that the ‘Mixed lymphatic malformations type,’ ‘Stage V of the de Serres classification,’ and ‘Need for surgical treatment’ were clinically and statistically significant prognostic factors for the deterioration of functional status in these patients, reducing the CDS scores by 0.976 to 4.514 points, respectively. These findings supported the development of a predictive model for worsening functional status in this group.
Conclusion. The predictive model formulated during this research accounts for the histological type, location, and treatment modality, and is recommended for clinical application within specialised medical institutions.
For citation: Polev GA, Grachev NS, Oganesyan RS, Yaremenko EY. Risk factors for functional state deterioration in patients with lymphatic malformation occuring in the neck region. Meditsinskiy sovet = Medical Council. 2024;(11):202–209. https://doi.org/10.21518/ms2024-247
Conflict of interest: the authors declare no conflict of interest.
Введение
Лимфатическая мальформация (ЛМ) – врожденная непролиферативная мальформация лимфатических дренажных путей (уст. – лимфангиома) [1]. Несмотря на ряд выявленных мутаций, ассоциированных с развитием ЛМ, отсутствует понимание точных этиологических и патогенетический механизмов их развития [1, 2]. Частота встречаемости ЛМ составляет от 1 на 6000 живых новорожденных до 1 на 16 000, или 6,4–6,9 случая ЛМ на 100 000 здоровых детей в отсутствие половых и расовых различий, представляя собой редкую нозологию сосудистых мальформаций [1, 3, 4].
Выделяют простые и сложные (ассоциированные с иными сосудистыми мальформациями или синдромальные формы, при которых также отмечены дополнительные симптомы, не связанные с сосудистой мальформацией) ЛМ [2, 5, 6]. По классификации сосудистых образований ISSVA 2018 (International Society for the Study of Vascular Anomalies) выделяют три гистологических типа простых форм ЛМ:
– макроцистные (диаметр кист – более 1 см);
– микроцистные (диаметр кист – менее 1 см);
– смешанный тип.
Несмотря на наиболее частую локализацию ЛМ в области головы и шеи (до 75% всех случаев) [6, 7], недостаточное внимание уделяется внеорганной шейной локализации (ВШЛ) ЛМ. Так, в наиболее широко применяемой классификации локализации ЛМ головы и шеи, предложенной L.M. de Serres et al., выделяют 5 стадий, учитывающих локализацию по отношению к срединной линии и подъязычной кости и долю развития осложнений, и учитывают наличие билатеральной инфархиоидальной локализации:
– I стадия – унилатеральная инфрахиоидиальная;
– II стадия – унилатеральная супрахиоидальная;
– III стадия – унилатеральная супра- и инфрахиоидальная;
– IV стадия – билатеральная супрахиоидальная;
– V стадия – билатеральная супра- и инфрахиоидальная [8].
Расположение ЛМ в области ВШЛ с выходом за пределы шеи и без него может быть ассоциировано со стойкими косметическими дефектами и функциональными нарушениями: дисфагия, дыхательная недостаточность, нарушение речи [9]. Значимый вклад в оценку функционального состояния пациентов с ЛМ головы и шеи внесли C. Wittekindt et al., предложив в 2006 г. шкалу CDS (Cologne Disease Score), выделяющую функциональное состояние средней тяжести (7–10 баллов), тяжелое (4–6 баллов) и крайне тяжелое (0–3 балла) [10].
В условиях сохраняющейся проблемы отсутствия широко принятых стандартизированных подходов к терапии ЛМ с локализацией в области головы и шеи, включая ВШЛ, проблема прогнозирования, сохранения и улучшения функционального состояния пациентов остается острой [3, 6, 7, 11, 12].
Целью данного исследования является анализ данных пациентов детского и подросткового возраста с ЛМ ВШЛ для выявления причинно-следственных связей изменения функционального состояния пациентов и создание прогностической модели ухудшения их функционального состояния.
Материалы и методы
Данное исследование является ретроспективным выборочным с количественной методологией описания данных с неслучайным методом включения пациентов. Катамнестические данные пациентов собирались динамически путем телефонного опроса, а также очного посещения пациентами Национального медицинского исследовательского центра детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева (НМИЦ ДГОИ). В исследование включены 115 пациентов в возрасте от 1 мес. до 17 лет, перенесшие хирургическое лечение и (или) склеротерапию ЛМ ВШЛ в условиях НМИЦ ДГОИ в период с мая 2012 по декабрь 2022 г. включительно. Во всех случаях был определен гистологический тип мальформации (микро-, макроцистный или смешанный). Также все пациенты были стадированы согласно классификации de Serres [8] и шкале CDS (Cologne Disease Score) [10]. Проводился статистический анализ данных анамнеза, клинических и катамнестических данных, а также анатомо-топографических особенностей ЛМ в зависимости от гистологического типа и стадии по классификации de Serres. В случае наличия пропущенных данных пациент исключался из исследования.
Статистические методы анализа данных. Во всех случаях проводилась комплексная проверка соблюдения необходимых условий применения статистических критериев. За традиционный уровень значимости исследования было принято значение 0,05 (при сравнении двух групп), по показаниям применялась поправка Бонферрони: при сравнении трех групп за уровень значимости исследования было принято 0,017, при сравнении четырех групп за уровень значимости принималось значение 0,0085. По показаниям применялись критерии Краскела – Уоллиса, Манна – Уитни, двусторонний критерий Фридмана, критерий χ2 Пирсона с поправкой на правдоподобие, а также точный двусторонний критерий Фишера и множественный линейный регрессионный анализ. Применялся статистический пакет IBM SPSS Statistics 26.
Результаты
В ходе исследования были проанализированы данные 115 пациентов (50 девочек и 65 мальчиков) с ЛМ ВШЛ. Медиана возраста на момент инициальной находки новообразования составила 2,0 (0,0; 726,0) суток жизни: пренатальная диагностика была представлена в 17,4% (n = 20) случаев. Медиана возраста пациентов на момент первичной госпитализации в НМИЦ ДГОИ составила 2,1 (0,4; 5,5) года. Более подробно данные пациентов и топографо-анатомические особенности ЛМ, в том числе в зависимости от гистологического типа, представлены в табл. 1.
Таблица 1. Результаты сравнительного анализа показателей пациентов в зависимости от гистологического типа лимфатической мальформации внеорганной шейной локализации
| Изучаемый признак | Выборочная совокупность (n = 115) | Группа А (n = 15) | Группа Б (n = 48) | Группа В (n = 52) | Результаты статистического анализа | ||
| Возраст инициальной находки, Me [Q1; Q3] (min – max), сутки от рождения | 2,0 [0,0; 726,0] (–141,0…6319,0) | 7,0 [–20,0; 980,0] (–31,0…3968,0) | 0,0 [–13,5; 361,5] (–141,0…3005,0) | 291,0 [0,0; 1635,3] (–141,0…6319,0) |
H = 10,138, p = 0,006; U(А–Б) = 342,500, p = 0,775; U(А–В) = 274,000, p = 0,076; U(Б–В) = 808,000, p = 0,002 |
||
| Период дебюта, n (%) | Пренатальный | 20 (17,4) | 4 (26,7) | 13 (27,1) | 3 (5,8) |
χ2(6) = 15,261, p = 0,018 |
|
| Неонатальный (0–28 суток) | 41 (35,7) | 6 (40,0) | 17 (35,4) | 18 (34,6) | |||
| От 1 мес. до 1 года | 13 (11,3) | 0 (0,0) | 6 (12,5) | 7 (13,5) | |||
| Старше 1 года | 41 (35,7) | 5 (33,3) | 12 (25,0) | 24 (46,2) | |||
| Пол, n (%) | Женщины | 50 (43,5) | 5 (33,3) | 23 (47,9) | 22 (42,3) |
χ2(2) = 1,056, p = 0,590 |
|
| Мужчины | 65 (56,5) | 10 (66,7) | 25 (52,1) | 30 (57,7) | |||
| Возраст на момент первичной госпитализации в НМИЦ ДГОИ, Me [Q1; Q3] (min – max), годы | 2,1 [0,4; 5,5] (0,1–17,7) | 3,3 [0,3; 8,6] (0,2–15,6) | 1,4 [0,3; 3,8] (0,1–16,6) | 2,1 [0,7; 7,3] (0,1–17,7) |
H = 3608,0, p = 0,165 |
||
| Классификация de Serres* | I | 22 (19,8) | 4 (28,6) | 6 (13,0) | 12 (23,5) |
χ2(6) = 8,706, p = 0,191 |
|
| II | 36 (32,4) | 5 (35,7) | 17 (37,0) | 14 (27,5) | |||
| III | 37 (33,3) | 2 (14,3) | 14 (30,4) | 21 (41,2) | |||
| V | 16 (14,4) | 3 (21,4) | 9 (19,6) | 4 (7,8) | |||
| Выход ЛМ за пределы шеи, n (%) | 79 (68,7) | 10 (66,7) | 40 (83,3) | 29 (55,8) |
χ2(2) = 9,206, p = 0,010 |
||
| Шкала CDS до лечения в НМИЦ ДГОИ, Me [Q1; Q3] (min – max), балл | 7,0 [5,0; 7,0] (0,0–9,0) | 7,0 [5,0; 7,0] (4,0–7,0) | 6,0 [4,3; 7,0] (0,0–9,0) | 7,0 [5,3; 7,0] (0,0–8,0) |
H = 2,383, p = 0,304 |
||
| Интерпретация шкалы CDS по Wittekindt до операции/склерозирования | Moderate | 57 (49,6) | 8 (53,3) | 19 (39,6) | 30 (57,7) |
χ2(4) = 6,585, p = 0,160 |
|
| Advanced | 47 (40,9) | 7 (46,7) | 23 (47,9) | 17 (32,7) | |||
| Severe | 11 (9,6) | 0 (0,0) | 6 (12,5) | 5 (9,6) | |||
| Наличие хирургического вмешательства по месту жительства, n (%) | 32 (27,8) | 5 (33,3) | 15 (31,3) | 12 (23,1) |
χ2(2) = 1,099, p = 0,577 |
||
| Предоперационный объем новообразования по данным МРТ при первичном поступлении в НМИЦ ДГОИ, Me [Q1; Q3] (min – max), см3 | 76,0 [28,0; 168,0] (1,9–1417,0) | 95,7 [29,3; 215,7] (8,2–693,0) | 55,3 [23,1; 156,6] (6,0–1417,0) | 99,8 [35,3; 160,5] (1,9–659,0) |
H = 1,262, p = 0,532 |
||
| Объем терапии в НМИЦ ДГОИ, n (%) | Хирургическое лечение | 34 (29,6) | 5 (33,3) | 12 (25,0) | 17 (32,7) |
χ2(4) = 2,739, p = 0,602 |
|
| Склеротерапия** | 60 (52,2) | 6 (40,0) | 29 (60,4) | 25 (48,1) | |||
| Хирургия + склеротерапия | 21 (18,3) | 4 (26,7) | 7 (14,6) | 10 (19,2) | |||
Примечание. Группа А – микроцистный тип; группа Б – смешанный тип; группа В – макроцистный тип; НМИЦ ДГОИ – Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева; ЛМ – лимфатическая мальформация; МРТ – магнитно-резонансная томография.
* Также были отмечены 2 (1,7%) случая IV стадии (билатеральное супрахиодальное расположение) в группе Б и 1 (0,89%) – в группе А, а также 1 случай билатерального инфрахиодального расположения в группе Б.
** В 13,3% (n = 8) данных случаев выполнялось хирургического лечение по месту жительства, предшествующее склеротерапии, проведенной в НМИЦ ДГОИ.
При анализе особенностей ЛМ ВШЛ было выявлено, что выход за пределы шейной области представлен в 68,7% (n = 79) случаев. Согласно классификации de Serres [8], наиболее часто встречаемой стадией являлась II (32,4%; n = 36) – унилатеральное супрахиоидальное расположение, а также III (33,3%; n = 37) – унилатеральное супра- и инфрахиодальное расположение. Также был выявлен 1 (0,87%) случай билатеральной инфрахиоидальной локализации ЛМ. Микроцистный тип ЛМ встречался наиболее редко и был представлен в 13,0% (n = 15) случаев, макроцистный – в 45,2% (n = 52), смешанный тип – в 41,7% (n = 48). Медиана предоперационного объема ЛМ при первичном поступлении пациента в НМИЦ ДГОИ составила 76,0 (28,0; 168,0) см3, при этом, несмотря на клинически значимо наименьшую медиану объема смешанных ЛМ (55,3 см3 против 95,7 и 99,8 см3 для смешанного, микро- и макроцистного типов соответственно), отсутствовали статистически значимые различия объема ЛМ вне зависимости от гистологического типа (H = 1,262; p = 0,532).
При оценке влияния гистологического типа ЛМ на функциональное состояние пациентов, несмотря на отсутствие статистически значимых отличий на момент первичного поступления в НМИЦ ДГОИ (H = 2,383, p = 0,304, χ2(4) = 6,585, p = 0,160), отмечались статистически значимые различия после первой операции в НМИЦ ДГОИ (H = 9,531, p = 0,009) и на момент последнего наблюдения (H = 2,383, p = 0,304), что также отражено в табл. 1 и на рис. 1.
Рисунок 1. Сравнительный анализ тяжести функционального состояния пациентов с лимфатической мальформацией внеорганной локализации в зависимости от гистологического типа
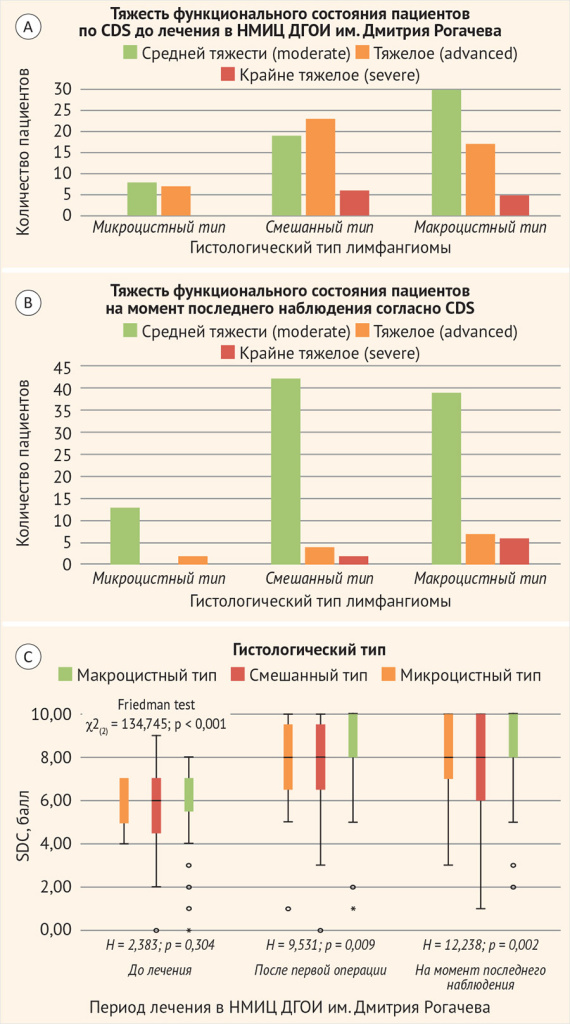
НМИЦ ДГОИ – Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева.
А – до лечения в НМИЦ ДГОИ; B – на момент последнего наблюдения в НМИЦ ДГОИ; C – в период лечения в НМИЦ ДГОИ.
Важно отметить, что, несмотря на отсутствие статистически значимых различий функционального состояния пациентов на предоперационном этапе в зависимости от гистологического типа мальформации, смешанные ЛМ обладали наименее благоприятными показателями на каждом этапе наблюдения пациентов, что наглядно отражено на рис. 1. Так, медианное значение, соответствующее тяжелому функциональному состоянию (CDS 4–6 баллов) на предоперационном этапе было представлено только в группе смешанных ЛМ ВШЛ: 6,0 (4,3; 7,0) против 7,0 (5,0; 7,0) и 7,0 (5,3; 7,0) для смешанных, микро- и макроцистных ЛМ соответственно. При этом, несмотря на клинически и статистически значимое улучшение функционального состояния пациентов (Friedman test χ2(2) = 134,745, p < 0,001), как после первой операции (Uсмеш.-макро = 843,500, p = 0,004), так и на момент последнего наблюдения (Uсмеш.-макро = 775,00, p < 0,001) сохранялись клинически и статистически значимо наименее благоприятные показатели у пациентов со смешанным гистологическим типом по сравнению с макроцистным.
При анализе функционального состояния пациентов в зависимости от локализации ЛМ по классификации de Serres, напротив, имели место клинически и статистически значимые различия до начала терапии (H = 41,238, p < 0,001), при этом наименее благоприятные показатели отмечались при V стадии, а наиболее благоприятные – при I (p < 0,0085 во всех случаях апостериорного сравнения с I и V стадией, согласно поправке Бонферрони при сравнении 4 групп, исключая IV стадию), что отражено на рис. 2. На момент последнего наблюдения сохранялась та же клинически и статистически значимая тенденция (H = 32,802, p < 0,001), исключением из которой являлось апостериорное сравнение I и II стадии, которое не выявило статистически значимых различий с учетом поправки Бонферрони (UI–II = 268,000, p = 0,015 при p > 0,0085).
Рисунок 2. Сравнительный анализ тяжести функционального состояния пациентов с лимфатической мальформацией внеорганной локализации в зависимости от ее локализации согласно классификации de Serres
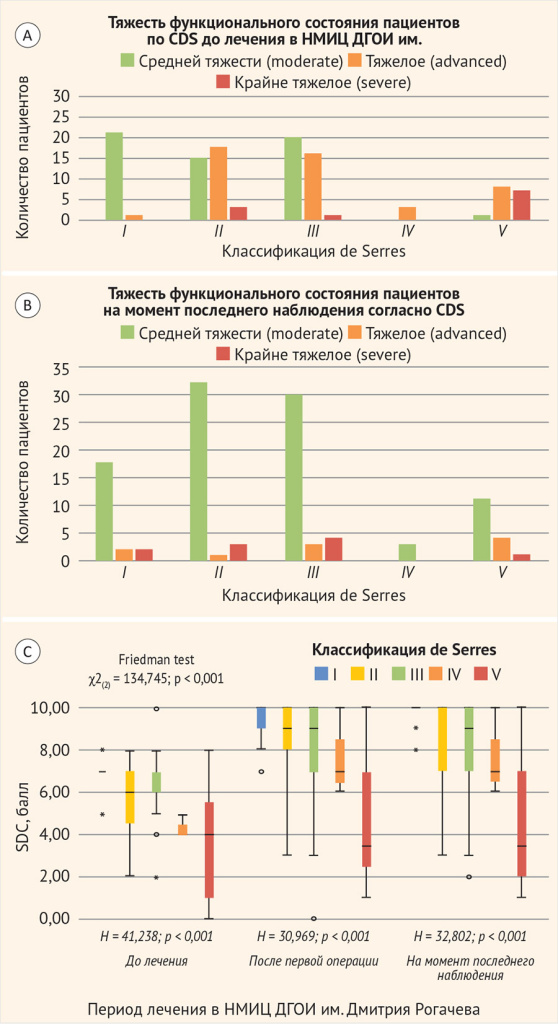
НМИЦ ДГОИ – Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева.
А – до лечения в НМИЦ ДГОИ; B – на момент последнего наблюдения в НМИЦ ДГОИ; C – в период лечения в НМИЦ ДГОИ.
Единственный случай билатеральной инфрахиодиальной локализации ЛМ не представлен на рис. 2, он имел 6 баллов по шкале CDS на всех этапах наблюдения (ввиду наличия продолженного роста).
Порядка 1/3 всех пациентов (27,8%, n = 32) имели эпизод первичного хирургического вмешательства по месту жительства, предшествующий лечению в НМИЦ ДГОИ. Наиболее частым методом лечения в НМИЦ ДГОИ служила склеротерапия в отсутствие хирургического лечения (52,2%, n = 60), однако важно отметить, что в 13,3% (n = 8) данных случаев по месту жительства выполнялось хирургическое лечение, предшествующее склеротерапии, проведенной в условиях нашего центра. Хирургическое лечение в отсутствие склеротерапии отмечено в 29,6% (n = 34) случаев, хирургическое лечение со склеротерапией представлено в 18,3% (n = 21) случаев. Объем терапии не зависел от гистологического типа ЛМ ВШЛ (χ2(4) = 2,739, p = 0,602), что позволяет провести дальнейший сравнительный анализ результатов лечения, представленный на рис. 3. Медиана продолжительности катамнестического наблюдения от первичной госпитализации в НМИЦ ДГОИ до последнего наблюдения составила 6,5 (1,0; 21,5) мес. Более подробно об алгоритме выбора метода лечения и его результатах можно прочитать в следующей статье данной серии, посвященной методам лечения ЛМ ВШЛ.
Рисунок 3. Результаты сравнительного анализа результатов лечения или изменения функционального состояния пациентов от поступления в НМИЦ ДГОИ до последнего наблюдения
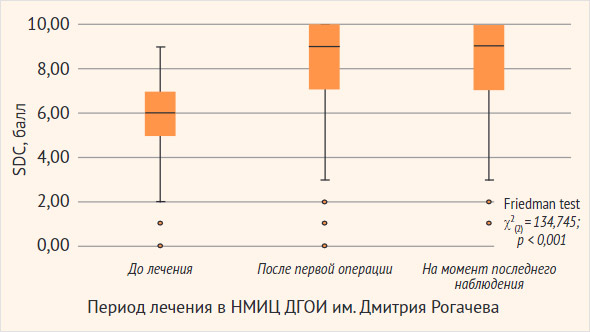
НМИЦ ДГОИ – Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева.
Так, согласно данным, представленным на рис. 3, отмечалось клинически (состояние пациентов изменилось от тяжелого при поступлении до средней тяжести после первой операции и на момент последнего наблюдения) и статистически значимое улучшение показателей согласно шкале CDS (Friedman test χ2(2) = 134,745, p < 0,001). Дальнейшее апостериорное сравнение выявило статистически значимое улучшение показателей после первой операции (–9,132, p < 0,001), а также при последнем наблюдении по сравнению с поступлением в НМИЦ ДГОИ (–9,165, p < 0,001), но не выявило различий в период между первой операцией и последним наблюдением (–0,033, p = 0,974), что может быть ассоциировано с наличием 17,4% (n = 20) случаев, рефрактерных к проводимой терапии ЛМ ВШЛ, при которых отмечался продолженный рост вне зависимости от объема проводимой терапии. Важно отметить, что, несмотря на их наличие, медианные показатели функционального состояния пациентов составили 6,0 (5,0; 7,0) балла на момент поступления (до лечения), 9,0 (7,0; 10,0) – после первой операции и 9,0 (7,0; 10,0) – на момент последнего наблюдения соответственно (Friedman test χ2(2) = 134,745, p < 0,001), что в совокупности свидетельствует о возможности клинически и статистически значимого улучшения функционального состояния пациентов вне зависимости гистологического типа и стадии de Serres ЛМ ВШЛ.
С целью объективизации анализа дифференциальной диагностики функционального состояния пациентов после перенесенного лечения в условиях специализированного лечебного учреждения был выполнен поиск прогностических факторов снижения показателя CDS и определения конфаундинг-эффекта (выявление дополнительно вмешивающихся факторов, влияющих на факторы риска и переменную исхода). Наиболее значимая прогностическая модель ухудшения функционального состояния пациентов после проведенной терапии представлена в табл. 2.
Таблица 2. Наиболее значимая прогностическая модель ухудшения функционального состояния пациентов с лимфатической мальформацией внеорганной шейной локализации
| Признак | b | 95% ДИ для b | Β (стандарт. b) | p | |
| нижний | верхний | ||||
| Блок 1 | |||||
| Константа (b 0) | 10,141 | 9,343 | 10,939 | – | <0,001 |
| Выход ЛМ за пределы шеи | –0,541 | –1,306 | 0,223 | –0,104 | 0,164 |
| Смешанный тип ЛМ | –0,845 | –1,545 | –0,146 | –0,173 | 0,018 |
| V стадия по классификации de Serres | –4,334 | –5,381 | –3,287 | –0,587 | <0,001 |
| Необходимость хирургического лечения | –1,089 | –1,819 | –0,360 | –0,206 | 0,004 |
| Блок 2 | |||||
| Константа (b 0) | 9,832 | 9,162 | 10,502 | – | <0,001 |
| Смешанный тип ЛМ | –0,976 | –1,654 | –0,297 | –0,199 | 0,005 |
| V стадия по классификации de Serres | –4,514 | –5,534 | –3,493 | –0,611 | <0,001 |
| Необходимость хирургического лечения | –1,069 | –1,802 | –0,337 | –0,202 | 0,005 |
Примечание. ЛМ – лимфатическая мальформация; R2 (коэффициент детерминации) = 0,454 для блока 1 (p = 0,001); для блока 2 ΔR2 = –0,009 (p = 0,164); adjusted R2 (скорректированное по формуле Стейна значение коэффициента детерминации) для блока 1 = 0,413; для блока 2 = 0,523, что говорит о том, какую долю вариабельности функционального состояния пациентов объясняла бы эта модель, если бы она была построена на данных всей популяции, из которой была извлечена выборка; метод ввода переменных – Backward (метод последовательного исключения).
Согласно представленным в табл. 2 данным, переменная «выход ЛМ за пределы шеи» не оказывала статистически значимого влияния на функциональное состояние пациентов с ЛМ ВШЛ и была исключена из прогностической модели согласно критерию шагового отбора исключения из модели при значении вероятности переменной 0,01 и менее. При этом переменные «смешанный тип ЛМ», «V стадия по классификации de Serres» и «необходимость хирургического лечения» являлись клинически и статистически значимыми прогностическими факторами ухудшения функционального состояния пациентов с ЛМ ВШЛ, снижая показатели шкалы CDS на 0,976–4,514 балла соответственно. Данная модель способна объяснить более половины случаев вариабельности функционального состояния пациентов, если бы она была построена на данных всей популяции, из которой была извлечена изучаемая выборочная совокупность, что отражает высокую репрезентативность данной модели и позволяет рекомендовать ее для использования в клинической практике специализированных лечебных учреждений.
Обсуждение
Значимой особенностью ЛМ ВШЛ является высокий риск функционального дефицита даже при наличии образования относительно малых размеров [4]. В качестве основной цели любого метода хирургического лечения сосудистых мальформаций является достижение оптимальных функциональных и эстетических показателей. Однако радикальное хирургическое удаление ЛМ может быть затруднено или невозможно ввиду инфильтративного характера распространения данной мальформации (в особенности смешанного и микроцистного гистологических типов) и высокой склонности ЛМ к развитию продолженного роста, а также стремления врачей к сохранению и повышению функционального состояния пациента [6, 7, 11–13]. Отсутствие стандартизированных алгоритмов выбора оптимального метода лечения дополнительно затрудняет прогнозирование функционального состояния пациентов.
В ходе проведенного обзора литературы не было выявлено статей, посвященных прецизионной оценке ассоциации между гистологическим типом, локализацией согласно стадии de Serres и функциональным состоянием пациентов с ЛМ ВШЛ с распространением за пределы шеи или без него. Однако в ходе данного поиска была выявлена статья, анализирующая ассоциацию данных показателей у пациентов с ЛМ головы и шеи, среди которых отмечено 47,2% (n = 68) пациентов с локализацией ЛМ в области шеи [13]. Так, при сравнении результатов исследования S. Wiegand et al. и текущего исследования было подтверждено, что смешанный гистологический тип ЛМ во всех случаях ассоциирован с наименее благоприятным функциональным состоянием пациентов [13]. При этом в ходе текущего исследования также подтвердилось предположение S. Wiegand et al., отметивших V стадию de Serres (CDS 4,26) в качестве клинически и статистически значимо наименее благоприятной стадии и I стадию (CDS 9,13) – в качестве наиболее благоприятной в послеоперационном периоде [13]. Важно отметить, что в рамках иных исследований функциональное состояние пациентов прямо зависело от стадии по классификации de Serres [8, 13–16], однако в условиях НМИЦ ДГОИ функциональное состояние пациентов с II–IV стадией по классификации de Serres было сопоставимо с показателями I стадии.
Так, для нашего исследования медианные показатели для I–V стадий по классификации de Serres на момент последнего наблюдения составили 10 (10,0; 10,0), 10 (7,0; 10), 9 (7,0; 10), 7,0 (6,0; 9,0), 3,5 (2,0;7,0) балла соответственно, что свидетельствует, с одной стороны, о сохранении статуса V стадии как наименее благоприятной по классификации de Serres, однако, с другой стороны, говорит о клинически менее значительном влиянии стадии de Serres на функциональное состояния пациентов, перенесших лечение в условиях НМИЦ ДГОИ, несмотря на относительно высокую долю смешанного типа ЛМ (41,7%, n = 48) в изучаемой выборочной совокупности.
Несмотря на ретроспективный характер данного исследования, мы постарались исключить ограничения исследования, которые отмечали S. Wiegand et al.:
– все пациенты были стадированы согласно гистологическому типу, классификациям de Serres и CDS;
– пациенты с пропущенными данными исключались из исследования;
– катамнестическое наблюдение проводилось преимущественно в рамках одного лечебного учреждения: медиана наблюдения составила 6,5 (1,0; 21,5) мес.
Также важно отметить, что сама выборочная совокупность обладала низкой гетерогенностью. Кроме того, на момент написания данной статьи нами представлен анализ наиболее крупной описанной выборочной совокупности ЛМ ВШЛ. Это в совокупности значительно повышает репрезентативность результатов данного исследования и позволяет не только выявить наличие ассоциации между гистологическим типом, локализацией ЛМ и функциональным состоянием пациентов, как отметили S. Wiegand et al. [13], но и построить прогностическую модель ухудшения функционального состояния пациентов с ЛМ ВШЛ, которая отражает высокую вариабельность популяционных показателей и подтверждает наличие причинно-следственной связи между гистологическим типом ЛМ, локализацией согласно классификации de Serres и функциональным состоянием пациентов.
Заключение
В ходе исследования крупной репрезентативной выборочной совокупности пациентов детского и подросткового возраста с ЛМ ВШЛ были выявлены клинически и статистически значимые причинно-следственные связи гистологического типа, локализации и функционального состояния данной группы пациентов. Построенная в ходе исследования прогностическая модель ухудшения функционального состояния пациентов может быть рекомендована для применения в клинической практике специализированных лечебных учреждений.
Список литературы / References
Развернуть
- Chandra SR, Nair A, Nair S. Terminology and Classifications of Vascular Lesions Based on Molecular Identification. Oral Maxillofac Surg Clin North Am. 2024;36(1):35-48. https://doi.org/10.1016/j.coms.2023.09.010.
-
Kunimoto K, Yamamoto Y, Jinnin M. ISSVA Classification of Vascular Anomalies and Molecular Biology. Int J Mol Sci. 2022;23(4):2358. https://doi.org/10.3390/ijms23042358.
- Acevedo JL, Shah RK, Brietzke SE. Nonsurgical therapies for lymphangiomas: a systematic review. Otolaryngol Head Neck Surg. 2008;138(4):418-424. https://doi.org/10.1016/j.otohns.2007.11.018.
- Harsha WJ, Perkins JA, Lewis CW, Manning SC. Pediatric admissions and procedures for lymphatic malformations in the United States: 1997 and 2000. Lymphat Res Biol. 2005;3(2):58-65. https://doi.org/10.1089/lrb.2005.3.58.
- Wang MX, Kamel S, Elsayes KM, Guillerman RP, Habiba A, Heng L et al. Vascular Anomaly Syndromes in the ISSVA Classification System: Imaging Findings and Role of Interventional Radiology in Management. Radiographics. 2022;42(6):1598-1620. https://doi.org/10.1148/rg.210234.
- Kamhieh Y, Mitra R, Burnett T, Jones H, Roblin G, Hall A. Sirolimus for Pediatric Cervicofacial Lymphatic Malformation: A Systematic Review and Meta-Analysis. Laryngoscope. 2024;134(5):2038-2047. https://doi.org/10.1002/lary.31091.
- Zhou Q, Zheng JW, Mai HM, Luo QF, Fan XD, Su LX et al. Treatment guidelines of lymphatic malformations of the head and neck. Oral Oncol. 2011;47(12):1105-1109. https://doi.org/10.1016/j.oraloncology.2011.08.001.
- De Serres LM, Sie KC, Richardson MA. Lymphatic malformations of the head and neck. A proposal for staging. Arch Otolaryngol Head Neck Surg. 1995;121(5):577-582. https://doi.org/10.1001/archotol.1995.01890050065012.
- Kulungowski AM, Patel M. Lymphatic malformations. Semin Pediatr Surg. 2020;29(5):150971. https://doi.org/10.1016/j.sempedsurg.2020.150971.
- Wittekindt C, Michel O, Streppel M, Roth B, Quante G, Beutner D, Guntinas-Lichius O. Lymphatic malformations of the head and neck: introduction of a disease score for children, Cologne Disease Score (CDS). Int J Pediatr Otorhinolaryngol. 2006;70(7):1205-1212. https://doi.org/10.1016/j.ijporl.2005.12.013.
- Wu C, Song D, Guo L, Wang L. Refractory Head and Neck Lymphatic Malformation in Infants Treated With Sirolimus: A Case Series. Front Oncol. 2021;11:616702. https://doi.org/10.3389/fonc.2021.616702.
- Adams MT, Saltzman B, Perkins JA. Head and neck lymphatic malformation treatment: a systematic review. Otolaryngol Head Neck Surg. 2012;147(4):627-639. https://doi.org/10.1177/0194599812453552.
- Wiegand S, Wichmann G, Dietz A, Werner JA. Association between malformation type, location and functional deficits in lymphatic malformations of the head and neck in children. Eur Arch Otorhinolaryngol. 2023;280(5):2535-2540. https://doi.org/10.1007/s00405-023-07844-x.
- Wang S, Du J, Liu Y, Zhang J, Ge W, Zhang Y et al. Clinical analysis of surgical treatment for head and neck lymphatic malformations in children: a series of 128 cases. Acta Otolaryngol. 2019;139(8):713-719. https://doi.org/10.1080/00016489.2019.1616818.
- Hamoir M, Plouin-Gaudon I, Rombaux P, Francois G, Cornu AS, Desuter G et al. Lymphatic malformations of the head and neck: a retrospective review and a support for staging. Head Neck. 2001;23(4):326-337. https://doi.org/10.1002/hed.1039.
- Khanwalkar A, Valika T, Maddalozzo J. Long-term symptom control following resection of cervical lymphatic malformations: a case series. J Otolaryngol Head Neck Surg. 2020;49(1):19. https://doi.org/10.1186/s40463-020-00415-8.








