Журнал "Медицинский совет" №9/2024
DOI: 10.21518/ms2024-077
М.Ф. Петрухнова, О.О. Воронкова*, О.Е. Буянова, О.Н. Антюфеева, Камалова А.Э., М.В. Кожевникова, И.С. Ильгисонис, Ю.Н. Беленков
Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет); 119991, Россия, Москва, ул. Трубецкая, д. 8, стр. 2
В данной статье описан клинический случай рака легкого, симптоматика которого длительное время расценивалась как проявление пневмонии; раскрыты этапы диагностического поиска от первых симптомов рака до радикального лечения. Одновременно у пациентки была диагностирована моноклональная гаммапатия неясного значения, что на этапе дифференциальной диагностики позволяло предположить развитие синхронного рака – рак легкого и дебют множественной миеломы (ММ). Проанализирован ряд литературных источников, по итогам анализа установлено, что на данный момент в мире описано шесть случаев развития синхронного рака легких и ММ, в большинстве из которых возраст больных был меньше 70 лет, что указывает на относительно раннее развитие ММ. Рассмотрены вопросы дифференциальной диагностики пневмонии и рака легкого, подчеркивается важность раннего выявления злокачественного новообразования (особенно на амбулаторном этапе). Установлено, что в ряде случаев пневмония может маскировать рак, особенно характерно выявление неоплазии после диагностирования пневмонии верхнедолевой локализации. Высказано предположение о возможной общности патогенеза рака легкого и ММ, связанной с интенсивной экспрессией СD38, приведен пример положительного клинического эффекта на нерезектабельный рак легкого при применении даратумумаба (моноклональное антитело, блокирующее CD38, применяется в терапии ММ). В то же самое время представляется очень интересным выявленное наблюдение сочетанного развития онкологических заболеваний, поскольку у пациентов с разными видами рака, как правило, каждая опухоль имеет тенденцию к последовательному развитию. Однако наш случай проанализирован в сравнении с данными литературы со случаями сочетанного развития множественной миеломы и рака легких одновременно. При этом были выделены общие гены и связанные патогенезы прогрессирования двух типов опухолей за счет активации экспрессии гена-концентратора митохондриальной транс-2-еноил-КоА-редуктазы (MECR).
Для цитирования: Петрухнова МФ, Воронкова ОО, Буянова ОЕ, Антюфеева ОН, Камалова АЭ, Кожевникова МВ, Ильгисонис ИС, Беленков ЮН. Важность онконастороженности при дифференциальной диагностике воспалительных изменений в легких. Медицинский Совет. 2024;(9):100-107. https://doi.org/10.21518/ms2024-077
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
The importance of oncological alertness in the differential diagnosis of inflammatory changes in the lungsdetected as a result of differential diagnosis of pneumonia
Maria F. Petrukhnova, Olga O. Voronkova*, Olga E. Buyanova, Olga N. Antyufeeva, Asiyat E. Kamalova, Maria V. Kozhevnikova, Irina S. Ilgisonis, Yuri N. Belenkov
Sechenov First Moscow State Medical University (Sechenov University); 8, Bldg. 2, Trubetskaya St., Moscow, 119991, Russia
This article describes a case of lung cancer, the symptoms of which have long been regarded as manifestations of pneumonia; the stages of diagnostic search from the first symptoms of cancer to radical treatment are revealed. At the same time, the patient was diagnosed with monoclonal gammopathy of unknown significance, which at the stage of differential diagnosis suggested the development of synchronous cancer – lung cancer and the onset of multiple myeloma (MM). A number of literature sources were analyzed, according to the results of the analysis, it was found that at the moment six cases of the development of synchronous lung cancer and ММ have been described in the world, in most of which the age of patients was less than 70 years, which indicates a relatively early development of ММ. The issues of differential diagnosis of pneumonia and lung cancer are considered; the importance of early detection of malignant neoplasms (especially at the outpatient stage) is emphasized. It has been established that in some cases pneumonia can mask cancer, especially the detection of neoplasia after diagnosing pneumonia of the upper lobe localization. It has been suggested that the pathogenesis of lung cancer and ММ associated with intensive expression of CD38 may be common, and an example of a positive clinical effect on unresectable lung cancer with daratumumab is given (CD38-blocking monoclonal antibody used in MM therapy). At the same time, the revealed observation of the combined development of oncological diseases is very interesting, since in patients with different types of cancer, as a rule, each tumor tends to develop sequentially. However, our case was analyzed in comparison with literature data with cases of concomitant development of multiple myeloma and lung cancer simultaneously. At the same time, common genes and related pathogenesis of progression of two types of tumors were identified due to activation of the expression of the mitochondrial trans-2-enoyl-CoA reductase (MECR) concentrator gene.
For citation: Petrukhnova MF, Voronkova OO, Buyanova OE, Antyufeeva ON, Kamalova AE, Kozhevnikova MV, Ilgisonis IS, Belenkov YN. The importance of oncological alertness in the differential diagnosis of inflammatory changes in the lungsdetected as a result of differential diagnosis of pneumonia. Meditsinskiy sovet = Medical Council. 2024;(9):100-107. (In Russ.) https://doi.org/10.21518/ms2024-077
Conflict of interest: the authors declare no conflict of interest.
Введение
Пневмония – одна из самых частых патологий в мире. Ежегодно сотни тысяч пациентов обращаются за медицинской помощью с симптомами данного заболевания. Но во всех ли случаях пациенты действительно страдают пневмонией? Что может скрываться под маской этого распространенного заболевания и какие симптомы могут навести на мысль о правильном диагнозе? Практикующему врачу, в особенности на амбулаторном этапе, крайне важно не забывать о возможности редких патологий и нетипичных нозологических сочетаний. Однако наиболее важной целью врача является дифференциальная диагностика пневмонии и злокачественных новообразований легких.
Рак легких занимает значительное место среди всех злокачественных опухолей. Он стабильно удерживает лидирующую позицию по заболеваемости и смертности среди населения. Формирование опухоли в паренхиме легких может приводить к развитию пневмонии, которая будет скрывать опухоль при диагностических исследованиях. Кроме того, пневмония может носить очаговый характер и при использовании лучевых методов диагностики может имитировать очаговое новообразование. По данным D. Shepshelovich et al было установлено, что в течение первого года после госпитализации в стационар по поводу пневмонии рак легких был диагностирован у 8,14%. При этом имела значение локализация пневмонии – рак чаще развивался у пациентов, перенесших верхнедолевую пневмонию (23,8%) [1]. Также имеет значение гистологический тип опухоли: китайские ученые определили, что наиболее часто именно аденокарцинома имитирует пневмонию при лучевых методах исследования. Был выделен отдельный подтип опухоли – локализованная аденокарцинома легких пневмонического типа (L-PLADC). При ретроспективном сравнении компьютерных томограмм больных с аденокарциномами и пациентов с воспалительным поражением паренхимы легких были выявлены некоторые рентгенологические отличия (утолщение стенок бронхов, участки некроза и утолщение плевры в большей степени характерны для воспалительного процесса) [2]. Однако данные признаки имеют значение только в своей совокупности, ни одно из отличий в отдельности не позволяет исключить онкологический процесс. Именно поэтому дифференцирование воспалительных изменений и неоплазии может вызывать затруднения.
Несмотря на то что механизмы канцерогенеза до конца не изучены, доказана роль иммунных клеток в патогенезе злокачественных новообразований. При злокачественной трансформации иммунных клеток нарушается контроль иммуноредукции рака и других аспектов взаимодействия опухолевых и иммунных клеток. Одним из видов такой трансформации является множественная миелома (ММ). В ряде случаев развитию ММ предшествует длительная персистенция моноклональной гаммапатии, которая в дальнейшем проходит злокачественную трансформацию. Однако нельзя исключить вторичный характер гаммапатии, что отмечается при некоторых состояниях (аутоиммунные заболевания, хронические инфекции).
Представленный нами клинический случай является примером сочетания моноклональной гаммапатии и немелкоклеточного рака легкого, диагностированного у молодой пациентки, демонстрирует важность дифференциальной диагностики при выявлении воспалительных изменений в легких, необходимость онконастороженности при отсутствии положительного эффекта на стандартную терапию. Описывает этапы диагностического поиска и процесс постановки верного диагноза. Оценивает наличие возможных общих этапов патогенеза ММ и рака легкого.
Клинический случай
Материалом для исследования являлась медицинская документация пациентки Ж., включающая стационарные карты из отделения пульмонологии УКБ №1 ПМГМУ им. И.М. Сеченова, ОХТО НМИЦ ФПИ. Авторами были проанализированы данные медицинской документации, произведен подбор и оформление результатов лучевых методов исследования. Поиск дополнительных источников литературы производился в базе данных PubMed.
В отделение пульмонологии поступила женщина 50 лет с жалобами на малопродуктивный приступообразный кашель, эпизоды затрудненного свистящего дыхания, одышку при небольшой физической нагрузке (ходьба в пределах квартиры).
Из анамнеза известно, что пациентка имеет длительный стаж курения (более 33 лет), индекс курильщика 35 пачка/лет. С 2019 г. беспокоит подкашливание в дневные часы. В сентябре 2020 г. перенесла COVID-19, на фоне которого отмечала значительное усиление кашля (для исключения поражения паренхимы легких было проведено КТ органов грудной клетки, по данным которого патологических изменений выявлено не было). В 2021 г. была диагностирована (со слов) левосторонняя пневмония с усилением кашля, по поводу которой проводилась антибактериальная терапия (препараты указать затруднилась), также ингаляционно принимала беродуал с умеренным положительным эффектом. Последние два года отмечает эпизоды повышения температуры тела до 37,1 °С, сопровождающиеся чувством жара. С сентября 2021 г. отметила появление одышки при умеренной физической нагрузке. В начале 2022 г. с жалобами на кашель и одышку обратилась за медицинской помощью по месту жительства. Было проведено КТ органов грудной клетки, где определялось ограниченное затемнение верхней доли левого легкого. Данное состояние было расценено как осумкованный плеврит, проводилась антибактериальная терапия с незначительным положительным эффектом. Постепенное ухудшение состояния началось с весны 2022 г., когда появились эпизоды свистящего дыхания. Консультирована пульмонологом по месту жительства, диагностирована ХОБЛ. С июля 2022 г. прекратила курение. В конце августа кашель усилился, начал носить приступообразный характер, беспокоить в ночные часы, стала нарастать одышка, снизилась толерантность к физической нагрузке. По рекомендации лечащего врача принимала амоксициллин + клавулановую кислоту (в течение 7 дней), ацетилцистеин, тиотропия бромид (прекратила ингаляции после 2 мес. применения ввиду усиления кашля) без значимого эффекта. В ноябре 2022 г. обратилась на консультацию к пульмонологу УКБ №1. На амбулаторном этапе в рамках исключения активного туберкулезного процесса в легких пациентка была консультирована фтизиатром. Был выполнен диаскин-тест, получен отрицательный результат. Данных за активный туберкулез обнаружено не было. Стоит отметить, что анамнестически и при поступлении специфических жалоб, характерных для ММ, не было (геморрагический, оссалгический синдром, патологические переломы, жалобы на полиурию и полидипсию как возможное проявление гиперкальциемии отсутствовали). Пациентка была госпитализирована в стационар для дальнейшего обследования и лечения.
Данные первичного осмотра в отделении: состояние пациентки средней степени тяжести. Температура тела 36,4 °С. Кожные покровы обычной окраски, чистые. Периферических отеков нет. Периферические лимфоузлы не увеличены. SatO2 – 99% при дыхании атмосферным воздухом. ЧДД – 18 в минуту. Над легкими выслушивается везикулярное дыхание с жестким оттенком, резко ослабленное над областью левого легкого. Тоны сердца ритмичные с ЧСС 102 уд/мин. АД 160/100 мм рт. ст. Живот при пальпации мягкий, безболезненный во всех отделах. Физиологические отправления в норме.
При поступлении пациентке проводилось исследование ФВД, при котором было выявлено нарушение вентиляции тяжелой степени, ОФВ1 = 44% от должн. ОФВ1/ФЖЕЛ = 53%, генерализованная обструкция, уровень ФЖЕЛ составлял 78% от должн. Положительная реакция на сальбутамол 400 мкг. В клиническом анализе крови обращала на себя внимание относительная эозинофилия (6,3%), абсолютное количество эозинофилов – 0,38*10^9/л. Учитывая жалобы, длительный анамнез курения и данные обследования, был диагностирован overlap-синдром – бронхиальная астма персистирующая, средней степени тяжести, смешанная, неконтролируемая, хроническая обструктивная болезнь легких, GOLD 2В, бронхитический фенотип, обострение.
Была начата терапия бронхообструктивного синдрома в рамках данных заболеваний – будесонид + формотерол, ингаляции ипратропия бромида посредством небулайзера, муколитическая терапия (амброксол), терапия артериальной гипертензии – метопролол.
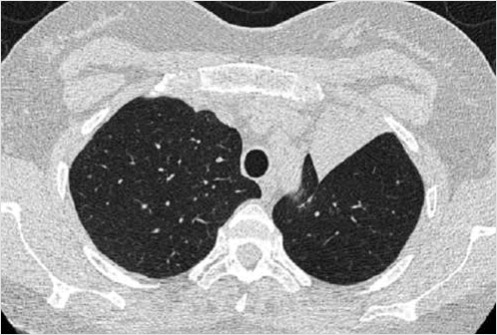
Пациентка представила МСКТ ОГК от 21.10.2022. При просмотре томограмм изменения были расценены как КТ-признаки ателектаза верхней доли левого легкого (рис. 1). Костно-деструктивные изменения по данным КТ ОГК выявлены не были.
Рисунок 1. Фрагмент КТ – ателектаз верхней доли левого легкого
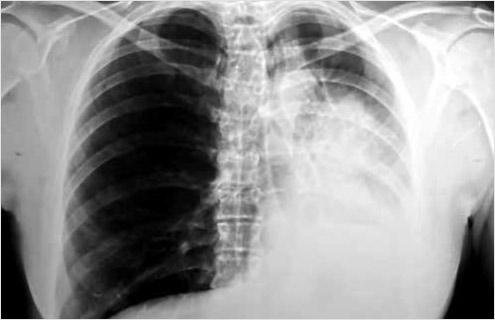
В стационаре выполнялась рентгенография ОГК (24.11.2022), где также определялся ателектаз левого легкого, смещение средостения влево (рис. 2).
Рисунок 2. Рентгенография пациентки до проведение бронхоскопии
Пациентка была консультирована торакальным хирургом, на основании представленного КТ-исследования было сделано предположение о наличии у больной новообразования дистального отдела левого главного бронха, верхнедолевого бронха. Для уточнения диагноза была выполнена бронхоскопия.
В ходе эндоскопического исследования была выявлена округлая плотноэластическая опухоль с гладкой гиперемированной поверхностью и участком поверхностного некроза белого цвета, почти полностью обтурирующая просвет левого главного бронха на протяжении примерно 2,5 см; взята биопсия. Макроскопически препарат был представлен тканью серовато-коричневого цвета. При микроскопическом исследовании было установлено, что биопсийный материал представляет собой слизистую бронха, частично выстланную многослойным плоским эпителием, под которым отмечается инвазивный рост карциномы из крупных клеток, морфологически более соответствующим плоскоклеточной карциноме без ороговения. Для верификации диагноза было проведено иммуногистохимическое исследование, по результатам которого в клетках опухоли была выявлена интенсивная ядерная экспрессия p63 (Leica, Clone7JUL); отсутствие экспрессии TTF1 (Dako, Clone 8 G7 G3/1) C56 (Dako, Clone M7304) – выявленный иммунофенотип соответствовал плоскоклеточной карциноме.
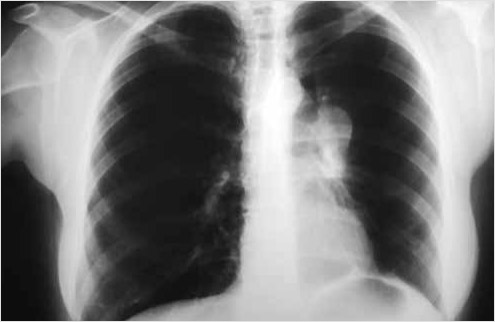
После выполнения бронхоскопии пациентке было повторно проведено рентгенографическое исследование органов грудной клетки (25.11.2022). На обзорном снимке на фоне прозрачного левого легочного поля в прикорневой зоне определяется округлая тень, примыкающая к верхнедолевому бронху, размерами 2,5 х 4 см с четким контуром, ателектаз был устранен (рис. 3).
Рисунок 3. Рентгенография пациентки после проведенной бронхоскопии с реканализацией просвета бронха
При поступлении, по данным лабораторных методов исследования, обращала на себя внимание гипохромная микроцитарная анемия средней степени тяжести (гемоглобин – 84 г/л, цветовой показатель – 0,66; средний объем эритроцитов – 71,6 фл), уровень железа сыворотки составлял 6,52 мкмоль/л; ферритин – 13,3 нг/мл. Отмечалась диссоциация между значительным увеличением СОЭ – 75 мм/ч при умеренном повышении СРБ до 7,3 мг/л. Уровень общего белка был в пределах референсных значений (85 г/л), однако объемная доля альбумина была снижена до 42%. Креатинин крови был в пределах референсных значений – 71 мкмоль/л. Расчетная СКФ по формуле CKD-EPI – 85 мл/мин. Протеинурия, по данным общего анализа мочи, не определялась. По результатам проведенного электрофореза белка была выявлена моноклональная секреция – 28% (23,8 г/л), повышение гамма-глобулинов до 31,7%, абсолютное количество иммуноглобулина G (IgG) увеличено до 23,14 г/л. Была диагностирована анемия смешанного генеза – железодефицитная + анемия хронических заболеваний. Позже пациентка сообщила, что признаки гипохромной микроцитарной анемии (гемоглобин – 93 г/л), ускорение СОЭ – 68 мм/ч были выявлены еще в сентябре 2021 г., в связи с чем проводилась терапия пероральными препаратами железа в течение 1 мес. без положительного эффекта. Выявленные изменения (анемия, ускорение СОЭ, парапротеинемия) могли рассматриваться как проявления паранеопластического синдрома на фоне карциномы легкого, в то же время нельзя было исключать наличие парапротеинемического гемобластоза.
В связи с этим для проведения дифференциально-диагностического поиска пациентка был направлена на консультацию гематолога, была выполнена стернальная пункция с последующим исследованием полученного аспирата. В миелограмме определялось повышение уровня плазматических клеток до 8,5%. Для верификации диагноза была выполнена трепанобиопсия (02.12.2022), при которой выявлена умеренно выраженная межтрабекулярная и с тенденцией к паратрабекулярному расположению очагово-интерстициальная инфильтрация из зрелых плазматических клеток, отмечались двуядерные формы, отдельные клетки с морфологией проплазмоцитов. С учетом клинических данных у пациентки была диагностирована моноклональная гаммапатия неясного значения.
По поводу впервые выявленного злокачественного новообразования (центральный рак верхней доли левого легкого с переходом на левый главный бронх (cT3N0Mх)) пациентка была направлена на онкологический консилиум, где было принято решение о выполнении расширенной пневмонэктомии слева. По заключению патологоанатомического исследования операционного материала был скорректирован дооперационный диагноз. При гистологическом исследовании определялся опухолевый узел размером 4,1 х 3 х 3,5 см. В парааортальных лимфатических узлах – метастазы рака с тотальным замещением ткани лимфатических узлов, их врастанием в капсулу и распространением за ее пределы. Морфологическая картина соответствовала плоскоклеточной карциноме легкого, high-grade (G3), V(1), L(0), Pn (0), R0, pT2bN2a1Mx.
С заключительным диагнозом «Основное заболевание: центральный рак верхней доли левого легкого с переходом на левый главный бронх рТ2bN2aM0 IIIA-стадия, клиническая группа III. Состояние после расширенной пневмонэктомии слева от 26.01.2023. Сопутствующие заболевания: хроническая обструктивная болезнь легких, GOLD 2В, бронхитический фенотип, вне обострения. Бронхиальная астма, персистирующая, средней степени тяжести, смешанная, неконтролируемая. Гипертоническая болезнь 1-й степени, 1-й стадии, риск ССО 1. Моноклональная гаммапатия неясного значения. Гипохромная микроцитарная анемия средней степени тяжести» пациентка была выписана на амбулаторный этап для подбора наиболее эффективного метода противоопухолевой терапии после проведенного оперативного лечения.
Обсуждение
Данный случай представляет собой яркий пример междисциплинарного взаимодействия и подчеркивает важное значение дифференциальной диагностики в повседневной деятельности практикующего врача.
Одышка – одна из самых распространенных жалоб, предъявляемых пациентами специалисту первичного звена. Важным моментом в данном случае является определение генеза одышки. Учитывая наличие малопродуктивного кашля и длительный анамнез курения, причиной одышки, вероятнее всего, являлась патология органов дыхания. Наиболее доступным визуализирующим диагностическим методом на амбулаторном этапе является обзорная рентгенография органов грудной клетки. У данной пациентки на рентгенограмме определялось затемнение левого легкого. Возможной причиной подобных рентгенологических изменений могла быть пневмония (относительно частая патология в амбулаторной практике). Кроме того, анамнестически известно, что данные рентгенологические изменения неоднократно трактовались как пневмония, по поводу которой она принимала антибактериальные препараты (амоксициллин + клавулановая кислота), муколитики, однако симптомы сохранялись, что заставляло расширять круг дифференциальной диагностики.
Пациентку длительно безуспешно лечили от пневмонии бактериальной этиологии. Однако термин «пневмония» включает также ряд интерстициальных поражений паренхимы легких. Несомненно, они встречаются в повседневной практике врачей (особенно амбулаторного звена) значительно реже, чем пневмонии, вызванные инфекционными агентами. Однако при несвоевременной диагностике прогноз для жизни у таких пациентов весьма неблагоприятен. Одышка и непродуктивный кашель – основные симптомы интерстициального поражения легочной ткани. Именно это, как правило, вынуждает пациента обратиться за медицинской помощью. Одним из паттернов интерстициальных болезней легких является десквамативная интерстициальная пневмония (ДИП). Пациентка входит в группу риска по развитию данной патологии, учитывая 33-летний стаж курения и неспецифическую симптоматику, возраст манифестации заболевания также характерен для ДИП [3]. Однако, по данным визуализации, признаков интерстициального поражения легких выявлено не было – поражение носило односторонний характер, кроме того, сопровождалось явлениями ателектаза, а не картиной «матового стекла», наблюдающейся при ДИП. В данном случае результаты физикального обследования также не выявляли признаков интерстициального поражения легких, характерные «целлофановые хрипы» у пациентки отсутствовали.
Вместе с тем неоднозначная рентгенологическая картина не позволяла исключить другое интерстициальное поражение легких – криптогенную организующую пневмонию (КОП). Эта патология наиболее часто встречается в возрасте 50–60 лет. В дебюте заболевание имеет определенное сходство с внебольничной пневмонией – эпизоды лихорадки, общая слабость, одышка и непродуктивный кашель – неспецифические симптомы, характерные для обоих заболеваний. Однако для КОП характерны рестриктивные изменения по данным исследования ФВД. Кроме того, в рамках данного интерстициального поражения отмечается значительное повышение маркеров острой фазы воспалительного синдрома, что не было выявлено у пациентки. Хотя рентгенологически КОП может имитировать картину бронхиолоальвеолярного рака, в большинстве случаев она протекает с типичной картиной консолидации паренхимы легких по типу «матового стекла», сопровождающейся уплотнением стенок бронхов и формированием бронхоэктазов, также характерно образование множественных периферических инфильтратов [4]. Кроме того, КОП чаще развивается у некурящих людей.
Длительный анамнез курения и одышка – классическое сочетание для пациентов с хронической обструктивной болезнью легких (ХОБЛ). Действительно, описанная пациентка страдала данным заболеванием. Однако ее клинические симптомы имели смешанный генез. В развитие бронхообструктивного синдрома важный вклад вносила бронхиальная астма. В течение длительного времени пациентка не получала базисной терапии ингаляционными глюкокортикостероидами, а эпизодически лечилась только холинолитиками (тиотропия бромид), в связи с этим затруднение дыхания нарастало и стало ограничивать повседневную активность. Правильная терапия оverlap-синдрома (бронхиальная астма + ХОБЛ) способна значительно повысить качество жизни пациентки и предотвратить развитие осложнений.
Важным симптомом также являлось эпизодическое повышение температуры тела до субфебрильных цифр, сохраняющееся в течение продолжительного времени. КТ-картина в сочетании с длительным субфебрилитетом не позволяла исключить формирование осумкованного плеврита верхней доли правого легкого.
Осумкованный плеврит мог явиться исходом пневмонии верхнедолевой локализации. Но по данным рентгенографии ОГК определялось смещение органов средостения в сторону поражения – данные изменения не характерны для осумкованного плеврита. Верхнедолевая локализация поражения настораживала относительно туберкулезной этиологии плеврита. Однако при обследовании данных за активный туберкулез получено не было.
Стоит отметить, что пациентка имела длительный стаж курения. Общеизвестен факт повышенного риска развития рака легких у курящих людей относительно некурящих в связи с нарушением защитных механизмов бронхолегочной системы, канцерогенным действием компонентов табачного дыма [1, 3]. При обследовании курящих пациентов с высоким индексом курильщика особенно важно проявлять онконастороженность и исключать неоплазию. Именно поэтому (учитывая косвенные признаки наличия ателектаза как причины затемнения легочного поля, признаки смещения средостения в сторону поражения, признаки анемии по данным лабораторных исследований и длительный субфебрилитет) было принято решение о проведении бронхоскопии, во время которой была визуализирована опухоль бронха и взята биопсия для верификации диагноза.
Таким образом, описанный случай являет собой пример мультиморбидного пациента в практике врача терапевтического профиля. Сочетание ХОБЛ и бронхиальной астмы вносило важный вклад в клиническую картину. Однако в процессе обследования было установлено, что основной причиной симптомов являлся центральный рак легкого.
Интересной особенностью случая является наличие у пациентки моноклональной гаммапатии, выявленной во время обследования. Несмотря на молодой возраст больной, нельзя было исключать наличие синхронного рака – множественной миеломы и рака легкого. Гаммапатия неясного значения в ряде случаев является предшественницей ММ.
Множественная миелома – злокачественное новообразование, морфологический субстрат которого составляют В-клетки (плазмоциты). По данным мировой статистики, доля ММ среди всех злокачественных опухолей составляет 0,9% [5]. Среди всех онкогематологических заболеваний на нее приходится 13% случаев [5]. Уровень заболеваемости ММ колеблется от 0,54 до 5,3 на 100 000 человек в зависимости от географического региона. Средний показатель заболеваемости равен 2,1 на 100 000 человек [6].
Большое количество мутаций, отмечаемое при ММ, способствует развитию злокачественных новообразований других локализаций и другого морфологического фенотипа. Так, по данным финских исследователей, доля вторичной онкологической патологии при ММ составляет 16,8% (в год установления диагноза множественной миеломы), увеличиваясь до 27,5% через два года после установления диагноза [7]. Особый интерес представляют случаи синхронного развития ММ и солидных опухолей. J. Hasskarl et al. описали 59 пациентов, страдающих ММ и одновременно имеющих другие злокачественные новообразования (что составило 10% от объема выборки). При этом чаще первичным являлись неоплазии различных локализаций, в то время как ММ диагностировалась позднее [8].
По литературным данным, на сегодняшний день всего в мире описаны 8 случаев сочетания ММ и рака легкого [9–15]. Соотношение женщин к мужчинам – 3:5. В 7 случаях из 8 возраст пациентов менее 70 лет (из них 2 случая миеломы у 52-летних мужчин, 1 – у 51-летнего). Гистологическая структура опухоли в 7 случаях из 8 была представлена немелкоклеточным раком легкого (3 плоскоклеточныt карциномы, 4 аденокарциномы).
В патогенетическом механизме развития ММ и рака легкого есть определенное сходство. На сегодняшний день известно, что плазматические клетки при миеломе интенсивно экспрессируют CD38. Посредством влияния на метаболизм кальция CD38 влияет на процессы апоптоза клеток, его гиперэкспрессия отмечается на опухолевых плазматических клетках, что делает их неуязвимыми для иммунной системы организма и способствует бесконтрольной пролиферации. В работе X. Bu еt al. было доказано, что экспрессия CD38 повышена не только при злокачественных заболеваниях кроветворной системы, но и при развитии немелкоклеточного рака легких; блокирование данного белка способно остановить прогрессирование опухоли легкого [16]. M.F. Kaiser et al. описали пациента с нерезектабельным раком легкого (T3 N0 M1b) и множественной миеломой, на примере которого был продемонстрирован положительный клинический эффект от терапии пембролизумабом и даратумумабом в сочетании с карфилзомибом и дексаметазоном [17]. Пембролизумаб – моноклональное антитело, ингибитор PD-1, повышенная экспрессия которого наблюдается при немелкоклеточном раке легкого. Было установлено, что при применении антител к PD-1 в ряде случаев развивается резистентность опухолевых клеток к терапии посредством повышенной экспреcсии CD38. Даратумумаб входит в схему терапии ММ, данный препарат блокирует CD38, индуцирует лизис клеток опухоли. Учитывая имеющиеся данные о повышенной экспрессии CD38 на клетках рака легкого, обнаруженную in vitro, хороший эффект от терапии был связан с воздействием даратумумаба не только на клетки миеломы, но и на немелкоклеточный рак легкого [18].
Также представляется очень интересным описание и генетический анализ, проведенный у пациентов с сочетанным развитием множественной миеломы и рака легкого одновременно, выявленный другими авторами [9]. Пациентам с одновременно протекающими заболеваниями множественной миеломы и раком легкого после проведения биоинформационного анализа удалось выявить общие гены и общие пути развития этих двух онкологических заболеваний за счет экспрессии в клетках обеих опухолей гена – концентратора митохондриальной транс-2-еноил-КоА-редуктазы (MECR).
Заключение
Высокая доступность современных лучевых методов исследования не всегда позволяет выявить неоплазии на ранних стадиях. Тщательный сбор анамнеза и комплексная оценка лабораторных, инструментальных данных в сочетании с клиническими симптомами – залог успешной диагностики и своевременного лечения. Особого внимания требуют мультиморбидные пациенты, т.к . определение генеза патологических изменений у таких больных затруднено ввиду многофакторности. В рамках диагностики не стоит ограничиваться стандартными, наиболее частыми патологиями, ведь нередко встречаются весьма необычные случаи. Моноклональная гаммапатия, выявленная у больной, позволяла предположить относительно редкий случай синхронного рака у молодой пациентки. В связи с общностью патогенетических звеньев ММ и рака легкого, приводящих к извращенной работе иммунной системы (гиперэкспрессия СD38), требуется динамический контроль за состоянием больной для своевременной диагностики возможной трансформации. Новые данные об особенностях этиопатогенеза ММ и рака легких открывают простор для разработок новых терапевтических мишеней и повышения эффективности терапии. Учитывая эти особенности, крайне важно проводить широкий диагностический поиск (в т. ч. синхронных злокачественных образований), принимая во внимание даже небольшие патологические изменения.
Список литературы / References
Развернуть
- Shepshelovich D, Barda N, Goldvaser H, Dagan N, Zer A, Diker-Cohen T et al. Incidence of lung cancer following pneumonia in smokers: a population-based study. QJM. 2022;115(5):287-291. https://doi.org/10.1093/qjmed/hcab030.
- Li Q, Fan X, Huo JW, Luo TY, Huang XT, Gong JW. Differential diagnosis of localized pneumonic-type lung adenocarcinoma and pulmonary inflammatory lesion. Insights Imaging. 2022;13(1):49. https://doi.org/10.1186/s13244-022-01200-z.
- Титова ОН, Суховская ОА, Куликов ВД. Курение табака и интерстициальные заболевания легких (обзор литературы). Практическая пульмонология. 2019;(1):32-37. Режим доступа: https://znanium.ru/read?id=352478.
- Юдин АЛ, Абович ЮА, Юматова ЕА, Афанасьева НИ, Афукова ОА, Беленькая ОИ и др. Аспекты компьютерной томографии в диагностике организующей пневмонии. Российский электронный журнал лучевой диагностики. 2019;9(3):176-189. https://doi.org/10.21569/2222-7415-2019-9-3-176-189.
- Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71(3):209-249. https://doi.org/10.3322/caac.21660.
- Менделеева ЛП, Вотякова ОМ, Соловьев МВ, Рехтина ИГ, Семочкин СВ, Османов ЕА и др. Множественная миелома: клинические рекомендации. М.; 2022. 217 с. Режим доступа: https://oncology-association.ru/wp-content/uploads/2022/04/mnozhestvennaya-mieloma.pdf?ysclid=lnwzoc....
- Toppila I, Kysenius K, Miettinen T, Lassenius MI, Lievonen J, Anttila P. Comorbidity characteristics of multiple myeloma patients diagnosed in Finland 2005-2016. Ann Hematol. 2022;101(11):2485-2495. https://doi.org/10.1007/s00277-022-04959-9.
- Hasskarl J, Ihorst G, De Pasquale D, Schröttner P, Zerweck A, Wäsch R, Engelhardt M. Association of multiple myeloma with different neoplasms: systematic analysis in consecutive patients with myeloma. Leuk Lymphoma. 2011;52(2):247-259. https://doi.org/10.3109/10428194.2010.529207.
- Xiao PP, Luo BQ, Fan W, Chen XY, Dong ZG, Huang JM et al. Simultaneous Presentation of Multiple Myeloma and Lung Cancer: Case Report and Gene Bioinformatics Analysis. Front Oncol. 2022;12:859735. https://doi.org/10.3389/fonc.2022.859735.
- Khade P, Devarakonda S. Coexisting multiple myeloma, lymphoma, and non-small cell lung cancer: a case report and review of the literature. Int Med Case Rep J. 2017;10:373-376. https://doi.org/10.2147/IMCRJ.S147266.
- Goto T, Maeshima A, Oyamada Y, Kato R. Definitive diagnosis of multiple myeloma from rib specimens resected at thoracotomy in a patient with lung cancer. Interact Cardiovasc Thorac Surg. 2010;10(6):1051-1053. https://doi.org/10.1510/icvts.2009.230854.
- Ji SH, Park JO, Lee J, Oh MJ, Lim DH, Park BB et al. Three cases of synchronous solid tumor and multiple myeloma. Cancer Res Treat. 2004;36(5):338-340. https://doi.org/10.4143/crt.2004.36.5.338.
- Dong HH, Li J, Kang L, Wei Q, Li Y. Simultaneous multiple myeloma and non-small cell lung carcinoma: A case report and review of the literature. Oncol Lett. 2022;23(6):195. https://doi.org/10.3892/ol.2022.13315.
- Agarwal R, Gupta R, Bhaskar A, Sharma A, Thulkar S, Kumar L. Synchronous presentation of multiple myeloma and lung cancer. J Clin Oncol. 2008;26(35):5814-5816. https://doi.org/10.1200/JCO.2008.19.6287.
- Jawiarczyk-Przybyłowska A, Wojtczak B, Whitworth J, Sutkowski K, Bidlingmaier M, Korbonits M, Bolanowski M. Acromegaly associated with GIST, non-small cell lung carcinoma, clear cell renal carcinoma, multiple myeloma, medulla oblongata tumour, adrenal adenoma, and follicular thyroid nodules. Endokrynol Pol. 2019;70(2):213-217. https://doi.org/10.5603/EP.a2019.0005.
- Bu X, Kato J, Hong JA, Merino MJ, Schrump DS, Lund FE, Moss J. CD38 knockout suppresses tumorigenesis in mice and clonogenic growth of human lung cancer cells. Carcinogenesis. 2018;39(2):242-251. https://doi.org/10.1093/carcin/bgx137.
- Kaiser MF, Croft J, Shah P, Yousaf N, Popat S. Durable response of multiple myeloma and non-small cell lung cancer with simultaneous, biologically targeted treatment. Br J Haematol. 2020;189(1):e1-e3. https://doi.org/10.1111/bjh.16393.
- Chen L, Diao L, Yang Y, Yi X, Rodriguez BL, Li Y et al. CD38-Mediated Immunosuppression as a Mechanism of Tumor Cell Escape from PD-1/ PD-L1 Blockade. Cancer Discov. 2018;8(9):1156-1175. https://doi.org/10.1158/2159-8290.CD-17-1033.








