
Журнал "Медицинский совет" №23/2024
DOI: 10.21518/ms2024-532
А.Р. Мелтонян1, ORCID: 0000-0002-5149-4667
М.Ю. Лаевская1, ORCID: 0000-0003-0837-8385
Ю.Н. Савченков2, ORCID: 0000-0002-8258-522X
А.Ю. Бабенко1, ORCID: 0000-0002-0559-697X
1 Национальный медицинский исследовательский центр имени В.А. Алмазова; 197341, Россия, Санкт-Петербург, ул. Аккуратова, д. 2
2 Федеральный медицинский биофизический центр имени А.И. Бурназяна Федерального медико-биологического агентства России; 123098, Москва, ул. Маршала Новикова, д. 23
Введение. Метаболически ассоциированная жировая болезнь печени (МАЖБП) – широко распространенное заболевание, имеющее патогенетическую взаимосвязь с сахарным диабетом 2-го типа (СД2).
Цель. Определить значения белка TXNIP у пациентов с МАЖБП и СД2, находящихся на монотерапии метформином, сопоставить полученные значения с результатами МРТ печени у данной группы пациентов, а также определить изменения уровней тиоредоксинвзаимодействующего белка (TXNIP) через 6 мес. от начала терапии агонистами рецептора глюкагоноподобного пептида 1 (арГПП-1) и ингибиторами натрий-глюкозного котранспортера 2-го типа (иНГЛТ-2).
Материалы и методы. В исследование были включены 49 пациентов с СД2 и МАЖБП в возрасте 55 ± 8 лет (34 женщины и 15 мужчин), наблюдавшихся в амбулаторно-поликлиническом отделении НМИЦ им. В.А. Алмазова (Санкт-Петербург) с января 2023 г. по март 2024 г., которые имели ИМТ 25–40 кг/м2, а также уровень гликированного гемоглобина не более 9,5%.
Результаты. Исследование показало, что уровень белка TXNIP в сыворотке коррелировал с результатами оценки выраженности МАЖБП по данным МРТ печени, а также значимо снижался на фоне применения сахароснижающей терапии арГПП-1 и иНГЛТ-2.
Выводы. Полученные нами данные корреляции свидетельствуют о возможном применении белка TXNIP в качестве перспективного диагностического маркера у пациентов с МАЖБП и СД2 как на этапе диагностики, так и при анализе результатов проводимой терапии.
Для цитирования: Мелтонян АР, Лаевская МЮ, Савченков ЮН, Бабенко АЮ. Тиоредоксинвзаимодействующий белок TXNIP как перспективный диагностический маркер метаболически ассоциированной жировой болезни печени у пациентов с сахарным диабетом 2-го типа. Медицинский совет. 2024;18(23):137–143. https://doi.org/10.21518/ms2024-532.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Согласие пациентов на публикацию: пациенты подписали информированное согласие на публикацию своих данных.
Thioredoxin-interacting protein TXNIP as a promising diagnostic marker for metabolic-associated fatty liver disease in patients with type 2 diabetes
Asia R. Meltonian1, ORCID: 0000-0002-5149-4667
Maria Yu. Laevskaya1, ORCID: 0000-0003-0837-8385
Yury N. Savchenkov2, ORCID: 0000-0002-8258-522X
Alina Yu. Babenko1, ORCID: 0000-0002-0559-697X
1 Almazov National Medical Research Centre; 2, Akkuratov St., St Petersburg, 197341, Russia
2 Burnasyan Federal Medical Research Biophysical Center of Federal Medical Biological Agency; 23, Marshal Novikov St., Moscow, 123098, Russia
Introduction. Metabolic-associated fatty liver disease (MAFLD) is a common disease that has a pathogenesis-based relationship with type 2 diabetes (T2D).
Aim. To determine the levels of TXNIP protein in patients with MAFLD and T2D who were on metformin monotherapy, to compare these levels with the findings of MRI of the liver, and to assess changes in TXNIP protein levels six months after starting treatment with glucagon-like peptide-1 receptor agonists (GLP-1RA) and sodium-glucose cotransporter-2 (SGLT-2) inhibitors.
Materials and methods. The study included 49 patients (34 female and 15 male) with T2D and MAFLD, aged 55 ± 8 years, who were followed up at the outpatient clinic of Almazov National Medical Research Centre (St. Petersburg) from January 2023 to March 2024. The eligibility criteria included BMI values of 25–40 kg/m² and a glycated hemoglobin level not exceeding 9.5%.
Results. The study showed that serum TXNIP protein levels were positively correlated with the severity of MAFLD assessed based on MRI findings. Furthermore, TXNIP levels significantly decreased as a result of therapy with GLP-1RAs and SGLT-2 inhibitors.
Conclusion. These correlation data suggest that the TXNIP level could be used as a promising diagnostic marker in patients with MAFLD and T2D, both at the stage of diagnostic evaluation and when considering the outcomes of ongoing therapy.
For citation: Meltonian AR, Laevskaya MYu, Savchenkov YuN, Babenko AYu. Thioredoxin-interacting protein TXNIP as a promising diagnostic marker for metabolic-associated fatty liver disease in patients with type 2 diabetes. Meditsinskiy Sovet. 2024;18(23):137–143. (In Russ.) https://doi.org/10.21518/ms2024-532.
Conflict of interest: the authors declare no conflict of interest.
Basic patient privacy consent: patients signed informed consent regarding publishing their data.
Введение
Метаболически ассоциированную жировую болезнь печени (МАЖБП) диагностируют у пациентов с сахарным диабетом 2-го типа (СД2) во взрослой популяции в среднем в 25% случаев по всему миру [1, 2].
Патогенез развития и прогрессирования МАЖБП у пациентов с СД2 является многофакторным, в его основе лежат развитие инсулинорезистентности, липотоксичности, активация врожденного иммунитета и воспаления через систему цитокинов и адипокинов, а также продуктов свободно-радикальных реакций [3, 4]. МАЖБП и СД2 в настоящее время рассматриваются как взаимоотягощающие заболевания, диагностика и лечение которых должны быть однонаправленными [5]. В этой связи актуальным является поиск новых неинвазивных диагностических и прогностических маркеров, которые позволят оценивать течение указанных коморбидных заболеваний в динамике [6]. Рядом исследователей была показана роль белка TXNIP в развитии воспаления и окислительного стресса, в т. ч. при заболеваниях печени. Так, Yu Zhang et al. в 2021 г. изучили роль TXNIP как фактора формирования гепатоцеллюлярного рака и показали, что повышенные уровни белка TXNIP ингибируют белок CHOP (CAAT/ enhancer-binding protein homologous protein) – основной транскрипционный фактор, задействованный в регуляции стресс-индуцированного апоптоза, воспаления и фиброза при НАСГ [7–9]. Формирующееся хроническое воспаление, ассоциированное с ожирением, поддерживается за счет NOD-подобного рецептора (NLRP3) – инфламмасомы, активатором которого также является TXNIP [10, 11]. Другие исследователи установили, что концентрация белка TXNIP была повышена как в экспериментах на лабораторных животных, так и при изучении биоптатов печени у людей, что позволяет рассматривать его как новый потенциальный маркер МАЖБП, в т. ч. на стадии НАСГ у пациентов с СД2 [12].
Кроме того, интерес представляет изучение динамики значений TXNIP у пациентов с МАЖБП в процессе трансформации стеатоза в стеатогепатит и возможность использования данного белка как предиктивного маркера.
Современные классы антидиабетических препаратов (АДП), такие как ингибиторы натрий-глюкозного котранспортера 2-го типа (иНГЛТ-2) и агонисты рецепторов глюкагоноподобного пептида 1-го типа (арГПП-1), обладают выраженными противовоспалительными свойствами, что позволяет ожидать положительных эффектов на течение МАЖБП. Для группы арГПП-1 характерен и значительный вес-снижающий потенциал, а для иНГЛТ-2 – антифиброзный, что позволяет рассматривать возможность персонифицированного назначения препаратов этих классов АДП как перспективную опцию для лечения пациентов с этими коморбидными заболеваниями.
Целью настоящего исследования было определение значений белка TXNIP у пациентов с МАЖБП и СД2, находящихся на монотерапии метформином, сопоставление полученных значений с результатами МРТ печени у данной группы пациентов, а также определение изменений уровней белка TXNIP через 6 мес. от начала применения арГПП-1 и иНГЛТ-2.
Материалы и методы
В когортное проспективное исследование были включены 49 пациентов с СД2 и МАЖБП в возрасте 55 ± 8 лет (34 женщины и 15 мужчин), наблюдающихся в амбулаторно-поликлиническом отделении НМИЦ им. В.А. Алмазова с января 2023 г. по март 2024 г. Исследование было одобрено этическим комитетом НМИЦ им. В.А. Алмазова (выписка №02011-22 от 12.12.2022 г.). Все включенные пациенты подписали добровольное информированное согласие на участие в исследовании.
К критериям включения относились следующие данные:
- Мужчины и женщины в возрасте от 18 до 65 лет с установленным диагнозом СД2 и ИМТ 25–40 кг/м2, имеющие лабораторные и инструментальные признаки МАЖБП: пациенты со стеатозом или стеатогепатитом по данным УЗИ/эластографии, у которых уровни трансаминаз (АЛТ, АСТ) были повышены не более чем в 3 раза (верхние границы нормы: 0–32 ЕД/л для АЛТ, 0–31 Ед/л для АСТ).
- Уровень гликированного гемоглобина (НbA1c) выше индивидуальной цели, но не выше 9,5%.
- Текущая монотерапия метформином в максимально переносимой дозе в течение не менее 3 мес.
- Стабильные дозы антигипертензивных, гиполипидемических препаратов в течение 3 мес. до включения.
К критериям исключения относились:
- Наличие тяжелых заболеваний сердечно-сосудистой системы (ХСН III–IV ФК по NYHA, неконтролируемая артериальная гипертензия, перенесенный инфаркт миокарда), ОНМК в течение последних 6 мес.
- Заболевания печени другой этиологии и печеночной недостаточности.
- Среднее потребление алкоголя для мужчин > 210 г/нед, для женщин > 140 г/нед в последние 5 лет.
- Психические заболевания.
- Острые/хронические инфекционные заболевания.
- Системная терапия глюкокортикостероидами.
- Бариатрические операции в анамнезе.
- Лечение препаратами для снижения массы тела или любыми другими препаратами, которые могли привести к изменению массы тела за последние 3 мес.
- Онкологические заболевания в анамнезе в отсутствие стойкой ремиссии в течение 2 лет.
- Системные аутоиммунные заболевания; терапия иммуносупрессантами, иммуномодуляторами, биологическими препаратами и т. п.
- Беременность, лактация.
- Планирующиеся хирургические вмешательства в период исследования.
- Синдром множественной эндокринной неоплазии (МЭН 1-го или 2-го типа).
- Заболевания щитовидной железы с уровнями гормонов выше или ниже нормы.
- Наличие в анамнезе острого и хронического панкреатита.
- Наличие противопоказаний к терапии арГПП-1 и иНГЛТ-2.
- Фиброз печени F4-F5, цирроз печени и гепатоцеллюлярная карцинома.
В рамках исследования были учтены данные анамнеза и антропометрии. Были проведены клинические, биохимические (гликированный гемоглобин методом аффинной хроматографии, Bio-Rad, США; глюкоза крови натощак, уровень трансаминазы, гамма-глутамилтранспептидаза, липидограмма, билирубин, креатинин, мочевина, мочевая кислота, общий белок, альбумин, ферритин, С-реактивный белок биохимическим методом, Rosche, Франция), гормональные исследования (грелин, ГПП-1, инсулин с расчетом индекса HOMA-IR, С-пептид, лептин, адипонектин методом ИФА в сыворотке крови, Abbot, RayBioTech, DBC, США). Проведена оценка маркера TXNIP методом ИФА в сыворотке крови (Cloud-Clone Сorp., США). Для лабораторной диагностики использовались анализаторы Elycsys 2010, Cobas Integra 400 plus и Architect I 1000SR. Из инструментальных методов исследования всем пациентам была проведена МРТ печени с внутривенным болюсным контрастированием с помощью МР-томографа с индукцией магнитного поля 3 Тесла (Magnetom Siemens VIDA 3T, Германия) с целью оценки стадии МАЖБП. Оценка степени МАЖБП, по данным МРТ, проводилась в зависимости от содержания в печени жировой ткани согласно соответствующим сигнальным характеристикам на МР-изображениях в соответствии со следующей классификацией: 0%, 5–33%, 33–66%, >66% (табл. 1).
Таблица 1. Стратификация пациентов на стадии метаболически ассоциированной жировой болезни печени на основании данных МРТ
| Стадия МАЖБП | Содержание жировой ткани в паренхиме печени по данным МРТ |
|---|---|
| I | 5–33% |
| II | 33–66% |
| III | >66% |
| НАСГ F0-F1 | МР-признаки перисинусоидального фиброза в отсутствие признаков перипортального фиброза или цирроза |
На основании данных МРТ 49 пациентов были разделены по стадиям МАЖБП: 16 человек (32,7%) со стеатозом 1-й степени, 8 (16,3%) – со стеатозом 2-й степени, 7 (14,3%) – со стеатозом 3-й степени, 18 – (36,7%) с НАСГ непродвинутой стадии, исключающим цирроз печени согласно критериям, представленным в табл. 1. Для пациентов было запланировано два визита: точка 1 – до начала лечения, точка 2 – через 6 мес. от начала терапии. С учетом индивидуальных целей сахароснижающей терапии и преимущественной клинической проблемы пациентам была назначена терапия иНГЛТ-2 (дапаглифлозин, эмпаглифлозин) и арГПП-1 (дулаглутид) в дополнение к исходной монотерапии метформином. Нами был проведен статистический анализ корреляции значений уровня TXNIP с данными МРТ пациентов в точке 1. Группы пациентов были сопоставимы по возрасту, полу, сопутствующей терапии, а также стажу СД2 (p > 0,05) (табл. 2).
Таблица 2. Характеристики пациентов, включенных в исследование
| Исследуемые параметры | Пациенты с СД2, n = 49 | В том числе | р | Референсные или целевые значения | |
|---|---|---|---|---|---|
| арГПП-1 n = 20 |
иНГЛТ-2 n = 29 |
||||
| • Женщины • Мужчины |
34 15 |
14 6 |
19 10 |
- | |
| Возраст, лет | 55 ± 8 | 55 ± 8 | 56 ± 8 | 0,08 | - |
| ИМТ, кг/м2 | 34 ± 7 | 34 ± 4 | 33 ± 8 | 0,09 | <25 |
| ОТ, см | 109 ± 13 | 110 ± 12.5 | 107 ± 15 | 0,1 | <80 (ж.), <94 (м.) |
| Стаж СД2, лет | 3 ± 2 | 3 ± 1 | 3 ± 2 | 0,2 | |
| HOMA-IR | 7 ± 4 | 7,1 ± 3,5 | 6,9 ± 3,3 | 0,2 | <2,7 |
| СРБ, мг/л | 5,2 ± 6,74 | 5,3 ± 5,2 | 5,6 ± 8,3 | 0,2 | 0–5,0 |
| Глюкоза натощак, ммоль/л | 7,6 ± 2,56 | 6,8 ± 3 | 7,7 ± 1,9 | 0,1 | 3,3–6,1 |
| HbA1c, % | 7,1 ± 1,18 | 7,1 ± 1,2 | 7,3 ± 1,1 | 0,850 | <6,5 |
| ОХ, ммоль/л | 5,4 ± 1,1 | 5,4 ± 1,1 | 5,4 ± 1,1 | 0,495 | <4,5 |
| ТГ, ммоль/л | 2 ± 0,75 | 2 ± 0,7 | 2,1 ± 0,7 | 0,550 | <1,7 |
| ЛПНП, ммоль/л | 3,3 ± 1,12 | 3,32 ± 1,1 | 3,1 ± 1,3 | 0,587 | <1,4 |
| ЛПВП, ммоль/л | 1,2 ± 0,25 | 1,3 ± 0,2 | 1,2 ± 0,3 | 0,893 | >1,0 |
| АЛТ, ЕД/л | 44 ± 25,5 | 45 ± 15 | 37,2 ± 17,6 | 0,875 | 0,0–40,0 |
| АСТ, ЕД/л | 31,6 ± 20.3 | 33 ± 22,4 | 2,6 ± 14,3 | 0,583 | 0,0–37,0 |
| ГГТП, Ед/л | 45,4 ± 27,37 | 44,3 ± 22 | 50,6 ± 31 | 0,893 | <32,0 |
| Инсулин, пмоль/л | 139,6 ± 63,68 | 138 ± 59,4 | 14,5 ± 68,8 | 0,754 | 17,8–173,0 |
| Лептин, нг/мл • Женщины • Мужчины |
39,5 ± 19,6 30,5 ± 16,16 |
40,4 ± 17,4 32 ± 17,2 |
38,5 ± 20,2 29,8 ± 16,04 |
0,455 0,352 |
1,1–27,6 0,5–13,8 |
| Альбумин г/л | 43,4 ± 3,09 | 43,8 ± 3,1 | 43,3 ± 3,4 | 0,451 | 32–52 |
| Ферритин нг/мл | 160 ± 110,94 | 158,6 ± 100,4 | 142,3 ± 102,3 | 0,950 | 30–400 |
| Грелин, пг/мл | 240 ± 122,49 | 238 ± 121,8 | 246 ± 123,8 | 0,865 | - |
| ГПП-1, нг/мл | 0,02 ± 0,03 | 0,02 ± 0,01 | 0,025 ± 0,01 | 0,658 | 0,22 ± 0,16 |
| TXNIP, нг/мл | 12,4 ± 617 | 13,3 ± 5,7 | 11,8 ± 6,5 | 0,540 | - |
Примечание. ИМТ – индекс массы тела, ОТ – окружность талии, HbA1c – гликированный гемоглобин, СРБ – С-реактивный белок, ОХ – общий холестерин, ТГ – триглицериды, ЛПНП – липопротеины низкой плотности, ЛПВП – липопротеины высокой плотности, АЛТ – аланинаминотрансфераза, АСТ – аспартатаминотрансфераза, ГГТП – гамма-глютамилтранспептидаза, ГПП-1 – глюкагоноподобный пептид 1.
Было проведено прямое сравнение в однородной выборке пациентов с СД2 и МАЖБП в группах арГПП-1 (дулаглутид) – 20 человек, иНГЛТ-2 – 29 человек. Повторно уровень TXNIP был оценен в точке 2 на фоне лечения изучаемыми классами препаратов через 6 мес., и проведен статистический анализ, сравнивающий значения показателей в точке 1 и 2.
Статистический анализ проводился с использованием программного пакета STATISTICA 10 и GraphPad Prism 10.2.3 (США). Проверка гипотезы нормальности распределения данных для всех количественных переменных выполнялась по критериям Колмогорова – Смирнова с поправкой Лилиефорса и Шапиро – Уилка. Нулевая гипотеза о нормальности закона распределения отвергалась при значениях р ≤ 0,05.
Результаты представлены в виде среднего значения и стандартного отклонения (М ± SD).
Сравнение двух независимых групп по отдельным количественным признакам осуществлялось с помощью U-критерия Манна – Уитни.
Корреляционный анализ проводился для всех количественных переменных с оценкой парных коэффициентов корреляции Спирмена. При наличии статистически значимой корреляции коэффициент |R| > 0,7 принимался как сильная взаимосвязь, 0,5 < |R| < 0,69 – как средняя, 0,3 < |R| < 0,49 – как слабая корреляция.
Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода применялся метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определялось по наивысшему значению индекса Юдена. Критический уровень значимости при проверке гипотез принимался р = 0,05.
Финансирование исследования осуществлялось из средств государственного задания №44 «Оптимизация терапевтических подходов у пациентов с сахарным диабетом 2-го типа и неалкогольной жировой болезнью печени».
Результаты
Данные МРТ, на основании которых проводилось распределение пациентов на стадии МАЖБП, представлены в табл. 1.
Исходные характеристики пациентов с СД2 в сравнении с референсными или целевыми значениями представлены в табл. 2.
Из табл. 2 следует, что пациенты, получившие в качестве второго препарата иНГЛТ2 и арГПП1, были сопоставимы по всем исходным параметрам. В рамках первого визита мы провели оценку TXNIP и сравнили показатель с данными МРТ (рис. 1).
Рисунок 1. Корреляция между значениями TXNIP и стадией метаболически ассоциированной жировой болезни печени
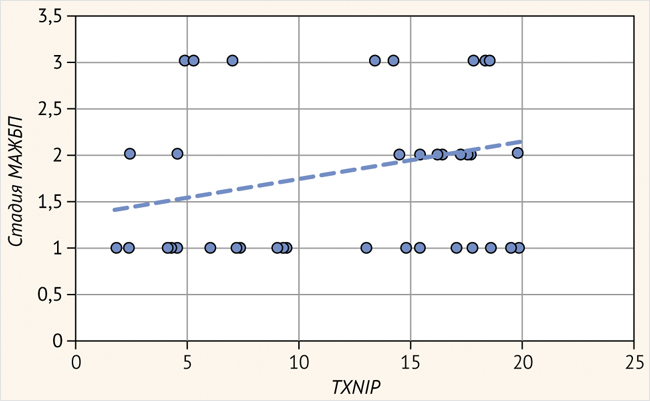
Стеатоз 1–3-й степени и НАСГ, где 1 – стеатоз 1-й степени, 2 – стеатоз 2-й степени, 3 – стеатоз 3-й степени, 4 – НАСГ без цирроза, 0–20 нг/мл – полученные значения TXNIP
Уровень TXNIP у пациентов с СД2, получающих терапию только метформином (первый визит), статистически значимо положительно коррелирует с определяемой по результатам МРТ стадией НАЖБП у пациентов с СД2 (r = 0,2872, p = 0,03).
Мы провели сравнение в динамике показателей TXNIP, полученных через 6 мес. после начала терапии исследуемыми препаратами в точке 2. Результаты представлены в табл. 3.
Таблица 3. Динамика TXNIP на фоне лечения арГПП-1 и иНГЛТ-2
| Исходно, первый визит, нг/мл | Через 6 мес., второй визит, нг/мл | % снижения в динамике | р |
|---|---|---|---|
| По всем пациентам, n = 49 | |||
| 12,4 ± 6,17 | 4,73 ± 3,82 | -62 | <0,001 |
| По пациентам на терапии арГПП-1, n = 20 | |||
| 13,3 ± 5,7 | 3,5 ± 3,23 | -74 | <0,001 |
| По пациентам на терапии иНГЛТ 2, n = 29 | |||
| 12 ± 6,5 | 5,6 ± 4,1 | -53 | <0,001 |
Таким образом, через 6 мес. после начала терапии как препаратами группы арГПП-1, так и иНГЛТ-2 в однородной выборке пациентов наблюдалось значимое (p < 0,001) снижение показателя TXNIP.
Далее нами был проведен многофакторный анализ с целью уточнения влияния на значение TXNIP исследуемых антропометрических и лабораторных данных пациентов. Пациенты были разделены на две группы: 1-я – «стеатоз» (без признаков фиброза, n = 30), 2-я – «фиброз» (МР-признаки НАСГ, n = 19). Согласно полученным данным, статистически значимые различия между пациентами с выделенным диагнозом «фиброз» («фиброз-да») и без него («фиброз-нет») выявлены только по показателю HOMA IR (p = 0,014), приближаются к порогу статистической значимости различия по показателю «общий холестерин» (р = 0,055). Данные представлены на рис. 2.
Рисунок 2. Параметры HOMA IR (А) и холестерина (В) у пациентов с фиброзом («фиброз-да») и без него («фиброз-нет»)
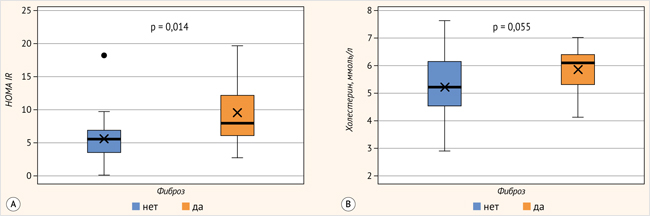
Нами был проведен анализ корреляции значений TXNIP с изучаемыми параметрами. У пациентов с фиброзом выявлена слабая положительная корреляция с уровнем HOMA IR (r = 0,32, p > 0,05). У пациентов без выраженного фиброза уровень TXNIP демонстрировал тенденцию к отрицательной корреляции с уровнем ЛПВП (r = -0,34, p > 0,05).
Обсуждение
В течение ряда лет, согласно российским и зарубежным клиническим рекомендациям, золотым стандартом диагностики МАЖБП считалась биопсия печени [13]. Однако в последние десятилетия начался активный поиск новых неинвазивных (лабораторных и инструментальных) методов оценки степени МАЖБП у пациентов с СД2, доступных для применения в рутинной клинической практике [14, 15]. Эта необходимость во многом обусловлена высокой распространенностью и нелинейностью течения МАЖБП, а также высокой распространенностью НАСГ у пациентов с СД2 [16, 17].
Среди новых возможных лабораторных маркеров диагностики МАЖБП рассматривается TXNIP. TXNIP – α-аррестиновый белок, обладающий оксидоредуктазной активностью, эндогенный ингибитор тиоредоксина (TXN), при связи с которым происходит нарушение окислительно-восстановительного баланса клеток. В свою очередь, это приводит к образованию активных форм кислорода и развитию окислительного стресса, являющегося одним из важных звеньев патогенеза МАЖБП [18–20]. TXNIP ингибирует поглощение глюкозы периферическими тканями, провоцируя усиление глюконеогенеза в печени, а также действует и через TXN-независимые пути, регулируя экспрессию генов транслокации переносчиков глюкозы и приводя к апоптозу β-клеток поджелудочной железы [21–23].
Наше исследование показало, что уровень белка TXNIP у пациентов с СД2 после первого визита до интенсификации терапии статистически значимо положительно коррелировал со стадией МАЖБП. Через 6 мес. после начала терапии как препаратами группы арГПП-1, так и иНГЛТ-2 в однородной выборке пациентов наблюдалось значимое (p < 0,01) снижение показателя TXNIP, что, вероятно, свидетельствовало об уменьшении уровня окислительного стресса и противовоспалительном эффекте, достигаемом на фоне терапии препаратами изучаемых групп [24]. Исследование корреляции TXNIP с данными МРТ и динамики на фоне терапии различными АДП было проведено впервые, данные о подобных поисках в доступной литературе найдены не были.
Согласно полученным в данной работе результатам на уровень TXNIP влиял фактор HOMA IR, что свидетельствует о наличии прямой корреляции между данными показателями и соответствует современным представлениям о патогенезе МАЖБП. Аналогичные данные были получены в ранее проведенных исследованиях, посвященных изучению молекулярных механизмов развития инсулинорезистентности у пациентов с МАЖБП [25–27].
В опубликованных в последние годы работах также была продемонстрирована взаимосвязь между уровнем белка TXNIP и прогрессированием воспалительного процесса при МАЖБП [28–30]. Выявленные тенденции в отношении корреляции между показателями ЛПВП и TXNIP у пациентов с МАЖБП требуют дальнейшего изучения и уточнения на большей выборке пациентов.
Выводы
Полученные нами данные корреляции свидетельствуют о возможном применении белка TXNIP в качестве перспективного диагностического маркера у пациентов с МАЖБП и СД2 как на этапе диагностики, так и при анализе результатов проводимой терапии.
Современные классы АДП в сочетании с метформином могут быть рассмотрены в качестве первой линии терапии у пациентов с СД2 и МАЖБП.
Необходимо проведение дальнейших многоцентровых исследований с включением большего числа пациентов, учет пациентов с НАСГ в регистре сахарного диабета, внесение МАЖБП в российские клинические рекомендации по лечению пациентов с СД – все это позволяет проводить персонифицированный выбор сахароснижающей терапии.
Список литературы / References
Развернуть
- Cao L, An Y, Liu H, Jiang J, Liu W, Zhou Y et al. Global epidemiology of type 2 diabetes in patients with NAFLD or MAFLD: a systematic review and meta-analysis. BMC Med. 2024;22(1):101. doi: 10.1186/s12916-024-03315-0.
- Powell EE, Wong VW, Rinella M. Non-alcoholic fatty liver disease. Lancet. 2021;397(10290):2212–2224. doi: 10.1016/S0140-6736(20)32511-3.
- Targher G, Corey KE, Byrne CD, Roden M. The complex link between NAFLD and type 2 diabetes mellitus – mechanisms and treatments. Nat Rev Gastroenterol Hepatol. 2021;18(9):599–612. doi: 10.1038/s41575-021-00448-y.
- Sakurai Y, Kubota N, Yamauchi T, Kadowaki T. Role of Insulin Resistance in MAFLD. Int J Mol Sci. 2021;22(8):4156. doi: 10.3390/ijms22084156.
- Fan JG, Xu XY, Yang RX, Nan YM, Wei L, Jia JD et al. Guideline for the Prevention and Treatment of Metabolic Dysfunction-associated Fatty Liver Disease (Version 2024). J Clin Transl Hepatol. 2024;12(11):955–974. doi: 10.14218/JCTH.2024.00311.
- Zeng M, Chen L, Li Y, Mi Y, Xu L. Problems and Challenges Associated with Renaming Non-alcoholic Fatty Liver Disease to Metabolic Associated Fatty Liver Disease. Medicine. 2023;3(3):105–113. doi: 10.1097/ID9.0000000000000085.
- Zhang Y, Yan Q, Gong L, Xu H, Liu B, Fang X et al. C-terminal truncated HBx initiates hepatocarcinogenesis by downregulating TXNIP and reprogramming glucose metabolism. Oncogene. 2021;40(6):1147–1161. doi: 10.1038/s41388-020-01593-5.
- Tauil RB, Golono PT, de Lima EP, de Alvares Goulart R, Guiguer EL, Bechara MD et al. Metabolic-Associated Fatty Liver Disease: The Influence of Oxidative Stress, Inflammation, Mitochondrial Dysfunctions, and the Role of Polyphenols. Pharmaceuticals. 2024;17(10):1354. doi: 10.3390/ph17101354.
- Xu HL, Wan SR, An Y, Wu Q, Xing YH, Deng CH et al. Targeting cell death in NAFLD: mechanisms and targeted therapies. Cell Death Discov. 2024;10(1):399. doi: 10.1038/s41420-024-02168-z.
- Rheinheimer J, de Souza BM, Cardoso NS, Bauer AC, Crispim D. Current role of the NLRP3 inflammasome on obesity and insulin resistance: A systematic review. Metabolism. 2017;74:1–9. doi: 10.1016/j.metabol.2017.06.002.
- Cho S, Ying F, Sweeney G. Sterile inflammation and the NLRP3 inflammasome in cardiometabolic disease. Biomed J. 2023;46(5):100624. doi: 10.1016/j.bj.2023.100624.
- Park HS, Song JW, Park JH, Lim BK, Moon OS, Son HY et al. TXNIP/VDUP1 attenuates steatohepatitis via autophagy and fatty acid oxidation. Autophagy. 2021;17(9):2549–2564. doi: 10.1080/15548627.2020.1834711.
- Tokushige K, Ikejima K, Ono M, Eguchi Y, Kamada Y, Itoh Y et al. Evidence-based clinical practice guidelines for nonalcoholic fatty liver disease/nonalcoholic steatohepatitis 2020. J Gastroenterol. 2021;56(11):951–963. doi: 10.1007/s00535-021-01796-x.
- Boursier J, Hagström H, Ekstedt M, Moreau C, Bonacci M, Cure S et al. Noninvasive tests accurately stratify patients with NAFLD based on their risk of liver-related events. J Hepatol. 2022;76(5):1013–1020. doi: 10.1016/j.jhep.2021.12.031.
- Masoodi M, Gastaldelli A, Hyötyläinen T, Arretxe E, Alonso C, Gaggini M et al. Metabolomics and lipidomics in NAFLD: biomarkers and non-invasive diagnostic tests. Nat Rev Gastroenterol Hepatol. 2021;18(12):835–856. doi: 10.1038/s41575-021-00502-9.
- Younossi ZM, Golabi P, de Avila L, Paik JM, Srishord M, Fukui N et al. The global epidemiology of NAFLD and NASH in patients with type 2 diabetes: A systematic review and meta-analysis. J Hepatol. 2019;71(4):793–801. doi: 10.1016/j.jhep.2019.06.021.
- Castera L, Laouenan C, Vallet-Pichard A, Vidal-Trécan T, Manchon P, Paradis V et al.; QUID-NASH investigators. High Prevalence of NASH and Advanced Fibrosis in Type 2 Diabetes: A Prospective Study of 330 Outpatients Undergoing Liver Biopsies for Elevated ALT, Using a Low Threshold. Diabetes Care. 2023;46(7):1354–1362. doi: 10.2337/dc22-2048.
- Guo Q, Xin M, Lu Q, Feng D, Yang V, Peng LF et al. A novel NEDD4L-TXNIPCHOP axis in the pathogenesis of nonalcoholic steatohepatitis. Theranostics. 2023;13(7):2210–2225. doi: 10.7150/thno.81192.
- Filios SR, Xu G, Chen J, Hong K, Jing G, Shalev A. MicroRNA-200 is induced by thioredoxin-interacting protein and regulates Zeb1 protein signaling and beta cell apoptosis. J Biol Chem. 2014;289(52):36275–36283. doi: 10.1074/jbc.m114.592360.
- Sullivan WJ, Mullen PJ, Schmid EW, Flores A, Momcilovic M, Sharpley MS et al. Extracellular Matrix Remodeling Regulates Glucose Metabolism through TXNIP Destabilization. Cell. 2018;175:117–132.e21. doi: 10.1016/j.cell.2018.08.017.
- Dalle S, Abderrahmani A, Renard E. Pharmacological inhibitors of β-cell dysfunction and death as therapeutics for diabetes. Front Endocrinol. 2023;14:1076343. doi: 10.3389/fendo.2023.1076343.
- Dagnell M, Schmidt EE, Arner ESJ. The A to Z of modulated cell patterning by mammalian thioredoxin reductases. Free Radic Biol Med. 2018;115:484–496. doi: 10.1016/j.freeradbiomed.2017.12.029.
- Choi EH, Park SJ. TXNIP: A key protein in the cellular stress response pathway and a potential therapeutic target. Exp Mol Med. 2023;55(7):1348–1356. doi: 10.1038/s12276-023-01019-8.
- Li A, Guan L, Su W, Zhao N, Song X, Wang J et al. TXNIP inhibition in the treatment of type 2 diabetes mellitus: design, synthesis, and biological evaluation of quinazoline derivatives. J Enzyme Inhib Med Chem. 2023;38(1):2166937. doi: 10.1080/14756366.2023.2166937.
- Zhao W, Pu M, Shen S, Yin F. Geniposide improves insulin resistance through AMPK-mediated Txnip protein degradation in 3T3-L1 adipocytes. Acta Biochim Biophys Sin. 2021;53(2):160–169. doi: 10.1093/abbs/gmaa157.
- Frankowski R, Kobierecki M, Wittczak A, Różycka-Kosmalska M, Pietras T, Sipowicz K, Kosmalski M. Type 2 Diabetes Mellitus, Non-Alcoholic Fatty Liver Disease, and Metabolic Repercussions: The Vicious Cycle and Its Interplay with Inflammation. Int J Mol Sci. 2023;24(11):9677. doi: 10.3390/ijms24119677.
- Chan KE, Koh TJL, Tang ASP, Quek J, Yong JN, Tay P, et al.. Global Prevalence and Clinical Characteristics of Metabolic-associated Fatty Liver Disease: A Meta-Analysis and Systematic Review of 10 739 607 Individuals. J Clin Endocrinol Metab. 2022;107(9):2691–2700. doi: 10.1210/clinem/dgac321.
- Chen F, Xing Y, Chen Z, Chen X, Li J, Gong S, Luo F, Cai Q. Competitive adsorption of microRNA-532-3p by circular RNA SOD2 activates Thioredoxin Interacting Protein/NLR family pyrin domain containing 3 pathway and promotes pyroptosis of non-alcoholic fatty hepatocytes. Eur J Med Res. 2024;29(1):250. doi: 10.1186/s40001-024-01817-4.
- He K, Zhu X, Liu Y, Miao C, Wang T, Li P et al. Inhibition of NLRP3 inflammasome by thioredoxin-interacting protein in mouse Kupffer cells as a regulatory mechanism for non-alcoholic fatty liver disease development. Oncotarget. 2017;8(23):37657–37672. doi: 10.18632/oncotarget.17489.
- Dagdeviren S, Lee RT, Wu N. Physiological and Pathophysiological Roles of Thioredoxin Interacting Protein: A Perspective on Redox Inflammation and Metabolism. Antioxid Redox Signal. 2023;38(4-6):442–460. doi: 10.1089/ars.2022.0022.








