
Журнал "Атеротромбоз" №1/2023
DOI: 10.21518/at2023-005
А.А. Нурхаметова*, Т.Э. Имаев, А.Е. Комлев, С.К. Курбанов, Ф.Т. Агеев, П.М. Лепилин, А.С. Колегаев, Р.С. Акчурин
Национальный медицинский исследовательский центр кардиологии имени академика Е.И. Чазова; 121552, Россия, Москва, ул. Академика Чазова, д. 15а
Введение. Периоперационное кровотечение является потенциально жизнеугрожающим осложнением хирургического вмешательства.
Встречаемость периоперационных кровотечений при транскатетерной имплантации аортального клапана (ТИАК) достигает 6%. Повышенный риск развития периоперационных кровотечений отмечается у пациентов, требующих постоянной антиагрегантной терапии, к которой относятся пациенты с сопутствующей ишемической болезнью сердца (ИБС).
Цель. Изучить факторы риска развития кровотечений, требующих гемотрансфузии, у пациентов, госпитализированных для проведения ТИАК, при сопутствующей ИБС.
Материалы и методы. Проведено ретроспективное исследование. Рассмотрены пациенты, перенесшие ТИАК в период с 2016 по 2021 г., при сопутствующей ИБС с гемодинамически значимым поражением коронарных артерий (n = 270). Изучена частота развития ранних послеоперационных кровотечений, требующих проведения гемотрансфузий. Выполнена оценка факторов риска развития кровотечений.
Результаты. Средний возраст исследуемых составил 77,7 ± 7,2 года, количество пациентов мужского и женского пола было сопоставимо – 45,9 и 54,1%. У большинства пациентов была диагностирована хроническая сердечная недостаточность (90,4%), у половины – легочная гипертензия (51,9%). Частота развития кровотечений, потребовавших проведения гемотрансфузии, составила 9,3%. Повышение риска развития кровотечений, требующих гемотрансфузии, ассоциировано с наличием следующих факторов риска: двойная антиагрегантная терапия, исходная анемия (гемоглобин менее 120 г/л), инсульт в анамнезе, хроническая почечная недостаточность и критический аортальный стеноз. Полученные факторы риска включены в прогностическую модель.
Заключение. У 9,3% пациентов с тяжелым аортальным стенозом и сопутствующей ИБС при проведении ТИАК развиваются кровотечения, требующие гемотрансфузии. Развитие кровотечения можно частично спрогнозировать с помощью предложенной в исследовании модели. Ее использование в клинической практике может быть полезным для определения превалирующего риска тромботических или геморрагических событий в послеоперационном периоде.
Для цитирования: Нурхаметова А.А., Имаев Т.Э., Комлев А.Е., Курбанов С.К., Агеев Ф.Т., Лепилин П.М., Колегаев А.С., Акчурин Р.С. Риск развития кровотечений, требующих гемотрансфузии, после транскатетерной имплантации аортального клапана у пациентов с сопутствующей ишемической болезнью сердца. Атеротромбоз. 2023;13(1):74-84. https://doi.org/10.21518/at2023-005
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Risk of bleeding requiring blood transfusion after transcatheter implantation of the aortic valve in patients with concomitant coronary artery disease
Alina A. Nurkhametova*, Timur E. Imaev, Alexey E. Komlev, Said K. Kurbanov, Fail T. Ageev, Petr M. Lepilin, Alexander S. Kolegaev, Renat S. Akchurin
National Medical Research Center of Cardiology named after the Academician E.I. Chazov; 15a, Academician Chazov St., Moscow, 121552, Russia
Introduction. Perioperative bleeding is a potentially life-threatening complication of surgical intervention. The incidence of perioperative bleeding during transcatheter aortic valve implantation (TAVI) reaches 6%. An increased risk of perioperative bleeding is noted in patients requiring constant antiplatelet therapy, which includes patients with concomitant coronary artery disease (CAD).
Aim. The study of risk factors of bleeding, which require blood transfusion in candidates for TAVI with concomitant CAD.
Materials and methods. A retrospective study. The patients with concomitant CAD who underwent TAVI from 2016 to 2021 with hemodynamically significant coronary artery stenosis (n = 270) were included in this study. The incidence of early postoperative bleeding requiring blood transfusions was analyzed. Risk factors of bleeding development were evaluated.
Results. The average age of the patients was 77.7 ± 7.2 years, the number of male and female patients was comparable (45.9 and 54.1%). The majority of patients were diagnosed with chronic heart failure (90.4%), more than half of the patients suffered from pulmonary hypertension (51.9%). The incidence of bleeding that required blood transfusion was 9.3%. The risk factors of the bleeding were dual antiplatelet therapy, baseline anemia (hemoglobin less than 120 g/l), history of stroke, chronic renal failure and critical aortic stenosis. The risk factors were included in the predictive model.
Conclusion. Bleeding requiring blood transfusion in patients with severe aortic stenosis and CAD after TAVR occurs in 9.3%. It can be partially predicted using the predictive model. The using of the predictive model may be useful in determining the predominant risk of thrombotic or bleeding events after surgery.
For citation: Nurkhametova A.A., Imaev T.E., Komlev A.E., Kurbanov S.K., Ageev F.T., Lepilin P.M., Kolegaev A.S., Akchurin R.S. Risk of bleeding requiring blood transfusion after transcatheter implantation of the aortic valve in patients with concomitant coronary artery disease. Aterotromboz = Atherothrombosis. 2023;13(1):74-84. (In Russ.) https://doi.org/10.21518/at2023-005
Conflict of interest: the authors declare no conflict of interest.
Введение
Транскатетерная имплантация аортального клапана (ТИАК) имеет очевидные преимущества, характерные для малоинвазивного вмешательства. В то же время данная операция сопряжена с риском развития многочисленных сердечно-сосудистых осложнений, среди которых кровотечение является наиболее частым [1–3]. Крупное кровотечение является жизнеугрожающим состоянием и встречается в 10% случаев при традиционной хирургической замене аортального клапана (АК), а при операции ТИАК – в 6% случаев [4, 5]. Частота развития кровотечений выше у пациентов, направляемых на ТИАК на фоне текущей антитромботической терапии, в особенности в случае двойной антиагрегантной терапии (ДААТ). Назначение ДААТ перед операцией сопровождается повышением комбинированных событий (30-дневной летальности и кровотечений) в 2,6 раза [6]. Использование ДААТ перед ТИАК обычно рассматривается в группе пациентов с сопутствующей ишемической болезнью сердца (ИБС), перенесших чрескожное коронарное вмешательство (ЧКВ) в течение предшествующих 6 мес. Особенно актуально продолжение ДААТ при недавнем ЧКВ (менее 1 мес.).
Причины кровотечения после ТИАК в большинстве случаев традиционны для оперативного лечения, к ним следует отнести кровотечение in situ в месте хирургического доступа, желудочно-кишечные кровотечения (ЖКК), кровотечение в полость перикарда и др. Среди других причин кровотечения в этой категории пациентов необходимо выделить синдром Хейде (СХ), представляющий собой сочетание тяжелого аортального стеноза (АС) и рецидивирующих ЖКК вследствие ангиодисплазии [7]. Распространенность ЖКК у пациентов с АС, связанных с СХ, составляет от 1 до 3% [8, 9]. У пациентов с АС, у которых источник кровотечения не был установлен, следует подозревать СХ [10]. Патогенетическим механизмом развития СХ является высокое гидравлическое напряжение сдвига на АК у пациентов с АС, которое вызывает разрушение высокомолекулярных мультимеров фактора фон Виллебранда (ФВ) и снижение его коллагенсвязывающей активности [11]. Развитие ангиодисплазии связано с ишемией слизистой оболочки, приводящей к расширению сосудов и формированию коралловидных сосудов по всему желудочно-кишечному тракту с наибольшей распространенностью в правой ободочной и слепой кишке [12]. В течение 12 мес., несмотря на успешно выполненную операцию ТИАК, рецидив ЖКК у пациентов с СХ был значительным (39,8%) и выше по сравнению с пациентами без СХ [7].
Наличие хронической анемии является характерным признаком у кандидатов на ТИАК. Анемия до и после оперативного вмешательства встречается нередко и может быть связана с наличием хронического заболевания, сосудистыми осложнениями, скрытым кровотечением или гемодилюцией в ходе послеоперационной гидратации, необходимой для недостающего наполнения или при возникновении обструкции выходного тракта левого желудочка [13]. В связи с этим потребность в переливании эритроцитарной массы, несмотря на то что оно связано с неблагоприятными результатами, возникает часто [14]. Так, по данным D. Tchetche et al., 38,9% пациентов, перенесших ТИАК, проведено минимум однократное переливание крови [15]. Неблагоприятные события после гемотрансфузии у пациентов, перенесших ТИАК, были изучены по результатам регистра TRITAVI. Авторы этого исследования пришли к следующим выводам:
1) возникает высокая потребность в переливании эритроцитов после операции ТИАК, которая независимо связана с увеличением ранней летальности;
2) переливание эритроцитарной взвеси увеличивает риск развития острого повреждения почек;
3) сама по себе трансфузия эритроцитов ассоциирована с летальностью независимо от развития крупных кровотечений и сосудистых осложнений [16].
В настоящее время не существует общепринятого алгоритма выполнения гемотрансфузии у пожилых пациентов, которые составляют большинство среди кандидатов на ТИАК. Выделение категории пациентов высокого риска кровотечений, требующих гемотрансфузии, представляется необходимым для определения риска хирургического лечения и изучения возможностей профилактики геморрагических осложнений.
Целью настоящего исследования явилось определение факторов риска кровотечений, требующих гемотрансфузии, в группе перенесших ТИАК пациентов при сопутствующей ИБС.
Материалы и методы
В период с 2016 по 2021 г. в отдел сердечно-сосудистой хирургии Научно-исследовательского института клинической кардиологии имени А.Л. Мясникова Национального медицинского исследовательского центра кардиологии имени академика Е.И. Чазова (руководитель – академик РАН Р.С. Акчурин) было госпитализировано 1046 пациентов с тяжелым АС для проведения операции первичной трансфеморальной ТИАК. Среди них у 276 пациентов была диагностирована сопутствующая ИБС с гемодинамически значимым поражением коронарных артерий. Операция ТИАК была выполнена у 270 пациентов.
Дизайн исследования. Исследование ретроспективное одноцентровое. Включены все пациенты, перенесшие ТИАК в период с января 2016 г. по январь 2021 г., всего 270 пациентов с сопутствующей гемодинамически значимой ИБС. Терапия антикоагулянтами (при наличии показаний) была отменена при приеме прямых пероральных антикоагулянтов в сроки до 48 ч, а при приеме варфарина операция ТИАК проводилась при снижении международного нормализованного отношения до менее 1,8 после временной отмены препарата. В качестве конечной точки выполнен анализ кровотечений, требующих гемотрансфузии. Гемотрансфузия проводилась по решению сердечно-сосудистой команды, при принятии которого использовался критерий в виде снижения уровня гемоглобина менее 7 г/дл.
Среди исходных клинико-демографических критериев следует выделить следующие:
– мультифокальный атеросклероз был выставлен при гемодинамически значимом поражении сонных артерий и (или) артерий нижних конечностей у исследуемых пациентов с ИБС;
– критический АС диагностировался при площади раскрытия АК (AVA) не более 0,6 см2;
– хроническая почечная недостаточность была диагностирована при стойком (более 3 мес.) снижении скорости клубочковой фильтрации менее 60 мл/мин.
Методы статистического анализа данных. Статистическую обработку проводили при помощи статистического пакета прикладных программ IBM SPSS Statistics 26.0 (IBM, США), Microsoft Excel 2010 (Microsoft, США), StatTech v.2.8.4 (ООО «Статтех», Россия). Перед началом анализа количественных данных проводилась их проверка на нормальность распределения (визуальный анализ гистограммы, асимметрия, эксцесс, коэффициент вариации, критерий Колмогорова – Смирнова). При распределении, близком к нормальному, переменные представлены в виде среднего арифметического (M) и стандартного отклонения (SD), а при существенном отклонении от нормального распределения использовали медиану (Me) и интерквартильный размах (Q1; Q3). Для клинически значимых эффектов рассчитывали отношение шансов (ОШ) с 95%-м доверительным интервалом (95% ДИ). Построение прогностической модели вероятности определенного исхода выполнялось при помощи метода логистической регрессии. Мерой определенности, указывающей на ту часть дисперсии, которая может быть объяснена с помощью логистической регрессии, служил коэффициент R2 Найджелкерка. Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода применялся метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определялось по наивысшему значению индекса Юдена. Различия считали статистически значимыми при р < 0,05.
Результаты
Основные характеристики пациентов, включенных в исследование, представлены в табл. 1. В основном исследуемая группа была сформирована из пациентов пожилого и старческого возраста, средний возраст составлял 77,7 ± 7,2 года. Количество мужчин и женщин было примерно равным и составляло 45,9 и 54,1%. Доля пациентов, перенесших реваскуляризацию миокарда в анамнезе до постановки диагноза тяжелого АС, была невелика и составила 9,6%. У 41,1% (n = 111) при поступлении отмечалась анемия (снижение гемоглобина менее 120 г/л). Осложненное течение АС с развитием хронической сердечной недостаточности и легочной гипертензии отмечалось у 90,4 и 51,9% исследуемых соответственно. Риск хирургического лечения по шкале Euroscore II у большинства был умеренным, более 25% имели высокий риск.
Таблица 1. Основные исходные клинико-демографические характеристики, n (%)
| Параметр | Значение |
| Возраст, М ± SD, годы | 77,7 ± 7,2 |
| Мужской пол | 124 (45,9%) |
| Ожирение | 115 (42,6%) |
| Сахарный диабет | 60 (22,2%) |
| Артериальная гипертензия | 258 (95,6%) |
| Курение в анамнезе | 34 (12,6%) |
| Хроническая обструктивная болезнь легких | 17 (6,3%) |
| Постинфарктный кардиосклероз | 71 (26,3%) |
| Низкая фракция выброса левого желудочка | 72 (26,7%) |
| ЧКВ в анамнезе | 16 (5,9%) |
| ЧКВ перед ТИАК | 206 (76,3%) |
| Недавнее ЧКВ (до 30 суток) перед ТИАК | 106 (51,5%) |
| Коронарное шунтирование в анамнезе | 10 (3,7%) |
| Мультифокальный атеросклероз | 101 (37,4%) |
| Фибрилляция предсердий | 83 (30,7%) |
| Хроническая сердечная недостаточность | 244 (90,4%) |
| Легочная гипертензия | 140 (51,9%) |
| Нарушение мозгового кровообращения в анамнезе | 32 (11,9%) |
| Хроническая почечная недостаточность | 67 (24,8%) |
| Риск по Euroscore II, Ме (Q1; Q3), % | 3,2 (1,9; 5,9) |
Примечание. ЧКВ – чрескожное коронарное вмешательство; ТИАК – транскатетерная имплантация аортального клапана.
Частота развития кровотечений, требующих гемотрансфузии, составила 9,3% (n = 25), несколько выше была частота кровотечений BARC 2–5, составившая 13,0% (n = 35). Выполнен анализ факторов риска развития кровотечений, требующих гемотрансфузии. Для этого мы разделили пациентов на две группы соответственно указанному событию: в первую группу вошли 25 пациентов, во вторую – 245. Отдельно в группе пациентов, получавших постоянную антикоагулянтную терапию (n = 83), изучено влияние терапии «моста» на развитие события, доля таких пациентов составила 36,1% (n = 30). Наиболее существенное влияние с достижением статистически значимых различий продемонстрировали два фактора: исходная анемия – снижение гемоглобина менее 120 г/л при поступлении (ОШ 7,3; 95% ДИ 1,4–38,1; p = 0,013) и хроническая почечная недостаточность (ОШ 5,2; 95% ДИ 1,2–22,5; p = 0,036). Тенденция к увеличению встречаемости кровотечений отмечалась у пациентов на фоне ДААТ перед операцией (ОШ 4,0; 95% ДИ 0,8–20,7, p = 0,076), при перенесенном остром нарушении мозгового кровообращения (ОНМК) в анамнезе (ОШ 4,7; 95% ДИ 1,0–21,9, p = 0,066) и критическом стенозе АК (ОШ 3,7; 95% ДИ 0,4–31,2, p = 0,268). Терапия «моста» не сопровождалась существенным повышением вероятности развития кровотечений, требующих гемотрансфузии (13,3 против 12,0%; ОШ 1,2; 95% ДИ 0,3–4,5, p = 0,648). Результаты анализа отражены в табл. 2.
Таблица 2. Факторы, ассоциированные с развитием послеоперационного кровотечения (при отношении шансов более 1,5)
| Фактор | ОШ | 95% ДИ | P |
| Исходная анемия | 7,3 | 1,4–38,1 | 0,013 |
| Хроническая почечная недостаточность | 5,2 | 1,2–22,5 | 0,036 |
| ОНМК в анамнезе | 4,7 | 1,0–21,9 | 0,066 |
| Двойная антиагрегантная терапия | 4,0 | 0,8–20,7 | 0,076 |
| Критический стеноз аортального клапана | 3,7 | 0,4–31,2 | 0,268 |
| Женский пол | 2,4 | 0,5–12,3 | 0,465 |
| Легочная гипертензия | 1,8 | 0,4–7,8 | 0,489 |
| Кровотечения в анамнезе | 1,5 | 0,2–13,0 | 0,729 |
Примечание. ОШ – отношение шансов; ДИ – доверительный интервал; ОНМК – острое нарушение мозгового кровообращения.
Все 8 факторов сопровождались увеличением вероятности развития кровотечений, из них статистически значимые различия достигнуты лишь для двух: хроническая почечная недостаточность и исходная анемия, которые сопровождались многократным повышением вероятности. ДААТ, ОНМК в анамнезе и критический стеноз АК увеличивали вероятность развития кровотечений в 3–5 раз, однако полученная разница не достигала статистической значимости.
Наиболее значимые факторы (ОШ больше 3), сопровождающиеся увеличением вероятности кровотечения, требующего гемотрансфузии, были включены в многофакторную модель методом бинарной логистической регрессии. Наблюдаемая зависимость описывается уравнением:
P = 1 / (1 + e–z) × 100%;
z = –5,868 + 1,419Xпн + 1,609Xи + 0,984Xкс + 1,226Xиа + 1,551XДААТ,
где P – вероятность гемотрансфузии, Xпн – ХПН (0 – нет почечной недостаточности, 1 – почечная недостаточность), Xи – инсульт/ОНМК в анамнезе (0 – нет инсульта в анамнезе, 1 – инсульт в анамнезе), Xкс – критический стеноз АК, AVA ≤0,6 (0 – тяжелый стеноз АК, 1 – критический стеноз АК), Xиа – исходная анемия (0 – уровень гемоглобина перед операцией более 120 г/л, 1 – анемия перед операцией), XДААТ – двойная антиагрегантная терапия (0 – монотерапия, 1 – двойная).
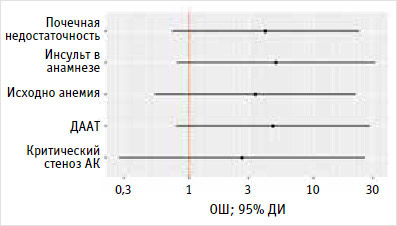
Исходя из значения коэффициента детерминации Найджелкерка модель объясняет 30,6% наблюдаемой дисперсии кровотечения, требующего гемотрансфузии. Характеристики факторов риска, используемых в модели, с вероятностью гемотрансфузии описаны в табл. 3 и представлены наглядно на рис. 1. Выполнен расчет ОШ, скорректированного по отношению каждого изучаемого фактора риска к остальным, указанным в табл. 3.
Таблица 3. Характеристики связи факторов риска модели с вероятностью гемотрансфузии
| Фактор | Нескорректированное | Скорректированное | ||
| ОШ (95% ДИ) | p | ОШ (95% ДИ) | P | |
| ХПН | 5,2 (1,2–22,5) | 0,028 | 4,1 (0,7–23,6) | 0,110 |
| ОНМК в анамнезе | 4,7 (1,0–21,9) | 0,048 | 4,9 (0,8–31,4) | 0,086 |
| Критический стеноз АК | 3,7 (0,4–31,2) | 0,227 | 2,7 (0,3–26,2) | 0,398 |
| Исходная анемия | 7,3 (1,4–38,1) | 0,018 | 3,4 (0,5–21,9) | 0,197 |
| ДААТ | 4,0 (0,8–20,7) | 0,096 | 4,7 (0,8–28,4) | 0,090 |
Примечание. ОШ – отношение шансов; ДИ – доверительный интервал; ХПН – хроническая почечная недостаточность; ОНМК – острое нарушение мозгового кровообращения; АК – аортальный клапан; ДААТ – двойная антиагрегантная терапия.
ОШ – отношение шансов; ДИ – доверительный интервал; АК – аортальный клапан; ДААТ – двойная антиагрегантная терапия.
Рисунок 1. Оценка отношения шансов с 95%-м доверительным интервалом для изучаемых факторов риска кровотечений, требующих гемотрансфузии
При оценке зависимости вероятности переливание крови от значения логистической функции P с помощью ROC-анализа была получена следующая кривая (рис. 2).
Рисунок 2. ROC-кривая, характеризующая зависимость вероятности гемотрансфузии от значения логистической функции P
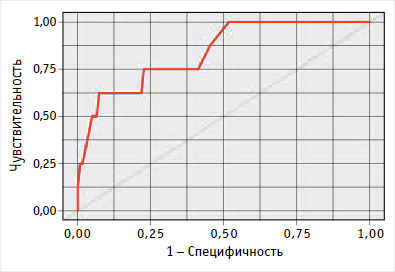
Площадь под ROC-кривой составила 0,841 ± 0,089 с 95% ДИ 0,667–1,000. Полученная модель была статистически значимой (p = 0,001). Пороговое значение логистической функции P в точке cut-off, которому соответствовало наивысшее значение индекса Юдена, составило 0,151. Кровотечение, требующее гемотрансфузии, прогнозировалось при значении логистической функции P выше 0,151 или равном ей. Чувствительность и специфичность модели составили 62,5 и 92,7% соответственно. При значении P < 0,151 риск кровотечения, требующего гемотрансфузии, прогнозируется как низкий, а при значении P ≥ 0,151 – как высокий.
Обсуждение
Частота тяжелых геморрагических событий у пациентов, перенесших операцию ТИАК, по данным литературы колеблется от 5 до 20%, для крупных кровотечений – от 2 до 40% [17–19]. Развитие кровотечения на госпитальном этапе является не только серьезным осложнением послеоперационного течения, но и важнейшим прогностическим предиктором после выписки пациентов [20–25].
При анализе данных литературы в качестве факторов риска кровотечений изучались как отдельные клинические и демографические параметры, так и уже существующие шкалы. Так, по данным японского регистра OCEAN-TAVI было установлено, что риск кровотечений по шкале HAS-BLED 4 балла предсказывал более высокую частоту развития тяжелых геморрагических осложнений [21]. В качестве самостоятельного предиктора тяжелых кровотечений в серии исследований выделена роль тяжелой почечной недостаточности [22–26]. По данным литературы частота развития кровотечений, требующих гемотрансфузии, и жизнеугрожающих кровотечений составляет 6–7% [23, 24]. В работе H. Khan выделены следующие предикторы кровотечений: возраст старше 75 лет, женский пол, наличие в анамнезе терминальной почечной недостаточности, заболеваний печени, застойная сердечная недостаточность, заболевания периферических артерий и ИБС [23]. S. Zahid et al. выделили роль язвенной болезни желудка и продемонстрировали частично схожие результаты по другим предикторам кровотечений [25]. В других работах наиболее значимыми предикторами развития тяжелых кровотечений явились анемия, сахарный диабет и использование трансаксиллярного доступа, а также предшествующее ЧКВ и женский пол [26–28]. В одной из последних работ, посвященных этому вопросу, отмечена роль инсульта в анамнезе и хронической почечной недостаточности [24]. В отечественной литературе риски кровотечений при ТИАК были изучены А.И. Мироновой и др. в когорте пациентов с фибрилляцией предсердий. По результатам многофакторного анализа предикторами развития больших / клинически значимых кровотечений (BARC 2–5) во время госпитализации оказались женский пол, гипопротеинемия при поступлении, ЧКВ менее чем за 3 мес. до ТИАК и рутинное применение терапии «моста» [29]. В изученной нами выборке доля пациентов с ИБС и фибрилляцией предсердий составила 31%, однако терапия «моста» использовалась только у 1/3 из этих пациентов, поскольку в реальной клинической практике мы старались использовать тактику временного перехода на прямые антикоагулянты как можно реже, в первую очередь у пациентов с механическим протезом митрального клапана, не включавшихся в настоящее исследование.
В нашей работе частота кровотечений, требующих гемотрансфузии, была немного выше в сравнении с данными литературы. Мы предполагаем, что основной причиной этого явилась селективная когорта пациентов с сопутствующей ИБС. Так, хирургическое лечение у большинства пациентов было выполнено на фоне ДААТ. Среди ведущих факторов риска нами выделены: хроническая почечная недостаточность, ОНМК в анамнезе, исходная анемия, а также прием ДААТ на фоне предшествующей ЧКВ и критический стеноз АК (AVA < 0,6 см2). Мы впервые выявили негативную роль критического стеноза АК в риске развития тяжелых кровотечений, другие выявленные факторы риска были описаны ранее. Одним из возможных объяснений патогенетической роли критического АС в повышении риска кровотечений является тот факт, что наблюдаемые при данном заболевании высокие скорости пристеночного сдвига потока крови создают условия для гидродинамической активации молекул ФВ, который изменяет свою конформацию с глобулярной на фибриллярную. Активированные молекулы ФВ открывают доступ тромбоцитов и факторов свертывания к ранее скрытым в глобулярной структуре доменам молекулы и одновременно подвергаются повышенной деградации металлопротеиназой ADAMTS13. Деструкция ФВ при сохранении его массовой концентрации приводит к дефициту гемостатически активных высокомолекулярных мультимеров ФВ в крови и, как следствие, к развитию приобретенной болезни Виллебранда типа 2А. Клинические проявления данного гемореологического феномена реализуются в повышении частоты геморрагических событий. Существенный клинический интерес представляет выявление обратимых факторов риска, среди которых – исходная анемия и прием ДААТ. Выделение этих факторов может быть полезным с точки зрения контроля геморрагического риска у кандидатов на ТИАК.
Нам не удалось продемонстрировать самостоятельную прогностическую ценность ни для одного из упомянутых факторов. Однако принимая во внимание данные литературы с упоминанием большинства из них ранее и многократное увеличение вероятности развития кровотечения для каждого из них в нашей работе, их ценность в качестве факторов риска кровотечений может быть высокой. В нашей работе была впервые предложена прогностическая модель с включением основных факторов риска кровотечений, требующих гемотрансфузии, которая объясняет около 1/3 событий. Использование модели с оценкой вероятности кровотечения может быть полезным в клинической практике для определения превалирующего риска тромботических или геморрагических событий. Наиболее очевидной точкой практического приложения предложенной модели представляется решение вопроса о безопасности продолжения ДААТ у кандидатов на ТИАК с ранее выполненной ЧКВ. Отсутствие четкого отрезного значения и малая дисперсия выборки ограничивают использование модели в клинической практике. Необходимы дополнительные исследования с увеличением количества пациентов в будущем.
Заключение
Геморрагические осложнения являются распространенным осложнением ТИАК, частота кровотечений, требующих гемотрансфузии, в нашей работе составила 9,3%. Среди факторов риска кровотечений наиболее значимыми являются ДААТ, исходная анемия (гемоглобин менее 120 г/л), инсульт в анамнезе, хроническая почечная недостаточность и критический стеноз АК.
Список литературы / References
- Leon M.B., Smith C.R., Mack M., Miller D.C., Moses J.W., Svensson L.G. et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med. 2010;363(17):1597-1607. https://doi.org/10.1056/nejmoa1008232.
- Dworakowski R., MacCarthy P.A., Monaghan M., Redwood S., El-Gamel A., Young C. et al. Transcatheter aortic valve implantation for severe aortic stenosis-a new paradigm for multidisciplinary intervention: a prospective cohort study. Am Heart J. 2010;160(2):237-243. https://doi.org/10.1016/j.ahj.2010.05.014.
- Thomas M., Schymik G., Walther T., Himbert D., Lefèvre T., Treede H. et al. Thirty-day results of the SAPIEN aortic Bioprosthesis European Outcome (SOURCE) Registry: A European registry of transcatheter aortic valve implantation using the Edwards SAPIEN valve. Circulation. 2010;122(1):62-69. https://doi.org/10.1161/CIRCULATIONAHA.109.907402.
- Rotman O.M., Bianchi M., Ghosh R.P., Kovarovic B., Bluestein D. Principles of TAVR valve design, modelling, and testing. Expert Rev Med Devices. 2018;15(11):771-791. https://doi.org/10.1080/17434440.2018.1536427.
- Mack M.J., Leon M.B., Thourani V.H., Makkar R., Kodali S.K., Russo M. et al. Transcatheter Aortic-Valve Replacement with a Balloon-Expandable Valve in Low-Risk Patients. N Engl J Med. 2019;380(18):1695-1705. https://doi.org/10.1056/NEJMoa1814052.
- Gandhi S., Schwalm J.D., Velianou J.L., Natarajan M.K., Farkouh M.E. Comparison of Dual-antiplatelet Therapy to Mono-antiplatelet Therapy After Transcatheter Aortic Valve Implantation: Systematic Review and Meta-analysis. Can J Cardiol. 2015;31(6):775-784. https://doi.org/10.1016/j.cjca.2015.01.014.
- Waldschmidt L., Drolz A., Heimburg P., Goßling A., Ludwig S., Voigtländer L. et al. Heyde syndrome: prevalence and outcomes in patients undergoing transcatheter aortic valve implantation. Clin Res Cardiol. 2021;110(12):1939-1946. https://doi.org/10.1007/s00392-021-01905-z.
- Godino C., Lauretta L., Pavon A.G., Mangieri A., Viani G., Chieffo A. et al. Heyde’s syndrome incidence and outcome in patients undergoing transcatheter aortic valve implantation. J Am Coll Cardiol. 2013;61(6):687-689. https://doi.org/10.1016/j.jacc.2012.10.041.
- Caspar T., Jesel L., Desprez D., Grunebaum L., Samet H., Trinh A. et al. Effects of transcutaneous aortic valve implantation on aortic valve disease-related hemostatic disorders involving von Willebrand factor. Can J Cardiol. 2015;31(6):738-743. https://doi.org/10.1016/j.cjca.2015.01.012.
- Alshuwaykh O., Krier M.J. A Case of Heyde Syndrome with Resolution of Gastrointestinal Bleeding Two Weeks After Aortic Valve Replacement. Am J Case Rep. 2018;19:924-926. https://doi.org/10.12659/AJCR.911298.
- Spangenberg T., Budde U., Schewel D., Frerker C., Thielsen T., Kuck K.H., Schäfer U. Treatment of acquired von Willebrand syndrome in aortic stenosis with transcatheter aortic valve replacement. JACC Cardiovasc Interv. 2015;8(5):692-700. https://doi.org/10.1016/j.jcin.2015.02.008.
- Sharma R., Gorbien M.J. Angiodysplasia and lower gastrointestinal tract bleeding in elderly patients. Arch Intern Med. 1995;155(8):807-812. https://doi.org/10.1001/archinte.1995.00430080037005.
- Suh W.M., Witzke C.F., Palacios I.F. Suicide left ventricle following transcatheter aortic valve implantation. Catheter Cardiovasc Interv. 2010;76(4):616-620. https://doi.org/10.1002/ccd.22609.
- Nuis R.J., Rodés-Cabau J., Sinning J.M., van Garsse L., Kefer J., Bosmans J. et al. Blood transfusion and the risk of acute kidney injury after transcatheter aortic valve implantation. Circ Cardiovasc Interv. 2012;5(5):680-688. https://doi.org/10.1161/CIRCINTERVENTIONS.112.971291.
- Tchetche D., Van der Boon R.M., Dumonteil N., Chieffo A., Van Mieghem N.M., Farah B. et al. Adverse impact of bleeding and transfusion on the outcome post-transcatheter aortic valve implantation: insights from the Pooled-RotterdAm-Milano-Toulouse In Collaboration Plus (PRAGMATIC Plus) initiative. Am Heart J. 2012;164(3):402-409. https://doi.org/10.1016/j.ahj.2012.07.003.
- Zimarino M., Barbanti M., Dangas G.D., Testa L., Capodanno D., Stefanini G.G. et al. Early Adverse Impact of Transfusion After Transcatheter Aortic Valve Replacement: A Propensity-Matched Comparison From the TRITAVI Registry. Circ Cardiovasc Interv. 2020;13(12):e009026. https://doi.org/10.1161/CIRCINTERVENTIONS.120.009026.
- Buchanan G.L., Chieffo A., Montorfano M., Maisano F., Latib A., Godino C. et al. The role of sex on VARC outcomes following transcatheter aortic valve implantation with both Edwards SAPIEN™ and Medtronic CoreValve ReValving System® devices: the Milan registry. EuroIntervention. 2011;7(5):556-563. https://doi.org/10.4244/EIJV7I5A91.
- Eltchaninoff H., Prat A., Gilard M., Leguerrier A., Blanchard D., Fournial G. et al. Transcatheter aortic valve implantation: early results of the FRANCE (FRench Aortic National CoreValve and Edwards) registry. Eur Heart J. 2011;32(2):191-197. https://doi.org/10.1093/eurheartj/ehq261.
- Nuis R.J., Piazza N., Van Mieghem N.M., Otten A.M., Tzikas A., Schultz C.J. et al. In-hospital complications after transcatheter aortic valve implantation revisited according to the Valve Academic Research Consortium definitions. Catheter Cardiovasc Interv. 2011;78(3):457-467. https://doi.org/10.1002/ccd.23018.
- Konigstein M., Ben-Assa E., Banai S., Shacham Y., Ziv-Baran T., Abramowitz Y. et al. Periprocedural bleeding, acute kidney injury, and long-term mortality after transcatheter aortic valve implantation. Can J Cardiol. 2015;31(1):56-62. https://doi.org/10.1016/j.cjca.2014.11.006.
- Honda Y., Yamawaki M., Araki M., Tada N., Naganuma T., Yamanaka F. et al. Impact of HAS-BLED score to predict trans femoral transcatheter aortic valve replacement outcomes. Catheter Cardiovasc Interv. 2018;92(7):1387-1396. https://doi.org/10.1002/ccd.27596.
- Moretti C., D’Amico M., D’Ascenzo F., Colaci C., Salizzoni S., Tamburino C. et al. Impact on prognosis of periprocedural bleeding after TAVI: mid-term follow-up of a multicenter prospective study. J Interv Cardiol. 2014;27(3):293-299. https://doi.org/10.1111/joic.12115.
- Khan H., Gilani A., Qayum I., Khattak T., Haq F., Zahid Anwar M. et al. An Analysis of the Predictors of Major Bleeding After Transcatheter Aortic Valve Transplantation Using the National Inpatient Sample (2015-2018). Cureus. 2021;13(6):e16022. https://doi.org/10.7759/cureus.16022.
- Albabtain M.A., Arafat A.A., Alonazi Z., Aluhaydan H., Alkharji M., Alsaleh R. et al. Risk of Bleeding after Transcatheter Aortic Valve Replacement: impact of Preoperative Antithrombotic Regimens. Braz J Cardiovasc Surg. 2022;37(6):836-842. https://doi.org/10.21470/1678-9741-2020-0538.
- 25. Zahid S., Khan M.Z., Bapaye J., Altamimi T.S., Elkhapery A., Thakkar S. et al. Outcomes, Trends, and Predictors of Gastrointestinal Bleeding in Patients Undergoing Transcatheter Aortic Valve Implantation (from the National Inpatient Sample). Am J Cardiol. 2022;170:83-90. https://doi.org/10.1016/j.amjcard.2022.01.022.
- Kochman J., Rymuza B., Huczek Z., Kołtowski Ł., Ścisło P., Wilimski R. et al. Incidence, Predictors and Impact of Severe Periprocedural Bleeding According to VARC-2 Criteria on 1-Year Clinical Outcomes in Patients After Transcatheter Aortic Valve Implantation. Int Heart J. 2016;57(1):35-40. https://doi.org/10.1536/ihj.15-195.
- Ullery B.W., Jin R., Kirker E.B., Hayes G., Siwek L., Brevig J. et al. Trends in vascular complications and associated treatment strategies following transfemoral transcatheter aortic valve replacement. J Vasc Surg. 2020;72(4):1313-1324.e5. https://doi.org/10.1016/j.jvs.2020.01.050.
- Wang J., Yu W., Jin Q., Li Y., Liu N., Hou X., Yu Y. Risk Factors for Post-TAVI Bleeding According to the VARC-2 Bleeding Definition and Effect of the Bleeding on Short-Term Mortality: A Meta-analysis. Can J Cardiol. 2017;33(4):525-534. https://doi.org/10.1016/j.cjca.2016.12.001.
- Миронова А.И., Кропачева Е.С., Комлев А.Е., Имаев Т.Э., Панченко Е.П. Предикторы развития геморрагических осложнений в период госпитализации у больных с фибрилляцией предсердий, подвергнутых транскатетерной имплантации аортального клапана. Кардиологический вестник. 2022;17(2):65-72. https://doi.org/10.17116/Cardiobulletin20221702165.


