Журнал "Медицинский совет" №9/2024
DOI: 10.21518/ms2024-068
Г.В. Неклюдова1,2, Д.В. Фан1, Н.В. Трушенко1,2,
Г.С. Нуралиева1,2, З.Г. Берикханов1, С.Н. Авдеев1,2
1 Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет); 119991, Россия, Москва, ул. Большая Пироговская, д. 2, стр. 4
2 Научно-исследовательский институт пульмонологии Федерального медико-биологического агентства; 115682, Россия, Москва, Ореховый бульвар, д. 28
Введение. Пневмония является частым проявлением коронавирусной инфекции. COVID-ассоциированная пневмония является заболеванием, характеризующимся нестандартным течением и рядом клинических феноменов, затрудняющих своевременную диагностику и лечение.
Цель. Изучить феномен немой гипоксемии при COVID-ассоциированной пневмонии.
Материалы и методы. В исследование включено 214 пациентов, которые были разделены на 2 группы. В группу исследования включили пациентов с подтвержденной COVID-ассоциированной пневмонией, а в группу контроля – пациентов с интерстициальными заболеваниями легких (ИЗЛ) (идиопатический легочный фиброз, неспецифическая интерстициальная пневмония, гиперчувствительный пневмонит). Оценивали субъективное состояние пациента, наличие сопутствующей патологии, данные компьютерной томографии высокого разрешения, газовый состав артериальной крови, а также данные спирометрии.
Результаты. У больных с COVID-ассоциированной пневмонией немая гипоксемия встречалась в 1,3 раза чаще, чем у больных ИЗЛ. При сравнении больных с немой гипоксемией и гипоксемией с одышкой при COVID-ассоциированной пневмонии определяются статистически значимо более высокие значения PaCO2 и более низкие значения частоты дыхания (ЧД). При ИЗЛ такие закономерности не выявлены. У больных с немой гипоксемией при ИЗЛ ЧД статистически значимо выше по сравнению с больными с COVID-ассоциированной пневмонией. Одномерный логистический регрессионный анализ демонстрирует, что у больных ИЗЛ немая гипоксемия ассоциирована с увеличением ИМТ (ОШ = 1,380 (95% ДИ: 1,058–1,801); р = 0,017).
Выводы. Феномен «немая гипоксемия» может встречаться не только при поражениях легких, вызванных SARS-CoV-2-инфекцией, однако именно при COVID-ассоциированной пневмонии отсутствие жалоб пациентов на одышку объективизируется отсутствием тахипноэ. Из-за феномена «немой гипоксемии» клинические проявления могут запаздывать, отвести подозрение от тяжелого поражения легких, которое в скором времени может привести к срыву компенсаторных механизмов.
Для цитирования: Неклюдова ГВ, Фан ДВ, Трушенко НВ, Нуралиева ГС, Берикханов ЗГ, Авдеев СН. Немая гипоксемия – специфический признак COVID-ассоциированной пневмонии? Медицинский совет. 2024;18(9):144–150. https://doi.org/10.21518/ms2024-068.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Silent hypoxemia – A specific sign of COVID-associated pneumonia?
Galina V. Nekludova1,2, Devid V. Fan1, Natalia V. Trushenko1,2,
Galiya S. Nuralieva1,2, Zelimkhan G. Berikkhanov1, Sergey N. Avdeev1,2
1 Sechenov First Moscow State Medical University (Sechenov University); 2, Bldg. 4, Bolshaya Pirogovskaya St., Moscow, 119991, Russia
2 Research Institute for Pulmonology of the Federal Medical Biological Agency; 8, Orekhovy Boulevard, Moscow, 115682, Russia
Introduction. Pneumonia is a frequent manifestation of coronavirus infection. COVID-associated pneumonia is a disease characterized by a non-standard course and a number of clinical phenomena that complicate timely diagnosis and treatment.
Aim. To investigate the phenomenon of mute hypoxemia in COVID-associated pneumonia.
Materials and methods. The study included 214 patients who were divided into 2 groups. The study group included patients with confirmed COVID-associated pneumonia, and the control group included patients with interstitial lung diseases (idiopathic pulmonary fibrosis, nonspecific interstitial pneumonia, hypersensitivity pneumonitis). The subjective condition of the patient, presence of concomitant pathology, high-resolution computed tomography data, arterial blood gas composition, and spirometry data were evaluated.
Results. In patients with COVID-associated pneumonia, “silent hypoxemia” was encountered 1.3 times more frequently than in patients with non-COVID-associated pneumonia. When comparing patients with silent hypoxemia and hypoxemia with dyspnea in COVID-associated pneumonia, statistically significantly higher values of PaCO2 and lower values of respiratory rate are observed. Such patterns are not detected in non-COVID-associated pneumonia. In patients with silent hypoxemia in non-COVIDassociated pneumonia, the respiratory rate is statistically significantly higher compared to patients with COVID-associated pneumonia. Univariate logistic regression analysis demonstrates that in patients with non-COVID-associated pneumonia, silent hypoxemia is associated with BMI increase (OR = 1.380 (95% CI: 1.058–1.801); p = 0.017).
Conclusion. The phenomenon of “silent hypoxemia” may manifest not only in pulmonary impairments resulting from SARS-CoV-2 infection but notably in COVID-associated pneumonia, where the absence of patient-reported dyspnea is substantiated by the lack of tachypnea. Owing to the subtleties of “silent hypoxemia”, clinical presentations may exhibit delays, diverting attention from significant pulmonary compromise, which could subsequently precipitate the failure of compensatory mechanisms.
For citation: Neklyudova GV, Fan DV, Trushenko NV, Nuralieva GS, Berikkhanov ZG, Avdeev SN. Silent hypoxemia – A specific sign of COVID-associated pneumonia? Meditsinskiy Sovet. 2024;18(9):144–150. (In Russ.) https://doi.org/10.21518/ms2024-068.
Conflict of interest: the authors declare no conflict of interest.
Введение
Частым проявлением новой коронавирусной инфекции является развитие пневмонии [1–5]. Однако КТ-изменения легочной ткани в виде «матового стекла», ретикулярных изменений, наличия участков консолидации встречаются не только при вирусной пневмонии, но и при большом спектре других паренхиматозных заболеваний легких, в т. ч. при идиопатическом легочном фиброзе (ИЛФ), неспецифической интерстициальной пневмонии (НСИП), гиперчувствительном пневмоните (ГП) [6–8].
При паренхиматозных заболеваниях легких возможно развитие, как правило, гипоксемической дыхательной недостаточности (ДН). Данный вариант ДН характеризуется формированием гипоксемии на фоне нормоили гипокапнии [9, 10].
В эпоху пандемии COVID-19 появились публикации, которые обсуждают т. н. вариант немой гипоксемии у больных с COVID-ассоциированной пневмонией. В литературе можно встретить описание клинических случаев, демонстрирующих то, что, несмотря на обширное повреждение легких и гипоксемию, часть пациентов с пневмонией на фоне COVID-19 не предъявляли жалобы на субъективное ощущение дискомфорта при дыхании, определяемое как одышка.
Значимость данного феномена, несомненно, велика для своевременного принятия правильного клинического решения, поскольку отсутствие одышки может привести к недооценке истинной тяжести заболевания.
Распространенность данного феномена весьма отличается в разных исследованиях [11, 12], поскольку до сих пор нет единого определения «немой гипоксемии».
Учитывая клиническую значимость немой гипоксемии возникает закономерный вопрос, насколько данный феномен является специфичной характеристикой именно вирусной пневмонии или он может выявляться и при других интерстициальных изменениях легких, приводящих к гипоксемии?
В настоящем исследовании мы провели анализ двух групп пациентов с интерстициальными изменениями легких, а именно пациентов с COVID-ассоциированной пневмонией и пациентов с интерстициальными заболеваниями легких (ИЗЛ).
Цель – изучить феномен немой гипоксемии при COVID-ассоциированной пневмонии.
Материалы и методы
В исследование включены данные 214 пациентов старше 18 лет. В группу исследования включены 134 пациента с COVID-ассоциированной пневмонией, проходивших лечение от новой коронавирусной инфекции в Университетской клинической больнице №4 Сеченовского Университета с апреля 2020 по март 2022 г. и случайным образом отобранные в исследование. Диагноз «COVID-19 » был подтвержден методом полимеразной цепной реакции (ПЦР) биоматериала из ротоглотки и/или носоглотки. Также в исследование были включены данные 80 пациентов с ИЗЛ, наблюдающихся в НМИЦ по профилю «пульмонология» Сеченовского Университета, из них идиопатический легочный фиброз (ИЛФ) был диагностирован у 22 (27,8%) пациентов, неспецифическая интерстициальная пневмония (НСИП) – у 13 (16,5%) и гиперчувствительный пневмонит (ГП) – у 45 (55,7%) пациентов.
В ходе исследования были проанализированы демографические, антропометрические и клинические данные, а именно возраст, пол, индекс массы тела (ИМТ), данные компьютерной томографии высокого разрешения (ВРКТ), наличие коморбидных состояний и легочной гипертензии, а также показатели газового состава артериальной крови при дыхании атмосферным воздухом, данные спирометрии, выраженность одышки по шкале Borg.
В настоящем исследовании были проанализированы данные ВРКТ больных с COVID-ассоциированной пневмонией при поступлении в стационар, у больных с ИЗЛ – актуальные данные ВРКТ на момент сбора основных клинико-функциональных параметров. Каждая томограмма проходила экспертную оценку рентгенолога.
У пациентов с COVID-ассоциированной пневмонией, так же как и у больных ИЗЛ сбор клинико-функциональных параметров был проведен в минимальном временном промежутке от времени проведения ВРКТ.
Диагностика легочной гипертензии (ЛГ) была основана на показателе систолического давления в легочной артерии (СДЛА), определенном с помощью эхокардиографии с использованием модифицированного уравнения Бернулли. При отсутствии стеноза клапана легочной артерии и выходного тракта ПЖ СДЛА рассчитывалось как PGТР + ДПП, где PGТР – максимальный систолический транстрикуспидальный градиент давления, ДПП – давление в ПП, которое оценивалось эмпирически по состоянию нижней полой вены и ее реакции на дыхательный маневр [13–15]. Состояние, при котором систолическое давление в легочной артерии было более 35 мм рт. ст., расценивалось как ЛГ.
У больных с новой коронавирусной инфекцией спирометрия проводилась в отдельном помещении, которое было оснащено дезинфицирующим оборудованием, и на приборе, предназначенном исключительно для таких больных. Медицинский персонал выполнял исследования в средствах индивидуальной защиты (СИЗ). Минимальное время между исследованиями составляло не менее 30 мин. Между исследованиями осуществлялась санитарная обработка дезинфицирующими средствами потенциально загрязненных поверхностей и дезинфекция помещения. Все исследования были проведены с использованием высокоэффективных одноразовых антибактериальных/антивирусных фильтров [16]. Определяли форсированную жизненную емкость легких (ФЖЕЛ), объем форсированного выдоха за первую секунду (ОФВ1), отношение ОФВ1/ФЖЕЛ.
Забор и хранение образца артериальной крови для анализа проводили согласно руководству для клинической практики [17].
Состояние, при котором PaO2 ≤ 60 мм рт. ст. и выраженность одышки в покое по шкале Borg составила 0 или 1 балл, было определено как «немая гипоксемия».
Статистический анализ
Нормальность распределения количественных данных оценивали с помощью теста Шапиро – Уилка. Поскольку проверка данных на соответствие нормальному закону распределения показала, что большинство рассматриваемых показателей имели распределение, отличное от нормального, то количественные данные представлены как медиана (Ме) и интерквартильный разброс (Ме (Q1–Q3)), качественные признаки – как абсолютные и относительные (%) частоты.
Сравнение непрерывных переменных между несвязанными группами проводилось с использованием U-критерия Манна – Уитни. Качественные переменные между группами сравнивали при помощи точного теста Фишера (при численных значениях менее 5) или критерия χ2 Пирсона.
Анализ связи признаков осуществляли с помощью метода ранговой корреляции Спирмена.
Анализ влияния показателя на вероятность развития события проводили при помощи метода логистической регрессии. Результат анализа представлен в виде отношения шансов (ОШ), 95%-ного доверительного интервала (ДИ) и уровня диагностической значимости (p).
Тесты считались статистически значимыми при р < 0,05.
Статистический анализ данных осуществлялся при помощи программного обеспечения IBM SPSS Statistics, version 26 (IBM Corporation, USA).
Результаты
В исследование включены 214 пациентов (111 (51,9%) мужчин и 103 (48,1%) женщины, медиана возраста составила 61,0 (49,0–68,0) года) (табл. 1), из них 134 больных с COVID-ассоциированной пневмонией и 80 больных – с интерстициальными заболеваниями легких – характеристика и сравнительный анализ групп представлены в табл. 1.
Таблица 1. Характеристика и сравнительный анализ больных с COVID-ассоциированной пневмонией и интерстициальными заболеваниями легких
| Характеристика пациентов | COVID-ассоциированная пневмония (n = 134) | ИЗЛ (n = 80) | p |
|---|---|---|---|
| Пол (М), n (%) | 81 (60,4) | 30 (37,5) | 0,002 |
| Возраст, года | 62,0 (47,8–68,0) | 60,0 (49,8–67,0) | 0,380 |
| ИМТ, см/м2 | 28,6 (25,6–32,1) | 28,0 (23,0–32,2) | 0,229 |
| Сопутствующая патология, n (%): • ССЗ • Ожирение • СД |
65 (48,5) 50 (37,3) 16 (11,9) |
39 (48,8) 31 (38,8) 10 (12,5) |
1,000 0,881 0,998 |
| Borg, балл | 0 (0–3) | 1 (0–2) | 0,073 |
| ЧД/мин | 19 (16–21) | 22 (20–23) | 0,000 |
| ЧСС/мин | 76 (67–86) | 86 (80–95) | 0,000 |
| PaO2, мм рт. ст. | 74,0 (60,0–82,0) | 69,9 (59,0–83,8) | 0,631 |
| PaCO2, мм рт. ст. | 36,0 (33,2–40,0) | 38,0 (34,1–41,0) | 0,010 |
| pH | 7,43 (7,40–7,46) | 7,44 (7,42–7,45) | 0,624 |
| PaO2 ≤ 60 мм рт. ст., n (%) | 47 (35,1) | 29 (36,3) | 0,871 |
| ФЖЕЛ, %долж. | 85,5 (66,0–99,0) | 64,0 (52,0–79,0) | 0,000 |
| ОФВ1, %долж. | 80,0 (64,8–93,3) | 71,0 (55,0–82,0) | 0,002 |
| ОФВ1/ФЖЕЛ | 0,77 (0,72–0,82) | 0,85 (0,80–0,89) | 0,000 |
| ЛГ, n (%) | 24 (17,9) | 49 (61,3) | 0,000 |
Сравнительный анализ исследуемых групп не продемонстрировал статистически значимых отличий по выраженности гипоксемии. PaO2 ≤ 60 мм рт. ст. определялось практически в одинаковых пропорциях в обеих группах, а именно у больных с COVID-ассоциированной пневмонией – в 35,1% случаев, у больных ИЗЛ – в 36,3% случаев.
Следует отметить, что у больных с COVID-ассоциированной пневмонией PaCO2 было статистически значимо ниже, так же как ЧД и ЧСС.
В обеих исследуемых группах корреляционный анализ не выявил статистически значимой связи между выраженностью одышки и PaO2 (COVID-ассоциированная пневмония: r = -,104; p = 0,238; ИЗЛ: r = -0,066; p = 0,637). В отличие от больных ИЗЛ у больных с COVID-ассоциированной пневмонией определялась статистически значимая корреляционная связь выраженности одышки и величины PaСО2 (COVID-ассоциированная пневмония: r = -0,233; p = 0,007; ИЗЛ: r = -0,152; p = 0,267).
Кроме того, отмечались статистически значимые отличия между анализируемыми группами больных по показателям спирометрии. Так, у больных ИЗЛ определялось снижение ФЖЕЛ и соответствующее ему снижение ОФВ1 (табл. 1).
У больных с ИЗЛ статистически значимо чаще выявлялась ЛГ. Одномерный логистический регрессионный анализ демонстрирует, что у больных ИЗЛ ЛГ ассоциирована со снижением PaO2 (ОШ = 0,958 (95% ДИ: 0,921– 0,996); р = 0,033), в то время, как у больных с COVID-ассоциированной пневмонией не было обнаружено такой связи (ОШ = 0,998 (95% ДИ: 0,964–1,034); р = 0,932).
Сравнительная характеристика больных с артериальной гипоксемией при COVID-ассоциированной пневмонией и ИЗЛ представлена в табл. 2.
Таблица 2. Характеристика и сравнительный анализ пациентов с PaO2 ≤ 60 мм рт. ст. при COVID-ассоциированной пневмонии и интерстициальными заболеваниями легких
| Характеристика пациентов | COVID-ассоциированная пневмония (n = 47) | ИЗЛ (n = 29) | p |
|---|---|---|---|
| Пол (М), n (%) | 29 (61,7) | 18 (62,1) | 1,000 |
| Возраст, года | 63,0 (52,0–67,0) | 63,0 (56,3–66,0) | 0,777 |
| ИМТ, см/м2 | 29,4 (26,2–32,7) | 30,0 (24,6–32,4) | 0,559 |
| Сопутствующая патология, n (%): • ССЗ • Ожирение • СД |
26 (55,3) 20 (42,6) 6 (12,8) |
20 (69,0) 15 (51,7) 4 (13,8) |
0,306 0,588 0,982 |
| Borg, балл | 0 (0–4) | 1,5 (0–3) | 0,098 |
| ЧД/мин | 20,0 (16,0–22,0) | 22,0 (22,0–24,0) | 0,000 |
| ЧСС/мин | 76,0 (65,8–88,5) | 85,0 (80,0–92,0) | 0,020 |
| PaO2, мм рт. ст. | 59,0 (57,0–60,0) | 59,0 (53,8–60,0) | 0,163 |
| PaCO2, мм рт. ст. | 36,6 (34,0–41,0) | 37,5 (32,8–42,5) | 0,977 |
| pH | 7,44 (7,41–7,47) | 7,43 (7,42–7,44) | 0,172 |
| Немая гипоксемия, n (%) | 27 (57,4) | 13 (44,8) | 0,347 |
| ФЖЕЛ, %долж. | 80,5 (64,0–93,0) | 61,0 (49,5–75,5) | 0,023 |
| ОФВ1, %долж. | 75,5 (63,0–92,0) | 67,5 (56,0–80,5) | 0,257 |
| ОФВ1/ФЖЕЛ | 0,78 (0,73–0,84) | 0,84 (0,80–0,88) | 0,002 |
| ЛГ, n (%) | 9 (19,1) | 21 (72,4) | 0,000 |
У больных с COVID-ассоциированной пневмонией немая гипоксемия встречалась в 1,3 раза чаще, чем у больных ИЗЛ, однако эти различия не были статистически значимыми.
При сравнении исследуемых групп больных с гипоксемией определены статистически значимые отличия по ЧД, ЧСС, ФЖЕЛ (% долж.), ОФВ1/ФЖЕЛ, частоте ЛГ.
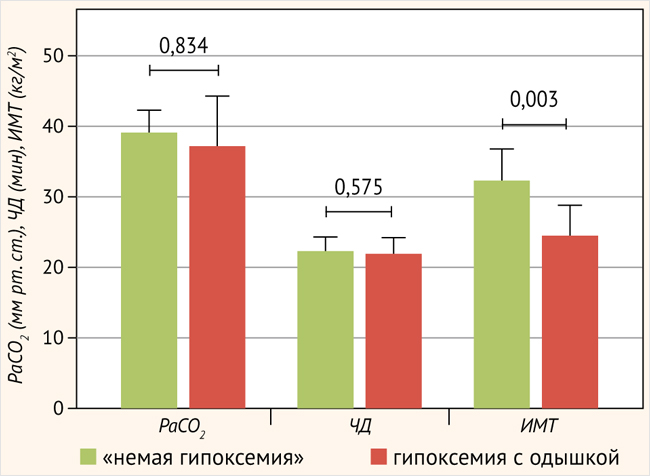
Сравнение больных с немой гипоксемией и гипоксемией с одышкой при COVID-ассоциированной пневмонии продемонстрировало следующие статистически значимые отличия: PaCO2 – 40,0 (35,0–43,0) мм рт. ст. и 35,0 (31,5–39,9) мм рт. ст. (р = 0,023); ЧД – 16,5 (15,8–20,5) дыхательных движений в минуту и 20,5 (20,0–24,0) дыхательных движений в минуту (р = 0,027) соответственно. У больных ИЗЛ не определены статистически значимые отличия по этим показателям: РаСО2 – 39,0 (34,0–42,0) мм рт. ст. и 37,0 (32,0– 44,0) мм рт. ст. (р = 0,834); ЧД – 22,5 (22,0–24,3) дыхательных движений в минуту и 22,0 (21,5–24,3) дыхательных движений в минуту (р = 0,575) соответственно (рис. 1, 2).
Рисунок 1. Параметры РаСО2, ЧД и ИМТ у больных с немой гипоксемией и с гипоксемией с одышкой при COVID-ассоциированной пневмонии
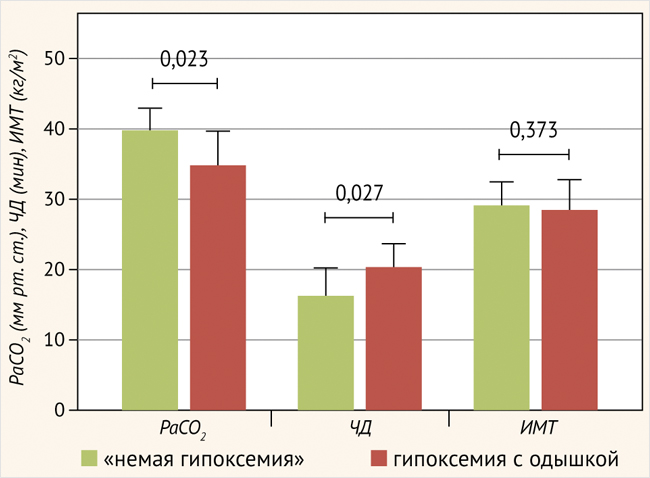
Рисунок 2. Параметры РаСО2, ЧД и ИМТ у больных с немой гипоксемией и с гипоксемией с одышкой при ИЗЛ
Одномерный логистический регрессионный анализ демонстрирует, что у больных с гипоксемией при COVID-ассоциированной пневмонии немая гипоксемия ассоциирована с PaCO2 (ОШ = 1,158 (95% ДИ: 1,019–1,315); р = 0,025). В свою очередь, у больных ИЗЛ одномерный логистический регрессионный анализ выявил ассоциацию немой гипоксемии с ИМТ (ОШ = 1,380 (95% ДИ: 1,058–1,801); р = 0,017).
Обсуждение
Одним из проявлений интерстициальных изменений легких может быть формирование гипоксемической ДН, при которой уровень парциального напряжения углекислого газа не увеличен.
Механизмы развития гипоксемии хорошо известны. Данное патологическое состояние развивается в результате альвеолярной гиповентиляции, вентиляционно-перфузионного (VА /Q) дисбаланса (наиболее частый механизм, ведущий к развитию гипоксемии) и нарушения диффузии газов через альвеолярно-капиллярную мембрану.
Выраженность одышки может не соответствовать степени гипоксической ДН. В проведенных ранее исследованиях и клинических наблюдениях было продемонстрировано, что у некоторых больных с вирусной пневмонией развивается т. н. «немая гипоксемия», когда гипоксемия не сопровождается жалобами на одышку.
В представленной статье проведен сравнительный анализ больных с COVID-ассоциированной пневмонией и интерстициальными заболеваниями легких как больных с потенциальной возможностью развития гипоксемической ДН для оценки выраженности симптома «немая гипоксемия».
В обеих исследованных группах нарушение легочной вентиляции было оценено с помощью спирометрии. Больные ИЗЛ характеризовались рестриктивным паттерном нарушения легочной вентиляции по данным спирометрии, снижением ФЖЕЛ (61,0 (49,5–75,5) л) при сохраненном соотношении ОФВ1/ФЖЕЛ, в то время как у больных с COVID-ассоциированной пневмонией ФЖЕЛ была статистически значимо выше (80,5 (64,0–93,0) л (p = 0,023)).
У больных с гипоксемией ожидаемо повышение давления в ЛА. Несмотря на то что уровень оксигенации в исследуемых группах статистически значимо не отличался, тем не менее частота ЛГ была статистически значимо выше у больных ИЗЛ. При развитии гипоксемии частота выявления ЛГ при ИЗЛ была в 3,8 раза выше, чем при COVID-ассоциированной пневмонии. Ассоциация ЛГ с величиной РаО2 при ИЗЛ, в отличие от больных с новой коронавирусной инфекцией, в нашем исследовании была продемонстрирована результатами логистического регрессионного анализа. Можно предположить, что у больных с пневмонией на фоне COVID-19 может уменьшаться гипоксическая вазоконстрикция, что приводит к сохранению кровотока в легочных капиллярах в неаэрируемых или гиповентилируемых альвеолах и тем самым – к увеличению внутрилегочного шунтирования, к усугублению вентиляционно-перфузионного дисбаланса и артериальной гипоксемии [18, 19].
Больные обеих групп имели схожий уровень парциального насыщения артериальной крови кислородом и практически одинаковую долю больных с PaO2 ≤ 60 мм рт. ст. Гипоксемия является одним из вентиляторных стимулов, однако ее роль не столь значима при PaO2 выше 60–65 мм рт. ст. [20–22]. В нашем исследовании корреляционный анализ не выявил статистически значимой связи между выраженностью одышки и гипоксемии.
Для появления одышки должны существовать дополнительные стимулы. Одним из наиболее мощных стимулов развития одышки является CO2, при повышении уровня CO2 в артериальной крови происходит активация легочных афферентных нейронов и/или хеморецепторов CO2 [23, 24].
В нашем исследовании у больных обеих групп с гипоксемией медиана PaCO2 не была увеличена, поэтому не удивительно, что феномен «немая гипоксемия» может быть обнаружен не только при вирусной пневмонии, но и у больных с другими причинами интерстициальных изменений легких. Так, при PaO2 ≤ 60 мм рт. ст. доля больных с «немой гипоксемией» статистически значимо не отличалась в обеих исследуемых группах и составила 57,4% при COVID-ассоциированной пневмонии и 44,8% – при ИЗЛ.
Важно отметить, что при COVID-ассоциированной пневмонии у больных с немой гипоксемией медиана PaCO2 была статистически значимо выше в отличие от больных с гипоксемией и одышкой, при этом ЧД была статистически значимо ниже у больных с немой гипоксемией. У больных ИЗЛ такой закономерности выявлено не было, т. е. не определялись статистически значимые отличия по PаCO2 и ЧД, причем у больных с немой гипоксемией при ИЗЛ ЧД была статистически значимо выше по сравнению с больными с COVID-ассоциированной пневмонией (рис. 1, 2).
Таким образом, для компенсации гипоксемии пациенты ИЗЛ увеличивают легочную вентиляцию за счет частоты дыхания, что приводит к снижению PaCO2. Однако пациенты с немой гипоксемией не расценивают это как одышка. В свою очередь, больные с немой гипоксемией при COVID-ассоциированной пневмонии не увеличивают частоту дыхания и не усиливают альвеолярную вентиляцию [25]. По-видимому, причиной данного явления могут быть механизмы центрального генеза. В имеющейся литературе ряд авторов, исследующих данный вопрос, придерживаются этой концепции, поскольку пониженная центральная хемочувствительность в большей степени влияет на легочную вентиляцию, чем снижение уровня PaO2 [20, 26].
Почему же ряд больных ИЗЛ не расценивают учащенное дыхание как одышку? Проведенный логистический регрессионный анализ показал, что увеличение ИМТ ассоциировано с формированием немой гипоксемии. Вероятно, больные с избыточной массой тела не воспринимают учащение дыхания как одышку, поскольку учащение дыхания для данной категории больных является повседневным ощущением.
Выводы
Феномен «немая гипоксемия» может встречаться не только при поражениях легких, вызванных SARS-CoV-2-инфекцией, однако именно при COVID-ассоциированной пневмонии отсутствие жалоб пациентов на одышку объективизируется отсутствием тахипноэ. При оценке тяжести состояния больных важен комплексный клинико-функциональный анализ статуса пациента, в т. ч. определение насыщения артериальной крови кислородом, газового состава артериальной крови, а также измерение ЧД, оценка выраженности одышки и сопоставление этих данных между собой. Необходимы дальнейшие исследования феномена «немая гипоксемия» для лучшего понимания механизмов его формирования и клинической значимости.
Список литературы / References
Развернуть
- Caronna E, Ballvé A, Llauradó A, Gallardo VJ, Ariton DM, Lallana S et al. Headache: A striking prodromal and persistent symptom, predictive of COVID-19 clinical evolution. Cephalalgia. 2020;40(13):1410–1421. doi: 10.1177/0333102420965157.
- Bastidas-Goyes AR, Tuta-Quintero E, Aguilar MF, Mora AV, Aponte HC, Villamizar JM et al. Performance of oxygenation indices and risk scores to predict invasive mechanical ventilation and mortality in COVID-19. BMC Pulm Med. 2024;24(1):68. doi: 10.1186/s12890-023-02807-8.
- Georgieva E, Ananiev J, Yovchev Y, Arabadzhiev G, Abrashev H, Abrasheva D et al. COVID-19 Complications: Oxidative Stress, Inflammation, and Mitochondrial and Endothelial Dysfunction. Int J Mol Sci. 2023;24(19):14876. doi: 10.3390/ijms241914876.
- Avdeev SN. COVID-19: Opportunities to Improve Prognosis. Her Russ Acad Sci. 2022;92(4):404–411. doi: 10.1134/S1019331622040025.
- Mahmoodpor A, Gohari-Moghadam K, Rahimi-Bashar F, Khosh-Fetrat M, Vahedian-Azimi A. 1-year survival rate of SARS-CoV-2 infected patients with acute respiratory distress syndrome based on ventilator types: a multi-center study. Sci Rep. 2023;13(1):12644. doi: 10.1038/s41598-023-39992-9.
- Brixey AG, Oh AS, Alsamarraie A, Chung JH. Pictorial Review of Fibrotic Interstitial Lung Disease on High Resolution CT Scan and Updated Classification. Chest. 2024;S0012-3692(23)05829-4. doi: 10.1016/j.chest.2023.11.037.
- Churg A. Hypersensitivity pneumonitis: new concepts and classifications. Mod Pathol. 2022;35(1):15–27. doi: 10.1038/s41379-021-00866-y.
- Lynch DA. CT Phenotypes in Hypersensitivity Pneumonitis. Chest. 2019;155(4):655–656. doi: 10.1016/j.chest.2018.10.048.
- Авдеев СН, Царева НА, Мержоева ЗМ, Трушенко НВ, Ярошецкий АИ. Практические рекомендации по кислородотерапии и респираторной поддержке пациентов с COVID-19 на дореанимационном этапе. Пульмонология. 2020;30(2):151–163. doi: 10.18093/0869-0189-2020-30-2-151-163. / Avdeev SN, Tsareva NN, Merzhoeva ZM, Trushenko NV, Yaroshetskiy AI. Practical guidance for oxygen treatment and respiratory support of patients with COVID-19 infection before admission to intensive care unit. Pulmonologiya. 2020;30(2):151–163. (In Russ.) doi: 10.18093/0869-0189-2020-30-2-151-163.
- Фан ДВ, Неклюдова ГВ, Берикханов ЗГ, Авдеев СН. Гипоксемия без одышки при COVID-19. Медицинский совет. 2023;17(20):172–179. doi: 10.21518/ms2023-282. / Fan DV, Nekludova GV, Berikkhanov ZG, Avdeev SN. Hypoxemia without dyspnea in COVID-19. Meditsinskiy Sovet. 2023;17(20):172–179. (In Russ.) doi: 10.21518/ms2023-282.
- Swenson KE, Swenson ER. Pathophysiology of Acute Respiratory Distress Syndrome and COVID-19 Lung Injury. Crit Care Clin. 2021;37(4):749–776. doi: 10.1016/j.ccc.2021.05.003.
- Nouri-Vaskeh M, Sharifi A, Khalili N, Zand R, Sharifi A. Dyspneic and non-dyspneic (silent) hypoxemia in COVID-19: Possible neurological mechanism. Clin Neurol Neurosurg. 2020;198:106217. doi: 10.1016/j.clineuro.2020.106217.
- Алехин МН, Бартош-Зеленая СЮ, Берестень НФ, Бощенко АА, Врублевский АВ, Глазун ЛО и др. Стандартизация проведения трансторакальной эхокардиографии у взрослых: консенсус экспертов Российской ассоциации специалистов ультразвуковой диагностики в медицине (РАСУДМ) и Российской ассоциации специалистов функциональной диагностики (РАСФД). Ультразвуковая и функциональная диагностика. 2021;(2):63–79. doi: 10.24835/1607-0771-2021-2-63-79. / Alekhin MN, Bartosh-Zelenaya SY, Beresten NF, Bosh-chenko AA, Vrublevskiy AV, Glazun LO et al. Standardization of transthoracic echocardiography in adults: an expert consensus statement from the Russian Association of Specialists in Ultrasound Diagnostics in Medicine (RASUDM) and the Russian Association of Specialists in Functional Diagnostics (RASFD). Ultrasound and Functional Diagnostics. 2021;(2):63–79. (In Russ.) doi: 10.24835/1607-0771-2021-2-63-79.
- Visseren FLJ, Mach F, Smulders YM, Carballo D, Koskinas KC, Bäck M et al. ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J. 2021;42(34):3227–3337. doi: 10.1093/eurheartj/ehab484.
- Mitchell C, Rahko PS, Blauwet LA, Canaday B, Finstuen JA, Foster MC et al. Guidelines for Performing a Comprehensive Transthoracic Echocardiographic Examination in Adults: Recommendations from the American Society of Echocardiography. J Am Soc Echocardiogr. 2019;32(1):1–64. doi: 10.1016/j.echo.2018.06.004.
- Айсанов ЗР, Калманова ЕН, Каменева МЮ, Кирюхина ЛД, Лукина ОФ, Науменко ЖК и др. Рекомендации Российского респираторного общества по проведению функциональных исследований системы дыхания в период пандемии COVID-19. Версия 1.1 от 19.05.2020 г. Практическая пульмонология. 2020;(1):104–106. Режим доступа: http://www.atmosphere-ph.ru/. / Aisanov ZR, Kalmanova EN, Kameneva MYu, Kiryukhina LD, Lukina OF, Naumenko ZhK et al. Recommendations of the Russian Respiratory Society for conducting research results on the system for combating the COVID-19 pandemic. Version 1.1 from 05/19/2020. Prakticheskaya Pulʹmonologiya. 2020;(1):104–106. (In Russ.) Available at: http://www.atmosphere-ph.ru/.
- Davis MD, Walsh BK, Sittig SE, Restrepo RD. AARC clinical practice guideline: blood gas analysis and hemoximetry. Respir Care. 2013;58(10):1694–1703. doi: 10.4187/respcare.02786.
- Gattinoni L, Chiumello D, Caironi P, Busana M, Romitti F, Brazzi L et al. COVID-19 pneumonia: different respiratory treatments for different phenotypes? Intensive Care Med. 2020;46(6):1099–1102. doi: 10.1007/s00134-020-06033-2.
- Lai SY, Schafer JM, Meinke M, Beals T, Doff M, Grossestreuer A et al. Lung Ultrasound Score in COVID-19 Patients Correlates with PO2/FiO2, Intubation Rates, and Mortality. West J Emerg Med. 2024:25(1):28–39. doi: 10.5811/westjem.59975.
- Hall JE, Hall ME. Text book of medical physiology. 14th ed. Elsevier; 2020. 1152 p.
- Tobin MJ, Laghi F, Jubran A. Why COVID-19 Silent Hypoxemia Is Baffling to Physicians. Am J Respir Crit Care Med. 2020;202(3):356–360. doi: 10.1164/rccm.202006-2157CP.
- Jouffroy R, Jost D, Prunet B. Prehospital pulse oximetry: a red flag for early detection of silent hypoxemia in COVID-19 patients. Crit Care. 2020;24(1):313–314. doi: 10.1186/s13054-020-03036-9.
- Bickler PE, Feiner JR, Lipnick MS, Batchelder P, MacLeod DB, Severinghaus JW. Effects of Acute, Profound Hypoxia on Healthy Humans: Implications for Safety of Tests Evaluating Pulse Oximetry or Tissue Oximetry Performance. Anesth Analg. 2017;124(1):146–153. doi: 10.1213/ANE.0000000000001421.
- Jubran A, Tobin MJ. Effect of isocapnic hypoxia on variational activity of breathing. Am J Respir Crit Care Med. 2000;162(4 Pt 1):1202–1209. doi: 10.1164/ajrccm.162.4.9907003.
- Глыбочко ПВ, Фомин ВВ, Авдеев СН, Моисеев СВ, Яворовский АГ, Бровко МЮ и др. Клиническая характеристика 1007 больных тяжелой SARS-CoV-2 пневмонией, нуждавшихся в респираторной поддержке. Клиническая фармакология и терапия. 2020;29(2):21–29. doi: 10.32756/0869-5490-2020-2-21-29. / Glybochko PV, Fomin VV, Avdeev SN, Moiseev SV, Yavorovskiy AG, Brovko MYu et al. Clinical characteristics of 1007 intensive care unit patients with SARS-CoV-2 pneumonia. Clinical Pharmacology and Therapy. 2020;29(2):21–29. (In Russ.) doi: 10.32756/0869-5490-2020-2-21-29.
- Harper RM, Kumar R, Macey PM, Harper RK, Ogren JA. Impaired neural structure and function contributing to autonomic symptoms in congenital central hypoventilation syndrome. Front Neurosci. 2015;9:415. doi: 10.3389/fnins.2015.00415.








