
Журнал "Медицинский совет" №19/2024
DOI: 10.21518/ms2024-439
Г.А. Полев1,2, https://orcid.org/0000-0002-7175-6417,
Р.С. Оганесян1, https://orcid.org/0000-0002-1698-2956,
Е.Ю. Яременко1, https://orcid.org/0000-0003-1196-5070,
Н.С. Грачев1, https://orcid.org/0000-0002-4451-3233
1 Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева; 117997, Россия, Москва, ул. Саморы Машела, д. 1
2 Ильинская больница; 143421, Россия, Московская обл., Красногорск, д. Глухово, ул. Рублевское Предместье, д. 2, корп. 2
Введение. Дифференциальная диагностика шейной лимфаденопатии у детей, имеющих онкогематологические заболевания или иммунопатологические процессы в анамнезе, представляет значительную проблему в клинической практике врачей различных специальностей, что может привести к избыточному объему терапии. Статья освещает комплексный анализ данных дифференциальной ультразвуковой диагностики лимфаденопатии у пациентов данной группы.
Цель. Повысить качество дифференциальной диагностики шейной лимфаденопатии у детей, имеющих онкогематологические заболевания или иммунопатологические процессы в анамнезе.
Материалы и методы. В ходе ретроспективного исследования выполнен комплексный анализ клинико-демографических данных 217 пациентов с выявленной шейной лимфаденопатией и онкогематологическими заболеваниями или иммунопатологическими процессами в анамнезе, перенесших эксцизионную биопсию лимфатического узла (ЛУ) и/или лимфаденэктомию с 2017 по 2022 г. включительно. Пациенты были разделены на группу А (неопухолевая лимфаденопатия; n = 92) и группу Б (злокачественная лимфаденопатия; n = 125).
Результаты. В ходе исследования было выявлено, что переменные «Индекс конфигурации ЛУ ≤ 2» (повышение шанса наличия злокачественной лимфаденопатии в 4,4–5,1 раза), «Короткая ось ЛУ > 10 мм» (ОШ 2,5–2,8), «Наличие специфической терапии до удаления ЛУ» (ОШ 6,9–7,2), «Отсутствие дифференцировки ЛУ» (ОШ 2,2–2,4), «Наличие интранодулярных микрокальцинатов» (ОШ 14,1–16,3), «Усиление васкуляризации ЛУ» (ОШ 2,0–2,6), «Общая гипоэхогенность ЛУ» (ОШ 2,4), «Формирование конгломерата» (ОШ 3,6) являются значимыми предикторами и входят в состав двух разработанных прогностических моделей повышения вероятности наличия злокачественной лимфаденопатии. Информационная способность моделей составляет 81,1% (p < 0,001), чувствительность – 79,3 – 82,6%, специфичность – 80,0–82,4%. Отсутствуют статистически значимые различия качества данных моделей (Z = 0,247; 0,098).
Обсуждение. Проведенный комплексный анализ прогностических факторов наличия злокачественной лимфаденопатии у пациентов, имеющих в анамнезе онкогематологические или иммунологические заболевания, свидетельствует о том, что один выборочный фактор риска УЗ-диагностики не должен выступать в качестве дифференциальной диагностики, что находит подтверждение и в более ранних работах.
Выводы. Разработанные в ходе исследования прогностические модели повышения вероятности злокачественного поражения лимфоузлов шейного коллектора могут быть предложены для использования в клинической практике с целью стандартизации и повышения качества первичной дифференциальной диагностики шейной лимфаденопатии у детей с онкогематологическими заболеваниями или иммунопатологическими процессами в анамнезе.
Для цитирования: Полев ГА, Оганесян РС, Яременко ЕЮ, Грачев НС. Прогностические факторы наличия злокачественной лимфаденопатии в области шеи у детей: анализ 217 случаев. Медицинский Совет. 2024;(19):206-213. https://doi.org/10.21518/ms2024-439
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Predictors of Malignant Lymph Node Involvement in paediatric patients: Analysis of 217 Cases
Georgiy A. Polev1,2*, https://orcid.org/0000-0002-7175-6417
Nikolai S. Grachev1, https://orcid.org/0000-0002-4451-3233
Raisa S. Oganesyan1, https://orcid.org/0000-0002-1698-2956
Ekaterina Yu. Yaremenko1, https://orcid.org/0000-0003-1196-5070
1 Dmitry Rogachev National Medical Research Center for Children's Hematology, Oncology and Immunology; 1, Samora Mashel St., Moscow, 117997, Russia
2 Ilyinskaya Hospital; 2, Bldg. 2, Rublevskoe Predmestie St.,
Glukhovo Settlement, Krasnogorsk, 143421, Russia
Introduction. Diagnosing cervical lymphadenopathy in children with a history of oncological or immunopathological conditions is challenging, often resulting in overtreatment. This study analyses ultrasound-based differential diagnostics for lymphadenopathy in this patient group.
Aim. To improve diagnostic accuracy for cervical lymphadenopathy in children with a history of oncological or immunopathological conditions.
Materials and methods. A retrospective analysis was performed on clinical and demographic data from 217 paediatric patients diagnosed with cervical lymphadenopathy. These patients underwent excisional lymph node biopsy and/or lymphadenectomy between December 2017 and December 2022. The cohort was divided into Group A (benign lymphadenopathy; n = 92) and Group B (malignant lymphadenopathy; n = 125).
Results. Significant predictors of malignant lymphadenopathy were identified, including “Lymph Node Configuration Index ≤ 2” (increasing the odds by 4.4–5.1 times), “Short Axis of Lymph Node > 10 mm” (OR 2.5–2.8), “Specific Therapy Prior to Lymph Node Removal” (OR 6.9–7.2), “Absence of Lymph Node Differentiation” (OR 2.2–2.4), “Presence of Intranodal Microcalcifications” (OR 14.1–16.3), “Increased Vascularisation of the Lymph Node” (OR 2.0–2.6), “Overall Hypoechogenicity” (OR 2.4), and “Formation of Conglomerates” (OR 3.6). Predictive models integrating these factors demonstrated strong accuracy, with an informational capacity of 81.1% (p < 0.001), sensitivity between 79.3% and 82.6%, and specificity from 80.0% to 82.4%.
Discussion. The comprehensive analysis of predictive factors for malignant lymphadenopathy in patients with a history of oncological or immunopathological diseases suggests that no single ultrasound risk factor should be the sole basis for differential diagnosis, supporting earlier findings.
Conclusion. The predictive models provide a standardised, robust approach for assessing malignant lymph node involvement, improving diagnostic accuracy in paediatric patients with oncological or immunopathological histories.
For citation: Polev GA, Oganesyan RS, Yaremenko EY, Grachev NS. Predictors of Malignant Lymph Node Involvement in paediatric patients: Analysis of 217 Cases. Meditsinskiy sovet = Medical Council. 2024;(19):206-213. (In Russ.) https://doi.org/10.21518/ms2024-439
Conflict of interest: the authors declare no conflict of interest.
Введение
Увеличение шейных лимфатических узлов – частая жалоба в педиатрической популяции: порядка 62% случаев шейной лимфаденопатии отмечается у детей в возрасте от 3 нед. до 6 мес., 41% – у пациентов от 2 до 5 лет и до 90% у детей в возрасте 4–8 лет [1, 2], что, как правило, может быть объяснено возрастными изменениями объема лимфатической ткани и реактивной лимфаденопатией, обусловленной вирусными и/или бактериальными инфекциями [3]. Практически каждый врач-педиатр сталкивается с увеличенными лимфатическими узлами в области шеи [4]. Для педиатрической популяции наличие метастатического поражения лимфатических узлов шеи является редкостью, составляя от 2,2–2,7 до 4,69% всех случаев шейной лимфаденопатии [3, 5–7]. Однако в условиях референс-центров данный показатель значительно возрастает вместе с онкологической настороженностью специалистов [7–9]. Так, наличие шейной лимфаденопатии (ЛАП) у пациента со злокачественной солидной опухолью, наблюдающегося по месту жительства или проходящего специфическую терапию в условиях референс-центра, несопоставимо с лимфаденопатией у пациента в отсутствие онкогематологического заболевания или иммунопатологического процесса. Все более широкое распространение имеют различные регрессионные модели данных МСКТ, ПЭТ/КТ, МРТ, УЗД, построенные на основе машинного обучения [10–15]. Несмотря на дискутабельную роль ультразвукового исследования в дифференциальной диагностике измененных лимфатических узлов, результаты ультразвуковой диагностики (УЗД) включаются в регрессионную модель машинного обучения и прогностические модели дифференциальной диагностики лимфаденопатии [16, 17]. При этом такие основополагающие параметры, как размер, форма, кровоснабжение и архитектоника измененного лимфатического узла, а также наличие кальцинатов и конгломератов и их соотношение не являются стандартизированными в педиатрической популяции. Это значительно затрудняет не только дальнейшее развитие методов диагностики, но и клиническую практику врача-педиатра, детского хирурга и детского онколога.
Цель – повысить качество дифференциальной диагностики шейной лимфаденопатии у детей, имеющих онкогематологические заболевания или иммунопатологические процессы в анамнезе.
Материалы и методы
В данной статье представлены результаты ретроспективного выборочного исследования с количественной методологией описания данных с неслучайным методом включения пациентов. В исследование включено 217 пациентов (от 1 мес. до 17 лет), перенесших эксцизионную биопсию лимфатического узла в области шеи и/или лимфаденэктомию в условиях ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева в период с декабря 2017 г. по декабрь 2022 г. включительно (5 лет). При отборе участников исследования в качестве критериев включения выступали: возраст пациента < 18 лет на момент госпитализации в указанный период; наличие шейной лимфаденопатии; патоморфологически верифицированная природа лимфаденопатии. В качестве критерия невключения принимали отсутствие эксцизионной биопсии или лимфаденэктомии пораженных лимфатических узлов (ЛУ) шейного коллектора, а также поражение заушных или затылочных лимфатических узлов. В случае отсутствия ключевой информации, такой как данные ультразвуковой диагностики лимфатических узлов шеи, необходимой для анализа прогностических факторов наличия злокачественной лимфаденопатии, пациент исключался из исследования.
В ходе исследования были проанализированы такие данные, как демографические (возраст пациента на момент хирургического вмешательства, пол пациента, диагноз основного заболевания), клинические (наличие специфической терапии, предшествующей изучаемому хирургическому вмешательству, объем операции, данные ультразвуковой диагностики, данные патоморфологического исследования операционного материала, наличие периоперационных осложнений). В качестве злокачественного поражения ЛУ выделяли: лимфопролиферативное поражение лимфатических узлов (лимфома Ходжкина и неходжкинские лимфомы), а также метастатическое поражение ЛУ при наличии злокачественного солидного образования головы и шеи или иной локализации. В качестве неопухолевой лимфаденопатии (ЛАП) рассматривали реактивную гиперплазию ЛУ, гранулематозный лимфаденит, некротизирующий гранулематозный лимфаденит, флоридную (фолликулярную) гиперплазию ткани лимфатического узла, некротизирующий лимфаденит.
Согласно дизайну исследования пациенты были разделены на группу А (неопухолевая лимфаденопатия) и группу Б (злокачественная лимфаденопатия).
Статистический анализ
Объем выборочной совокупности определялся с помощью EVP-критерия. Во всех случаях проводилась комплексная проверка соблюдения необходимых условий применения статистических критериев. За традиционный уровень значимости исследования было принято значение 0,05, по показаниям применялся критерий Манна – Уитни, критерий χ2 Пирсона с поправкой на правдоподобие, одно- и многофакторный логистический регрессионный анализ, ROC-анализ, одно- и многофакторный линейный регрессионный анализ. Применялся статистический пакет IBM SPSS Statistics 26.
Результаты
С декабря 2017 г. по декабрь 2022 г. 264 пациента перенесли эксцизионную биопсию шеи и/или лимфаденэктомию. На этапе отбора пациентов в исследование не были включены 19 пациентов с поражением затылочных или заушных лимфатических узлов; были исключены 28 пациентов ввиду отсутствия ключевой информации, необходимой для оценки прогностической ценности факторов риска наличия злокачественной лимфаденопатии. Так, объем изучаемой выборочной совокупности составил 217 пациентов (105 мальчиков и 112 девочек) в возрасте от 1 мес. до 17 лет, перенесших эксцизионную биопсию или шейную лимфаденэктомию (I–VI уровней удаляемых ЛУ, а также надключичных ЛУ). В группу А (неопухолевая ЛАП) было включено 92 пациента, в то время как в группу Б (злокачественная лимфаденопатия) было включено 125 пациентов. Медиана (Q1; Q3) возраста пациентов на момент хирургического вмешательства составила 11,2 (4,8; 15,2) лет. Возраст пациентов с выявленной опухолевой лимфаденопатией оказался выше, чем у пациентов с неопухолевой ЛАП (U = 4177,500; p = 0,001), что может быть объяснено высокой долей выявленного метастатического поражения шейных лимфатических узлов при злокачественном новообразовании (ЗНО) щитовидной железы (33/37; 89,2%) преимущественно у пациентов 15–16 лет (табл. 1). Нозологические формы поражения лимфатических узлов представлены на рис. 1.
Рисунок 1. Нозологические формы поражения лимфатических узлов шеи
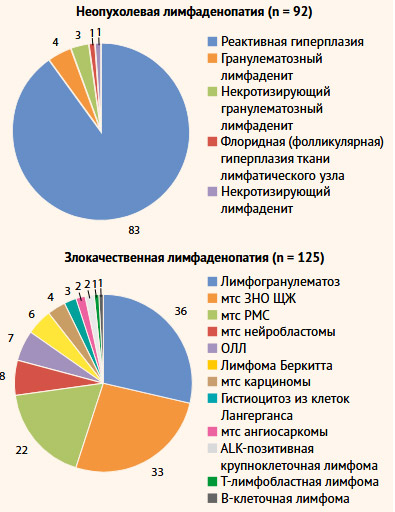
мтс – метастазы; ЗНО ЩЖ – злокачественное новообразование щитовидной железы;
ОЛЛ – острый лимфобластный лейкоз
При наличии злокачественного основного заболевания, установленного до проведения рассматриваемого хирургического вмешательства, статистически значимо чаще были удалены лимфатические узлы с опухолевым поражением (группа Б): 122 против 48 пациентов (χ2 (1) = 71,119; p < 0,001). Специфическая терапия (полихимиотерапия и/или лучевая терапия) была проведена в 62 (28,6%) случаях. В качестве наиболее подозрительных лимфоузлов значимо чаще описаны переднешейные (IIA-III, IV, VI уровни); подозрительные относительно опухолевого поражения подчелюстные (IA-IB) лимфоузлы чаще оказывались неопухолевым поражением (32,6% против 18,4%; χ2 (3) = 13,107; p = 0,004). Более подробно с клинико-демографическими данными пациентов можно ознакомиться в табл. 1.
Таблица 1. Результаты анализа клинико-демографических данных пациентов с шейной лимфаденопатией
| Изучаемый признак | Выборочная совокупность |
Группа
А (n=92) |
Группа
Б (n=125) |
Результаты статистического анализа | ||
| Возраст на момент операции, лет Me (Q1; Q3; min-max) | 11,2 (4,8; 15,2; 0,5; 17,9) | 8,5 (3,7; 13,2; 0,5; 17,9) | 12,8 (6,3; 16,1; 0,6; 17,9) |
U = 4177,500; p = 0,001 |
||
| Гендерное соотношение, n (%) | М | 105 (48,4) | 41 | 64 |
χ2 (1) = 0,935; p = 0,333 |
|
| Ж | 112 (51,6) | 51 | 61 | |||
| Основное заболевание на момент операции, n (%) | Доброкачественное, неопределенного или неизвестного характера или иммунодефицитные нарушения | 47 (21,7) | 44 (47,8) | 3 (2,4) |
χ2 (1) = 71,119; p < 0,001 |
|
| Злокачественное | 170 (78,3) | 48 (52,2) | 122 (97,6) | |||
| Наличие специфической терапии по основному заболеванию, n (%) | 62 (28,6) | 14 (15,2) | 48 (38,4) |
χ2 (1) = 14,683; p < 0,001 |
||
| Объем операции, n (%) | Биопсия | 153 (70,5) | 76 (82,6) | 77 (61,6) |
χ2
(2)
= 15,235; p < 0,001 |
|
| Лимфодиссекция | 54 (24,9) | 11 (12,0) | 43 (34,4) | |||
| Биопсия + лимфодиссекция | 10 (4,6) | 5 (5,4) | 5 (4,0) | |||
| Локализация наиболее подозрительного описанного ЛУ, n (%) | Подчелюстные (IA-IB) | 53 (24,4) | 30 (32,6) | 23 (18,4) |
χ2 (3) = 13,107;
p = 0,004 |
|
| Переднешейные (IIA-III, IV, VI) | 138 (63,6) | 55 (59,8) | 83 (66,4) | |||
| Заднешейные (VA-VB) | 6 (2,8) | 4 (4,3) | 2 (1,6) | |||
| Надключичные | 20 (9,2) | 3 (3,3) | 17 (13,6) | |||
| Примечание. Группа А – неопухолевая лимфаденопатия, группа Б – злокачественная лимфаденопатия. | ||||||
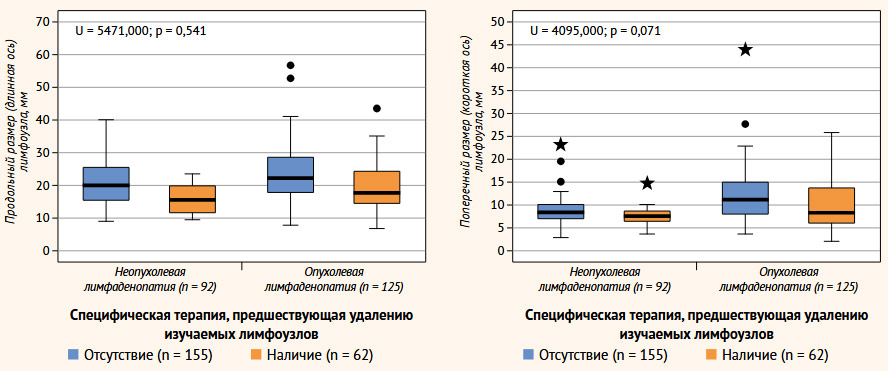
Согласно данным, продольный размер наиболее подозрительных лимфатических узлов не зависел от наличия или отсутствия опухолевого поражения (U = 5471,500; p = 0,541), в то время как короткая ось оказалась статистически значимо выше в группе злокачественной лимфаденопатии (U = 4248,500; p = 0,001) (табл. 2, рис. 2). Короткая ось лимфоузла ≥ 10 мм статистически значимо чаще отмечалась при злокачественной ЛАП (χ2 (1) = 33,618; p < 0,001). Важно отметить, что при дополнительно проведенном анализе размеров подчелюстных лимфатических узлов (IA-IB уровни), короткая ось ≥ 15 мм была выявлена только в 5 (2,3%) случаях; медиана короткой оси составила 7,2 мм (6,0; 9,6), что в совокупности исключает целесообразность применения отдельного параметра «короткая ось ≥ 15 мм» при оценке подчелюстных лимфатических узлов. Важно отметить, что при наличии специфической терапии, предшествующей удалению изучаемых лимфоузлов, отмечалось значимое сокращение продольного (длинная ось) размера лимфатических узлов (U = 4095,000; p = 0,071), при этом отсутствовали статистически значимые различия (U = 4095,000; p = 0,071) поперечного размера (короткая ось) удаляемых ЛУ (табл. 2). Так, индексы конфигурации ≤ 2 (или ≥ 0,5), а также ≤ 1,5 статистически и клинически значимо чаще отмечались при злокачественном поражении лимфатических узлов. При этом индекс Solbiati был отмечен в более половины 74 (59,2%) случаев злокачественной лимфаденопатии (χ2 (1) = 51,148; p < 0,001).
Если говорить об иных ультразвуковых характеристиках злокачественной лимфаденопатии, то преимущественно отмечалось нарушение (64/125; 51,2%) или полное отсутствие (34/125; 27,2%) дифференцировки изучаемых лимфатических узлов (χ2 (2) = 37,480; p < 0,001). Общая эхогенность ЛУ при невыраженном срединном эхо была преимущественно гипоэхогенной (χ2 (2) = 21,321; p < 0,001).
В подавляющем большинстве случаев (122/217; 56,2%) отмечалась усиленная васкуляризация пораженного лимфоузла; большая часть случаев приходится на злокачественное поражение ЛУ (87/125; 69,6%; χ2 (2) = 30,199; p < 0,001).
Наличие интранодальных микрокальцинатов (26/125; 20,8%; χ2 (1) = 24,175; p < 0,001) и образование конгломератов (16/125; 12,8%; χ2 (1) = 4,915; p = 0,027) лимфатических узлов значимо чаще встречалось при злокачественной лимфаденопатии. При этом микрокальцинаты преимущественно были характерны для метастатического поражения ЛУ ЗНО щитовидной железы, в то время как формирование конгломерата не было нозология-специфичным.
Таблица 2. Результаты сравнительного анализа УЗ-данных наиболее подозрительных лимфоузлов в зависимости от природы лимфаденопатии
| Изучаемый признак | Выборочная совокупность | Группа А (n = 92) | Группа Б (n = 125) | Результаты статистического анализа | |
| Максимальный размер удаляемого лимфатического узла по данным УЗ-диагностики (длинная ось), мм Me (Q1; Q3; min-max) | 20,0 (15,0; 26,0; 7,0; 109,0) | 20,0 (15,3; 25,0; 9,3; 40,0) | 21,0 (15,0; 27,5; 7,0; 109,0) | U = 5471,000; p = 0,541 | |
| Максимальный размер удаляемого лимфатического узла по данным УЗ-диагностики (короткая ось), мм Me (Q1; Q3; min-max) | 9,0 (7,0; 13,0; 0,5; 44,0) | 8,0 (7,0; 10,0; 0,5; 23,0) |
10,0 (7,0; 15,0; 2,6; 44,0) |
U = 4248,500; p = 0,001 | |
| Короткая ось лимфоузла ≥ 10 мм, n (%) | 85 39,2% | 16 17,4% | 69 55,2% |
χ2 (1) = 33,618; p < 0,001 |
|
| Индекс конфигурации2 лимфатического узла | ≤2,0 | 86 (39,6) | 12 (13,0) | 74 (59,2) |
χ2 (1) = 51,148; p < 0,001 |
| ≤1,5 | 34 (15,7) | 4 (4,3) | 30 (24,0) |
χ2 (1) = 17,734; p < 0,001 |
|
| Дифференциация составных частей ЛУ, n (%) | Сохранена | 76 (35,0) | 49 (53,3) | 26 (20,8) |
χ2 (2) = 43,649; p < 0,001 |
| Нарушена | 104 (47,9) | 40 (43,5) | 59 (47,2) | ||
| Отсутствует | 37 (17,1) | 3 (3,3) | 40 (32,0) | ||
| Общая эхогенность узла при невыраженном срединном эхо, n (%) | Гиперэхогенный | 10 (4,6) | 2 (2,2) | 8 (6,4) |
χ2 (2) = 21,321; p < 0,001 |
| Гипоэхогенный | 118 (54,4) | 36 (39,1) | 82 (65,6) | ||
| Изоэхогенный | 89 (41,0) | 54 (58,7) | 35 (28,0) | ||
| Васкуляризация лимфоузла, n (%) | Норма | 87 (40,1) | 56 (60,9) | 31 (24,8) |
χ2 (2) = 30,199; p < 0,001 |
| Усиление кровотока | 122 (56,2) | 35 (38,0) | 87 (69,6) | ||
| Снижение кровотока | 8 (3,7) | 1 (1,1) | 7 (5,6) | ||
| Наличие микрокальцинатов, n (%) | 27 (12,4) | 1 (1,1) | 26 (20,8) |
χ2 (1) = 24,175; p < 0,001 |
|
| Наличие конгломерата лимфоузлов, n (%) | 20 (9,2) | 4 (4,3) | 16 (12,8) |
χ2 (1) = 4,915; p = 0,027 |
|
| Примечание. Группа А – неопухолевая лимфаденопатия, группа Б – злокачественная лимфаденопатия, индекс конфигурации (Solbiati) – соотношение продольного и поперечного размеров лимфоузла (длинная ось / короткая ось) в норме составляет более 2, более округлая форма характерна для опухолевого поражения лимфатических узлов. Также имеет место индекс конфигурации, при котором рассматривают соотношение короткой и длинной осей, при котором в норме индекс составляет менее 0,5 | |||||
Рисунок 2. Влияние наличия специфической терапии на продольный и поперечный размеры удаляемых лимфатических узлов
С целью объективизации анализа дифференциальной диагностики шейной лимфаденопатии у детей был выполнен поиск прогностических факторов повышения шанса злокачественного поражения лимфатических узлов и выявления дополнительно вмешивающихся факторов, влияющих на факторы риска и переменную исхода (конфаундеров). Наиболее значимые прогностические модели наличия злокачественной лимфаденопатии представлены в табл. 3.
Таблица 3. Наиболее значимые прогностические модели повышения шанса обнаружения злокачественной шейной лимфаденопатии у детей
| Изучаемые переменные | B(SE)* | Exp(B)** | 95% ДИ для Exp(B) | p | |
| нижний | верхний | ||||
| Модель 1 | |||||
| Константа | -2,060(0,366) | 0,127 | - | - | 0,001 |
| Индекс конфигурации ≤ 2 | 1,487 (0,440) | 4,423 | 1,866 | 10,485 | 0,001 |
| Короткая ось ЛУ > 10 мм | 0,920 (0,461) | 2,509 | 1,017 | 6,188 | 0,046 |
| Наличие специфической терапии до удаления ЛУ | 1,969 (0,450) | 7,162 | 2,968 | 17,284 | <0,001 |
| Усиление васкуляризации ЛУ | 0,935 (0,389) | 2,548 | 1,189 | 5,457 | 0,016 |
| Отсутствие дифференцировки ЛУ | 0,888 (0,366) | 2,430 | 1,186 | 4,981 | 0,015 |
| Наличие интранодулярных микрокальцинатов | 2,793 (1,081) | 16,333 | 1,964 | 135,816 | 0,010 |
| Формирование конгломерата | 1,285 (0,717) | 3,615 | 1,866 | 14,750 | 0,073 |
| Модель 2 | |||||
| Константа | -2,269(0,398) | - | - | <0,001 | |
| Индекс конфигурации ≤ 2 | 1,631 (0,460) | 5,109 | 2,075 | 12,580 | <0,001 |
| Короткая ось ЛУ > 10 мм | 1,020 (0,456) | 2,774 | 1,136 | 6,777 | 0,025 |
| Наличие специфической терапии до удаления ЛУ | 1,925 (0,451) | 6,854 | 2,834 | 16,579 | <0,001 |
| Усиление васкуляризации ЛУ | 0,669 (0,399) | 1,953 | ,893 | 4,270 | 0,094 |
| Отсутствие дифференцировки ЛУ | 0,798 (0,365) | 2,221 | 1,087 | 4,538 | 0,029 |
| Наличие интранодулярных микрокальцинатов | 2,645 (1,078) | 14,082 | 1,702 | 116,522 | 0,014 |
| Общая гипоэхогенность ЛУ | 0,861 (0,405) | 2,367 | 1,070 | 5,236 | 0,033 |
|
*Коэффициент регрессии с
достигнутым уровнем статистической значимости по результатам множественного
логистического регрессионного анализа и ошибка коэффициента регрессии. **
Коэффициент Exp(B) или ОШ показывает, во сколько раз изменяются шансы
возникновения изучаемого события (в данном случае – наличие злокачественной
лимфаденопатии). Примечание. Модель 1: R2 = 0,627 (Hosmer & Lemeshow), 0,409 (Cox & Snell), 0,549 (Nagelkerke); Хи-квадрат модели 113,985; р < 0,001. Метод ввода переменных – Backward LR; модель 2: R2 = 0,637 (Hosmer & Lemeshow), 0,412 (Cox & Snell), 0,553 (Nagelkerke); Хи-квадрат модели 115,186; р < 0,001. Метод ввода переменных – Backward LR. |
|||||
Согласно данным, представленным в табл. 3, переменные «Индекс конфигурации ≤ 2», «Короткая ось ЛУ > 10 мм», «Наличие специфической терапии до удаления ЛУ», «Отсутствие дифференцировки ЛУ», «Наличие интранодулярных микрокальцинатов» и «Общая гипоэхогенность ЛУ» являются клинически и статистически значимыми прогностическими факторами повышения вероятности наличия злокачественной лимфаденопатии в 2,4–16,3 раза. Переменная «Формирование конгломерата», несмотря на отсутствие статистической значимости, обусловленной относительно малым количеством представленных случаев формирования конгломерата ЛУ, является значимым конфаундером. Статистическая значимость переменной «Усиление васкуляризации ЛУ» зависит от состава представленной прогностической модели: значимость данной переменной снижается при добавлении в модель переменной «Общая гипоэхогенность ЛУ». Данные модели способны объяснить более половины случаев вариабельности дифференциальной диагностики злокачественной лимфаденопатии, если бы они были построены на данных всей популяции, из которой была извлечена изучаемая выборочная совокупность, что отражает высокую репрезентативность моделей. Информационная способность моделей 1 и 2 с целью прогнозирования наличия злокачественной лимфаденопатии составляет 81,1% (p < 0,001). Чувствительность модели 1 незначительно превышает данный параметр для модели 2 (82,6% против 79,3% соответственно), специфичность модели 1, напротив, несколько ниже (80,0% против 82,4%). Площадь под кривой модели 1 составляет 0,813 (SE 0,031; 95% ДИ 0,753; 0,874; p < 0,001), модели 2 – 0,809 (SE 0,031; 95% ДИ 0,747; 0,870; p < 0,001), отсутствуют статистически значимые различия качества данных моделей (Z = 0,247; 0,098). Это свидетельствует о том, что обе модели могут быть рекомендованы для использования в клинической практике лечебных учреждений.
При анализе послеоперационных осложнений было выявлено 8 (3,7%) случаев наличия осложнений, классифицированных как I стадия Клавьен – Диндо: 5/217 (2,3%) случаев гематомы, 1/217 (0,5%) случай транзиторной презентации синдрома Горнера, развившегося после постановки центрального венозного катетера, 1/217 (0,5%) случай жалоб пациента на головную боль при вертикализации и 1/217 (0,5%) случай субфебрильной лихорадки неинфекционного генеза. Это свидетельствует о высокой безопасности выполнения эксцизионной биопсии и/или шейной лимфаденэктомии в условиях специализированного лечебного учреждения.
Обсуждение
Проведенный комплексный анализ прогностических факторов наличия злокачественной лимфаденопатии у пациентов, имеющих в анамнезе онкогематологические или иммунологические заболевания, свидетельствует о том, что один выборочный фактор риска УЗ-диагностики не должен выступать в качестве дифференциальной диагностики, что находит подтверждение и в более ранних работах [18]. Так, в ходе исследования были разработаны и предложены к применению в клинической практике прогностические модели наличия злокачественного поражения лимфатических узлов шеи у детей.
Продольный размер, выявленный по данным УЗД, не должен служить определяющим фактором риска наличия злокачественной лимфаденопатии. Согласно полученным данным, короткая ось обладает меньшей изменчивостью относительно наличия или отсутствия специфической терапии, что требует дополнительного изучения с учетом нозологии лимфаденопатии [19, 20]. При достижении поперечного размера более 10 мм короткая ось служит значимым предиктором наличия злокачественного поражения лимфоузла [21].
Значимым предиктором наличия злокачественного поражения является округлая форма лимфатического узла. Существуют различные индексы конфигурации злокачественно пораженных лимфатических узлов [22–27]. Для изучаемой нами выборочной совокупности для опухолевого поражения ЛУ был характерен индекс конфигурации «длинная ось/короткая ось ≤ 2» или «короткая ось/длинная ось ≥ 0,5».
Нарушенная или полностью отсутствующая дифференциация лимфоузла на составные части также является значимым предиктором злокачественного поражения ЛУ. Согласно данным M. Paddock et al., до 90% неопухолевых лимфатических узлов > 5 мм (короткая ось) имеют эхогенный хилус, в то время как порядка 4% метастатических пораженных лимфоузлов демонстрируют эхогенные ворота ЛУ [18]. Данная тенденция находит подтверждение в изучаемой выборочной совокупности.
При злокачественной лимфаденопатии, как правило, определяется общая гипоэхогенность лимфоузлов в 62,5% и более случаев [28]. Так, данный параметр не может приниматься за дифференциальный признак в отсутствие иных факторов [29,30].
Васкуляризация лимфоузлов в области шеи при злокачественном их поражении, как правило, повышена. Для лимфомы типично значительное усиление кровоснабжения, особенно в области ворот, менее выраженное в периферических отделах [31]. Также для ряда лимфом характерна высокая плотность микрососудов, ассоциированная с неблагоприятным прогнозом; для вторичного метастатического поражения солидной опухоли характерен смешанный кровоток или периферическое его усиление [31, 32].
Дополнительные включения в структуре лимфоузла: наличие интранодулярных микрокальцинатов встречается сравнительно редко и характерно для вторичного поражения лимфатических узлов шеи метастазами ЗНО щитовидной железы (преимущественно при папиллярном раке ЩЖ), а также микрокальцинаты могут быть обнаружены после перенесенной специфической терапии (полихимиотерапии и/или дистанционной лучевой терапии) [18].
Ввиду относительно малой частоты встречаемости в изучаемой выборочной совокупности наличия переменной «формирование конгломерата» (20/217; 9,2%), данный предиктор требует дополнительного изучения, но может быть использован в качестве значимого конфаундера.
Выводы
На основе комплексного анализа предикторов наличия злокачественной шейной лимфаденопатии были разработаны прогностические модели повышения вероятности наличия злокачественного поражения лимфоузлов шейного коллектора у детей с наличием онкогематологических заболеваний или иммунопатологических процессов, которые могут быть использованы для стандартизации дифференциальной диагностики лимфаденопатии.
Список литературы / References
Развернуть
- Park YW. Evaluation of neck masses in children. Am Fam Physician. 1995;51(8):1904-1912. Available at: https://pubmed.ncbi.nlm.nih.gov/7762481.
- Weinstock MS, Patel NA, Smith LP. Pediatric Cervical Lymphadenopathy. Pediatr Rev. 2018;39(9):433-443. https://doi.org/10.1542/pir.2017-0249.
- Sarsu SB, Sahin K. A retrospective evaluation of lymphadenopathy in children in a single center’s experience. J Pak Med Assoc. 2016;66(6):654-657. Available at: https://pubmed.ncbi.nlm.nih.gov/27339563.
- Herzog LW. Prevalence of lymphadenopathy of the head and neck in infants and children. Clin Pediatr. 1983;22(7):485-487. https://doi.org/10.1177/000992288302200703.
- Berce V, Rataj N, Dorič M, Zorko A, Kolarič T. Association between the Clinical, Laboratory and Ultrasound Characteristics and the Etiology of Peripheral Lymphadenopathy in Children. Child. 2023;10(10):1589. https://doi.org/10.3390/children10101589.
- Bozlak S, Varkal MA, Yildiz I, Toprak S, Karaman S, Erol OB et al. Cervical lymphadenopathies in children: A prospective clinical cohort study. Int J Pediatr Otorhinolaryngol. 2016;82:81-87. https://doi.org/10.1016/j.ijporl.2016.01.002.
- Deosthali A, Donches K, DelVecchio M, Aronoff S. Etiologies of Pediatric Cervical Lymphadenopathy: A Systematic Review of 2687 Subjects. Glob Pediatr Heal. 2019;6:2333794X19865440. https://doi.org/10.1177/2333794X19865440.
- Celenk F, Gulsen S, Baysal E, Aytac I, Kul S, Kanlikama M. Predictive factors for malignancy in patients with persistent cervical lymphadenopathy. Eur Arch Otorhinolaryngol. 2016;273(1):251-256. https://doi.org/10.1007/s00405-015-3717-3.
- Sgro JM, Campisi ES, Selvam S, Greer MC, Alexander S, Ngan B, Campisi P. Cervical lymph node biopsies in the evaluation of children with suspected lymphoproliferative disorders: Experience in a tertiary pediatric setting. J Pediatr Surg. 2022;57(8):1525-1531. https://doi.org/10.1016/j.jpedsurg.2021.08.024.
- Zhang W, Peng J, Zhao S, Wu W, Yang J, Ye J, Xu S. Deep learning combined with radiomics for the classification of enlarged cervical lymph nodes. J Cancer Res Clin Oncol. 2022;148(10):2773-2780. https://doi.org/10.1007/s00432-022-04047-5.
- Yang Y, Zheng B, Li Y, Li Y, Ma X. Computer-aided diagnostic models to classify lymph node metastasis and lymphoma involvement in enlarged cervical lymph nodes using PET/CT. Med Phys. 2023;50(1):152-162. https://doi.org/10.1002/mp.15901.
- Wang T, Yan D, Liu Z, Xiao L, Liang C, Xin H et al. Diagnosis of cervical lymph node metastasis with thyroid carcinoma by deep learning application to CT images. Front Oncol. 2023;13:1099104. https://doi.org/10.3389/fonc.2023.1099104.
- Li S, Wei X, Wang L, Zhang G, Jiang L, Zhou X, Huang Q. Dual-source dual-energy CT and deep learning for equivocal lymph nodes on CT images for thyroid cancer. Eur Radiol. 2024;34(12):7567-7579. https://doi.org/10.1007/s00330-024-10854-w.
- Lee JH, Ha EJ, Kim D, Jung YJ, Heo S, Jang YH et al. Application of deep learning to the diagnosis of cervical lymph node metastasis from thyroid cancer with CT: external validation and clinical utility for resident training. Eur Radiol. 2020;30(6):3066-3072. https://doi.org/10.1007/s00330-019-06652-4.
- Zhang D, Jiang F, Yin R, Wu GG, Wei Q, Cui XW et al. A Review of the Role of the S-Detect Computer-Aided Diagnostic Ultrasound System in the Evaluation of Benign and Malignant Breast and Thyroid Masses. Med Sci Monit: Int Med J Exp Clin Res. 2021;27:e931957. https://doi.org/10.12659/MSM.931957.
- Zijtregtop EAM, Winterswijk LA, Beishuizen TPA, Zwaan CM, Nievelstein RAJ, Meyer-Wentrup FAG, Beishuizen A. Machine Learning Logistic Regression Model for Early Decision Making in Referral of Children with Cervical Lymphadenopathy Suspected of Lymphoma. Cancers. 2023;15(4):1178. https://doi.org/10.3390/cancers15041178.
- Cai D, Wu S. Efficacy of logistic regression model based on multiparametric ultrasound in assessment of cervical lymphadenopathy - a retrospective study. Dentomaxillofac Radiol. 2022;51(2):20210308. https://doi.org/10.1259/dmfr.20210308.
- Paddock M, Ruffle A, Beattie G, Prasai A, Jeanes A. Do otherwise well, healthy children with palpable cervical lymph nodes require investigation with neck ultrasound? Arch Dis Child. 2020;105(10):1012-1016. https://doi.org/10.1136/archdischild-2020-319648.
- Burkhard-Meier A, Jurinovic V, Berclaz LM, Albertsmeier M, Dürr HR, Klein A et al. Differentiation of benign and metastatic lymph nodes in soft tissue sarcoma. Clin Exp Metastasis. 2024;41(2):131-141. https://doi.org/10.1007/s10585-024-10273-7.
- Alamdaran SA, Randian A, Rasoulian B, Jafarian AH, Aminzadeh B, Niroumand S. Correlation of Sonographic Classification of Neck Adenopathy (A-RADS) and Malignancy. Iran J Otorhinolaryngol. 2023;35(126):39-47. https://doi.org/10.22038/IJORL.2022.67255.3299.
- Spijkers S, Littooij AS, Nievelstein RAJ. Measurements of cervical lymph nodes in children on computed tomography. Pediatr Radiol. 2020;50(4):534-542. https://doi.org/10.1007/s00247-019-04595-y.
- Krišto B, Buljan M. The lymph node roundness index in the evaluation of lymph nodes of the neck. Coll Antropol. 2015;39(1):165-169. https://pubmed.ncbi.nlm.nih.gov/26040085.
- Steinkamp HJ, Cornehl M, Hosten N, Pegios W, Vogl T, Felix R. Cervical lymphadenopathy: ratio of longto short-axis diameter as a predictor of malignancy. Br J Radiol. 1995;68(807):266-270. https://doi.org/10.1259/0007-1285-68-807-266.
- Ni X, Xu S, Zhan W, Zhou W. Ultrasonographic features of cervical lymph node metastases from medullary thyroid cancer: a retrospective study. BMC Med Imaging. 2022;22(1):151. https://doi.org/10.1186/s12880-022-00882-7.
- Rohan K, Ramesh A, Sureshkumar S, Vijayakumar C, Abdulbasith KM, Krishnaraj B. Evaluation of B-Mode and Color Doppler Ultrasound in the Diagnosis of Malignant Cervical Lymphadenopathy. Cureus. 2020;12(8):e9819. https://doi.org/10.7759/cureus.9819.
- Locke R, Comfort R, Kubba H. When does an enlarged cervical lymph node in a child need excision? A systematic review. Int J Pediatr Otorhinolaryngol. 2014;78(3):393-401. https://doi.org/10.1016/j.ijporl.2013.12.011.
- Delantoni A, Sarafopoulos A. Sonographic Anatomy and Pathology: Cervical Lymph Nodes. In: Orhan K (ed.). Ultrasonography in Dentomaxillofacial Diagnostics. Springer International Publishing; 2021, pp. 77-87. https://doi.org/10.1007/978-3-030-62179-7_6.
- Pandey A, Kureel SN, Pandey J, Wakhlu A, Rawat J, Singh TB. Chronic cervical lymphadenopathy in children: Role of ultrasonography. J Indian Assoc Pediatr Surg. 2012;17(2):58-62. https://doi.org/10.4103/0971-9261.93963.
- Białek EJ, Jakubowski W. Mistakes in ultrasound diagnosis of superficial lymph nodes. J Ultrason. 2017;17(68):59-65. https://doi.org/10.15557/JoU.2017.0008.
- Jia W, Cai Y, Wang S, Wang J. Predictive value of an ultrasound-based radiomics model for central lymph node metastasis of papillary thyroid carcinoma. Int J Med Sci. 2024;21(9):1701-1709. https://doi.org/10.7150/ijms.95022.
- Cardesa-Salzmann TM, Colomo L, Gutierrez G, Chan WC, Weisenburger D, Climent F et al. High microvessel density determines a poor outcome in patients with diffuse large B-cell lymphoma treated with rituximab plus chemotherapy. Haematologica. 2011;96(7):996-1001. https://doi.org/10.3324/haematol.2010.037408.
- Şen HS, Ocak S, Yılmazbaş P. Children with cervical lymphadenopathy: reactive or not? Turk J Pediatr. 2021;63(3):363-371. https://doi.org/10.24953/turkjped.2021.03.003.








