
Журнал "Медицинский совет" №1/2025
DOI: 10.21518/ms2025-047
И.А. Лисица, https://orcid.org/0000-0003-3501-9660, В.Л. Грицинская, https://orcid.org/0000-0002-8290-8674, А.Н. Завьялова, https://orcid.org/0000-0002-9532-9698, Ю.С. Александрович, https://orcid.org/0000-0002-2131-4813, О.В. Лисовский, https://orcid.org/0000-0002-1749-169X
Санкт-Петербургский государственный педиатрический медицинский университет; 194100, Россия, Санкт-Петербург, Литовская ул., д. 2
Неполноценное количественное и/или компонентное питание детей остается актуальной проблемой во всем мире. Генеральной Ассамблеей ООН сформулированы «Глобальные основы мониторинга в области питания», в результате проведения которых уровень острой нутритивной недостаточности в общей детской популяции должен снизиться до 5% к 2025 г. На основании научных публикаций по электронным базам PubMed, EMBASE, Cochrane Library, eLibrary. ru проведен систематический анализ. Полученные данные показали, что в странах с развитой экономикой белковоэнергетическая недостаточность регистрируется у 2,4–26% пациентов, поступивших в медицинские стационарные учреждения. Нутритивная недостаточность у пациентов педиатрического профиля полиэтиологична и может влиять на исход заболевания. Значительную часть в этиологическую структуру белково-энергетической недостаточности у пациентов вносят критические состояния (травмы, тяжелые инфекционные заболевания и их осложнения, деструктивный панкреатит и т. д.). Понимание патогенеза белково-энергетической недостаточности у пациентов в критическом состоянии позволяет оптимально подойти к организации и оказанию помощи, и в частности нутритивной поддержки. Анализ результатов исследований показал, что при мальнутриции у детей в критических состояниях происходит нарушение всех видов обмена: углеводного, белкового, жирового и витаминного. На фоне гиперметаболизма происходят изменения в гормональном и иммунологическом статусе, сдвиги водно-электролитного баланса. В статье представлена схема патогенеза острой белково-энергетической недостаточности критических состояний, а также проанализированы методы коррекции гомеостаза. Представлен широкий спектр специализированных продуктов для организации как зондового, так и перорального питания у детей, нуждающихся в нутритивной поддержке.
Для цитирования: Лисица ИА, Грицинская ВЛ, Завьялова АН, Александрович ЮС, Лисовский ОВ. Клинико-метаболические аспекты белково-энергетической недостаточности у пациентов педиатрических отделений интенсивной терапии. Медицинский Совет. 2025;(1):204-213. https://doi.org/10.21518/ms2025-047
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Clinical and metabolic aspects of protein-energy malnutrition in patients in pediatric intensive care units
Ivan A. Lisitsa, https://orcid.org/0000-0003-3501-9660, Vera L. Gritsinskaya, https://orcid.org/0000-0002-8290-8674, Anna N. Zavyalova, https://orcid.org/0000-0002-9532-9698, Yurii S. Aleksandrovich, https://orcid.org/0000-0002-2131-4813, Oleg V. Lisovskii, https://orcid.org/0000-0002-1749-169X
Saint Petersburg State Pediatric Medical University; 2, Litovskaya St., St Petersburg, 194100, Russia
Inadequate quantitative and/or component nutrition of children remains an urgent problem worldwide. The General Assembly of the United Nations formulated the “Global Monitoring Framework for Nutrition”, as a result of which the level of acute nutritional deficiencies in the general child population should be reduced to 5% by 2025. A systematic analysis was conducted on the basis of scientific publications in the electronic databases PubMed, EMBASE, Cochrane Library, eLibrary.ru. The data obtained showed that in developed economies protein-energy deficiency is registered in 2.4–26% of patients admitted to medical inpatient facilities. Nutritional deficiency in pediatric patients is polyetiological and can influence the outcome of the disease. Critical conditions (trauma, severe infectious diseases and their complications, destructive pancreatitis, etc.) contribute a significant part to the etiologic structure of protein-energy deficiency in patients. Understanding the pathogenesis of protein-energy deficiency in patients in critical condition allows to optimally approach the organization and provision of care and, in particular, nutritional support. Analysis of the results of studies has shown that malnutrition in children in critical conditions causes a violation of all types of metabolism: carbohydrate, protein, fat, and vitamin metabolism. On the background of hypermetabolism there are changes in hormonal and immunologic status, shifts in water-electrolyte balance. A wide range of specialized products is presented for organizing both tube and oral nutrition in children who need nutritional support.
For citation: Lisitsa IA, Gritsinskaya VL, Zavyalova AN, Aleksandrovich YS, Lisovskii OV. Clinical and metabolic aspects of protein-energy malnutrition in patients in pediatric intensive care units. Meditsinskiy sovet = Medical Council. 2025;(1):204-213. (In Russ.) https://doi.org/10.21518/ms2025-047
Conflict of interest: the authors declare no conflict of interest.
Введение
Нерациональное и/или недостаточное питание и его влияние на здоровье детей остается актуальной проблемой в XXI в. [1]. В соответствии с рекомендациями ASPEN (Американское общество энтерального и парентерального питания) недостаточность питания (malnutrition – мальнутриция) определяется как дисбаланс между потребностью в пищевых веществах и их поступлением в организм, что приводит к развитию дефицита энергии, белка и микронутриентов [1, 2]. Следствием длительной недостаточности питания является нарушение роста и развития ребенка, а также неблагоприятный прогноз для ряда заболеваний [2]. Объединенный экспертный комитет ФАО/ВОЗ по пищевым добавкам в 1961 г. для определения состояния, вызванного длительным и/или интенсивным, преимущественно белковым и/или энергетическим, голоданием, проявляющимся дефицитом массы тела и/или роста и комплексным нарушением гомеостаза организма, предложил термин «белково-энергетическая недостаточность» (БЭН) [3]. У пациентов, госпитализированных в отделения реанимации и интенсивной терапии (ОРИТ), нутритивная недостаточность понимается как состояние несоответствия поступления и расхода макро- и/или микронутриентов, приводящее к нарушению гомеокинеза, развитию морфо-функциональных расстройств, что отрицательно влияет на исход заболевания [4]. При этом дисбаланс возникает вследствие дефицита поступления, нарушения ассимиляции в сочетании с повышенными тратами, что приводит к стойкой дисрегуляции трофического гомеостаза, структурно-метаболическим (снижение массы тела, изменение компонентного состава организма с уменьшением сухой/тощей и клеточной масс) и функциональным (физические и когнитивные) последствиям.
В настоящее время в странах с низким уровнем экономического развития ведущей причиной развития БЭН у детей является ограниченный доступ к продуктам питания и/или медицинской помощи, а в развивающихся странах – повторные инфекционные заболевания. В экономически развитых странах ведущая роль формирования мальнутриции обусловлена не алиментарным фактором, а тяжелыми острыми или хроническими заболеваниями, вызывающими ассоциированные с гиперметаболизмом состояния [5]. Важное значение при этом играет как повышенная потребность в пищевых веществах, так и нарушение их абсорбции и ассимиляции. По данным мониторинга ЮНИСЕФ, ВОЗ и Всемирного банка, в 2020 г. в мире от неправильного питания страдали около 230 млн детей в возрасте до 5 лет, из которых более 47 млн (6,7%) имели острую недостаточность питания (wasting – потеря веса) [1]. Метаанализ по результатам публикаций за последние годы показал, что недостаточность питания, соответствующую критериям БЭН, имели 3,8% детей в Российской Федерации [6]. Частота БЭН среди пациентов, обращающихся за медицинской помощью в педиатрические клиники, выше и колеблется от 2,4 до 26% в странах Европейского союза [7]. БЭН у пациентов педиатрических ОРИТ полиэтиологична и может влиять на исход заболевания. С одной стороны наличие у ребенка БЭН осложняет течение коморбидной патологии; с другой стороны, критическое состояние (травмы, тяжелые инфекционные заболевания и их осложнения и т. д.) является пусковым фактором развития или прогрессирования БЭН [8–10]. Понимание патогенеза БЭН у пациентов в критическом состоянии позволяет оптимизировать оказание специализированной помощи, и в частности нутритивной поддержки.
Критерии диагностики белково-энергетической недостаточности у детей в условиях стационара
Диагностика недостаточности питания у детей необходима для корректной интерпретации лабораторных параметров, обеспечения адекватного лечения и формирования прогноза. Учитывая доказанную длительность пребывания в ОРИТ детей с БЭН по сравнению с пациентами с эйтрофией более чем в 2,5 раза, а также увеличение количества случаев повторных госпитализаций в ОРИТ, принципиально важным является своевременная диагностика, квалифицированная помощь и оптимизация мероприятий ухода [8].
Для диагностики мальнутриции используются соматометрические, лабораторные и инструментальные методы. Основными соматометрическими показателями являются длина (рост стоя) и масса тела, для оценки которых ВОЗ разработаны нормативы Child Growth Standards (2006 г.) и WHO Growth Reference (2007 г.), а также мобильные приложения – антропометрический калькулятор WHO Anthro (для детей от 0 до 60 мес.) и WHO AnthroPlus (для детей от 0 до 19 лет) [11]. В случае невозможности измерения длины тела ребенка обычным методом возможно проведение сегментарного измерения (длина голени, высота колена) с последующим расчетом по формулам общей длины тела. Обязательным критерием является определение массо-ростового индекса Кетле. Значимым критерием в диагностике БЭН является толщина кожно-жировой складки над трицепсом и окружность плеча в средней трети. Для всех соматометрических показателей определяется величина z-score; диагностическим уровнем БЭН является значение ниже -2z-score [1]. В качестве независимого инструмента скрининга БЭН у детей, в т. ч. в условиях ОРИТ, широко используется градуированная лента MUAC (mid-upper arm circumference) для измерения окружности плеча [12, 13].
Для оценки риска БЭН предложен ряд скрининговых шкал [14–16], в Российской Федерации адаптирована и валидизирована только шкала StrongKids (Screening tool for risk on nutritional status and growth) [17]. По шкале оценивается анамнез снижения массы тела, тяжесть сопутствующих заболеваний и наличие/отсутствие нарушения поступления или потери питательных веществ; в зависимости от суммы баллов от 0 до 5 стратифицируется риск развития мальнутриции.
Особенности метаболизма белков с определением изменений соматического и висцерального пулов возможно оценить на основе анализа белково-азотистого обмена (общий белок, альбумин, короткоживущие белки (трансферрин и преальбумин), креатинин и мочевина). При этом необходимо учитывать возрастные нормативные значения показателей [1, 18]. Изменения иммунных маркеров (процентное и абсолютное количество лимфоцитов, показатель иммунорегуляторного индекса (CD4+/CD8+), иммунограмма) также косвенно отражают нарушения нутритивного статуса и имеют большое прогностическое значение при сопутствующих заболеваниях [3, 18].
Возможно дополнительное использование комплексных методов оценки нутритивного статуса. В частности, изучение композиционного состава тела пациента (удельный вес жировой и мышечной ткани) может быть получено по результатам биоимпедансометрии и двухэнергетической рентгеновской абсорбциометрии [1, 19]. Количественную оценку состава и типа жировой и мышечной тканей, в т. ч. в качестве критерия эффективности лечения, позволяют провести ультразвуковое исследование, компьютерная и магнитно-резонансная томография [20].
Этиопатогенетические механизмы развития белково-энергетической недостаточности при критических состояниях
К ведущим этиологическим факторам острой БЭН, развивающейся при критическом состоянии, относят повышение потребности в энергии на фоне катаболизма и гиперметаболизма; затруднения в точной оценке базовой скорости метаболизма, неадекватное проведение питания пациента [20, 21].
Формирование БЭН у детей, особенно госпитализированных в ОРИТ, сопряжено с разнообразными биохимическими изменениями, затрагивающими метаболические, гормональные и глюкозо-регуляторные механизмы [9, 14]. Установлено, что ответом на критическое состояние является развитие типичной гиперметаболической реакции, продолжительность и выраженность которой в большей степени коррелирует с тяжестью состояния, индивидуальными особенностями пациента и продолжительностью острой фазы, в меньшей степени – с этиологическим характером патологии [21]. Значительное увеличение скорости обмена веществ приводит не только к повышению потребности в кислороде (О2), но и к гиперпродукции углекислого газа (СО2), нарастанию отрицательного азотистого баланса, БЭН (табл. 1) [22, 23]. Эффективность терапии в значительной степени определяется подбором объема и состава нутритивной поддержки, который должен строиться с учетом выраженности катаболической реакции, уровня гормонального и цитокинового профиля, анатомо-физиологических особенностей ребенка [1, 23].
Таблица 1. Основные клинико-метаболические отличия простого голодания и синдрома гиперметаболизма
| Характеристика | Простое голодание | Синдром гиперметаболизма |
| Сердечный выброс | – | ++ |
| Общее периферическое сосудистое сопротивление | Без изменений | – |
| Потребление О2 | – | ++ |
| Выделение СО2 | Без изменений | ++ |
| Энергетические потребности | – | +++ |
| Респираторный коэффициент | 0,75 (преобладание окисления липидов и белков) | 0,85 (смешанный метаболизм) |
| Первичный субстрат | Липиды | Липиды, углеводы и протеины |
| Протеолиз | + | +++ |
| Окисление протеинов | + | +++ |
| Синтез острофазных белков, цитокинов | + | +++ |
| Уреогенез | + | +++ |
| Гликогенолиз | + | +++ |
| Глюконеогенез | + | +++ |
| Инсулинорезистентность | Без изменений | ++ |
| Липолиз | ++ | +++ |
| Кетонемия | ++++ | + |
| Реакция на регуляторные стимулы | ++++ | + |
| Скорость развития БЭН | + | ++++ |
| Примечание. – снижение, + повышение. | ||
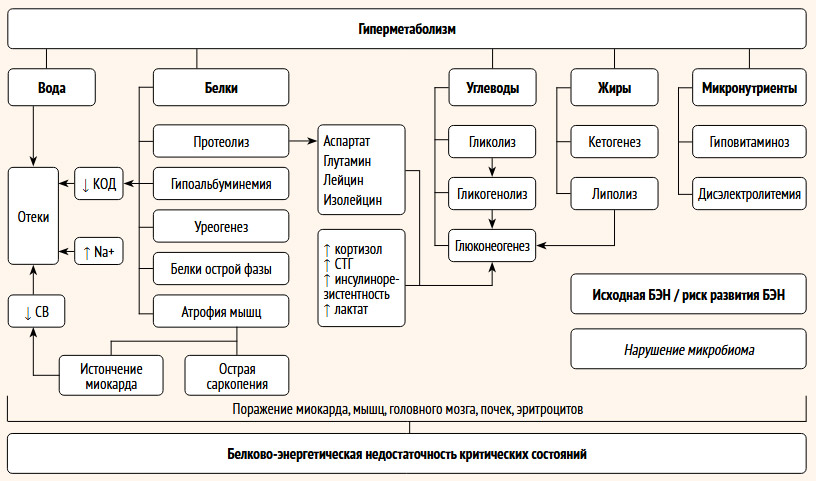
Развитие БЭН сопровождается изменением всех видов обмена: энергетического, белкового, углеводного, жирового и минерального. В первую очередь истощаются запасы гликогена и липидов, впоследствии присоединяется ускорение протеолиза мышечной ткани, а затем и истощение общего и висцерального пула белка [23, 24]. Изменение углеводного обмена у пациентов в критическом состоянии проявляется усилением окисления глюкозы и глюконеогенеза [21]. При дефиците энтеральной дотации углеводов через 12 ч с момента энтерального голодания начинается гликогенолиз [24, 25]. При этом парентеральное введение глюкозосодержащих растворов не снижает скорости глюконеогенеза, протеолиза и липолиза [21]. При сохраняющемся дефиците пищевых субстратов на фоне инсулинорезистентности активизируется распад белков, преимущественно в мышечной ткани, характеризующийся изменениями протеинограммы. В частности, отмечается снижение концентрации короткоживущих белков (преальбумина, трансферрина, церулоплазмина), затем уменьшается концентрация альбумина и общего белка [26].
Под воздействием нейрометаболических и гормон-индуцированных изменений снижается продукция трийодтироксина, инсулина, инсулиноподобного фактора роста-1 (IGF-1) и повышается синтез кортикотропина и кортизола [9, 27]. Увеличение времени голодания определяет переход к глюконеогенезу из продуктов протеолиза мышц и использованию аминокислот (в первую очередь аспартата, глутамина, лейцина и изолейцина), пирувата и лактата, что усиливает разрушение скелетных мышц с развитием саркопении. Через несколько дней наступает фаза мобилизации жира, которая через липолиз и кетогенез обусловливает прекращение быстрой миодеградации [9, 23, 27]. Происходящие реакции гиперкатаболизма включают также повышение скорости окисления жирных кислот [21].
Специфический гормональный и цитокиновый профиль, проявляющийся во время критического заболевания, характеризуется повышением содержания инсулина, глюкагона, кортизола, катехоламинов и провоспалительных цитокинов в сыворотке [21, 28, 29]. Среди цитокинов наиболее изучено влияние фактора некроза опухоли α (TNF-α), интерлейкинов 1 (IL-1) и 6 (IL-6) [30–31]. Увеличение концентрации контринсулярных гормонов в системном кровотоке повышает резистентность к инсулину и гормону роста и обуславливает стимулирование катаболических реакций: протеолиза, гликолиза и липолиза [29, 32]. Большинство образовавшихся в результате протеолиза свободных аминокислот используются для синтеза провоспалительных белков [22, 33]. Оставшаяся часть аминокислот с кровотоком поступает в печень для глюконеогенеза [18, 23].
Детально изучено влияние кортизола. Активированный цитокинами кортикотропин (АКТГ) стимулирует выработку кортизола в коре надпочечников. Повышению концентрации кортизола также способствует снижение кортикостероидсвязывающего глобулина при нарушении метаболизма печени, диспротеинемии. Гормональная активность кортизола при критическом состоянии клинически проявляется гипергликемией (за счет активации ферментов, участвующих в глюконеогенезе, повышении инсулинорезистентности, снижении поглощения глюкозы скелетными мышцами). Кроме того, активируется липолиз, что приводит к высвобождению свободных жирных кислот [34]. Кортизол-индуцированное увеличение транскрипции поверхностных рецепторов катехоламинов и ангиотензина II приводит к повышению чувствительности к этим вазоактивным гормонам, к вазоспазму, что, с одной стороны, повышает периферическое сосудистое сопротивление и артериальное давление, с другой – приводит к спланхнотической гипоперфузии [34].
Мышечная атрофия, сопровождающая протеолиз, – острая саркопения критических состояний, является неспецифическим патологическим процессом в результате сопутствующего системного воспаления, окислительного стресса, резистентности к инсулину и метаболического ацидоза [22]. Повышение лактата, с одной стороны, является подтверждением наличия недостаточности перфузии тканей, а с другой стороны, это независимый фактор усиления протеолиза и снижения биосинтеза белка [30]. Изучена роль воспаления в ингибировании mTOR (the mammalian Target of Rapamycin) – сериновой треонин-протеинкиназы, участвующей в регуляции клеточной пролиферации, а также влияние снижения содержания кальция и цинка на клеточный метаболизм [35]. Снижение IGF-1 также ингибирует mTOR и биосинтез белка [36]. Кроме того, mTORC1 (mammalian target of rapamycin complex 1) является ключевым фактором регуляции TFEB (Transcription Factor EB) – основного регулятора цитоаутофагии, лизосомального экзоцитоза и катаболизма липидов. При катаболизме и недостатке питательных веществ ингибирование mTORC1 приводит к дефосфорилированию TFEB по консервативным остаткам серина, способствуя транслокации TFEB в перинуклеарную область и транскрипционной активации, что проявляется усилением клеточной деградации [37].
Выявлена прямая зависимость снижения соматотропина, тестостерона и IGF-1 с повышением мышечной слабости и атрофии [30, 38]. Кроме того, повышение циркулирующих в сыворотке глюкокортикоидов, несмотря на их противовоспалительное действие, связано с гиперкатаболическим состоянием [39]. Вызванные развитием критического состояния митохондриальная дисфункция, нарушение внутриклеточных процессов окислительного фосфорилирования с развитием оксидативного стресса негативно влияют на белки скелетных мышц, способствуя их дальнейшему истощению [30, 40].
Учитывая характер изменений, характерный для всех мышц, Z. Grover еt al. показали динамику миоатрофии при БЭН в зависимости от метаболической активности: мышцы подмышечной и паховой областей (степень I), мышцы бедер ягодиц (степень II), грудные и абдоминальные мышцы (степень III), мышцы лица (степень IV) [27]. Снижение массы диафрагмы и грудных мышц, изменение метаболизма и электролитные нарушения (гипофосфатемия) приводят к острой дыхательной недостаточности нейромышечного типа со снижением минутной вентиляции, развитию гипоксии [9, 41–44]. Опосредованное мальнутрицией снижение иммунорезистентности и развитие инфекций нижних дыхательных путей приводят к прогрессированию дыхательной недостаточности [41, 45]. При длительном протеолизе истончаются сердечные миофибриллы, что обуславливает снижение контрактильности миокарда [9, 42]. В тяжелых случаях наблюдается брадикардия и артериальная гипотония в сочетании с нарушением сократительной функции и дисэлектролитными нарушениями, приводящими к развитию аритмии [41, 42]. Снижение сердечного выброса приводит к гипоперфузии внутренних органов, прогрессированию полиорганной недостаточности. Обусловленная нарастающей гипоперфузией гипоксия тканей ассоциируется с нарушением образования аденозинтрифосфата (АТФ), что приводит к нарушению клеточного гомеостаза, усиливает проявления оксидативного стресса, образование свободных радикалов [46]. Таким образом, происходит нарушение мембран клеток с развитием недостаточности высокоэнергетических нуклеотидов.
При преимущественно мышечной атрофии в клинической картине без развития отеков принято говорить об алиментарном маразме; сочетание похудания и отеков называют маразматическим квашиоркором [9]. На фоне снижения сывороточного альбумина, антидиуретического гормона, повышения кортизола во время голодания формируется клиническая картина квашиоркора. Отеки начинаются со стопы (I степень), затем лица (II степень), поясничного и грудного отделов (III степень) вплоть до ассоциации с асцитом (IV степень) [9]. Гипоальбуминемия приводит к снижению коллоидно-осмотического давления, внутрисосудисто-интерстициального градиента альбумина, что увеличивает фильтрацию жидкости из внутрисосудистого отдела в интерстициальный [47]. В настоящее время классическая модель Старлинга, в которой преобладающая роль в развитии отеков отводится коллоидно-осмотическому давлению, пересмотрена. Показано увеличение влияния у пациентов в критическом состоянии изменений слоя эндотелиального гликокаликса, эндотелиальной базальной мембраны и внеклеточного матрикса в межсекторальном распределении жидкости [42, 47]. Учитывая, что эндотелиальный гликокаликс содержит в своем составе сульфатированные протеогликаны и другие гликозаминогликаны, не исключено влияние нарушения метаболизма серы в развитии отеков [48]. У пациентов в катаболической фазе критического состояния, особенно при исходном наличии БЭН, отмечается нарушение лимфооттока [21]. Задержка натрия, истощение внутриклеточного калия приводят к увеличению проницаемости клеточных мембран и прогрессированию квашиоркора [9, 27].
Развитие синдрома мальабсорбции при БЭН обусловлено рядом причин. Так, атрофия ворсинок энтероцитов вызывает вторичную дисахаридазную недостаточность [41]. Рост условно-патогенной и патогенной микробиоты кишечника при функциональной недостаточности поджелудочной железы приводит к мальабсорбции жиров [27, 49].
Острая нутритивная недостаточность вызывает снижение количества нейронов, синапсов, миелинизации нервных волокон, что приводит к уменьшению объема и истончению коры головного мозга, нарушению роста и дифференцировки белого и серого вещества [50]. В случае развития острой БЭН у детей старше 3–4-летнего возраста изменения, происходящие в головном мозге, могут приводить к необратимым последствиям [9, 51].
Дефицит белка и нарушения его метаболизма обуславливают снижение скорости синтеза иммуноглобулинов, уменьшение секреции внутри- и внеклеточных транспортных белков, внутриклеточный дефицит энергии, нарушение транспорта микронутриентов. Иммунная недостаточность у пациентов педиатрических ОРИТ с БЭН определяет частое присоединение инфекционных заболеваний, склонных к затяжному и осложненному течению, в т. ч. нозокомиальных, что в совокупности повышает риск наступления летального исхода [52].
Влияние гиповитаминозов, микро- и макронутриентного дисбаланса на развитие белково-энергетической недостаточности
Недостаточное поступление витаминов, микро- и макронутриентов при отсутствии или несбалансированном питании могут усугубить полиорганную недостаточность при БЭН [26]. Снижение сывороточной концентрации микронутриентов у детей в ОРИТ может быть обусловлено перераспределением из центрального кровообращения в ткани и органы во время катаболической фазы критического заболевания; потерями микроэлементов из-за экссудативных потерь или потерь в стомах или дренажах, зондах; снижением концентрации кофакторов ферментов из-за повышенных потребностей во время заболевания; снижением эндогенных уровней витаминов, микро- и макронутриентов при наличии хронических неинфекционных заболеваний [53].
Гипопротеинемия усиливает гипоэлектролитемию, т. к. большинство микроэлементов циркулирует вместе с белками-переносчиками [54]. Пациенты педиатрических ОРИТ склонны к дефициту и аномальным концентрациям витаминов и микронутриентов из-за гиперметаболического состояния, снижения кишечной абсорбции, недостаточного поступления, выведения; колебаний, связанных с приемом лекарств, и основных метаболических заболеваний [54, 55]. Однако в реальной клинической практике в связи с нестабильной природой концентрации витаминов для измерения концентрации в крови определение истинного содержания их проблематично [54].
Клинические проявления острого дефицита витамина С (аскорбиновая кислота) определяются патофизиологическими изменениями, обусловленными его ролью в организме. При гиповитаминозе С наблюдается замедление заживления ран, угнетение усвоения негемового железа [56]. G. Grosso еt al. указали на наличие обратной связи между снижением содержания витамина С в сыворотке крови и полиорганной недостаточностью; прямой связи – со снижением летальности [57]. Показано неблагоприятное влияние снижения концентрации аскорбиновой кислоты на проницаемость эндотелия сосудов с развитием феномена «капиллярной утечки», элиминацию супероксида, ингибирование оксида азота и пероксинитрита, что в совокупности повышает негативное влияние перекисного окисления липидов на клеточные мембраны [57]. Дефицит витамина С вносит негативный вклад в развитие отеков нижних конечностей, поднадкостничных кровоизлияний, гемартрозов; усугубляет недостаточность железа [54].
Снижение содержания жирорастворимых витаминов у детей в критическом состоянии связано в т. ч. с уменьшением концентрации холестерина и триглицеридов [54, 58]. Возникающая у детей в критическом состоянии недостаточность витамина D оказывает негативное влияние на гомеостаз кальция, иммунную функцию и оксидантно-антиоксидантный баланс [59, 59]. Доказанной является связь между низкой концентрацией витамина D при поступлении ребенка с повышением тяжести заболевания, увеличением продолжительности пребывания в ОРИТ. К. Ebenezer et al. при исследовании детей (средний возраст 17,5 мес.) показали наличие обратной корреляции между содержанием 25(OH)D и тяжестью заболевания при поступлении, необходимостью в вазопрессорной поддержке и продолжительностью искусственной вентиляции легких [61]. В проведенном когортном многоцентровом проспективном исследовании R. Ghashut et al. выявили сильную корреляционную связь между концентрациями 25(OH)D, С-реактивного белка и альбумина в плазме [62].
Имеются неоднозначные сообщения о содержании витамина Е (токоферола) при тяжелых заболеваниях у детей. Авторы указывают, что при оценке уровня токоферола необходимо учитывать перераспределение холестерина, которое происходит как часть системной воспалительной реакции [54]. Содержание витамина К (филлохинон) может изменяться у пациентов в критическом состоянии по двум причинам: первая связана с уменьшением поступления или всасывания при развитии мальабсорбции; вторая – с проводимой в ОРИТ терапией. В частности, доказано негативное влияние длительного использования цефалоспоринов третьего поколения, включающих боковую цепь N-метилтиотетразола (например, цефтриаксон), которые ингибируют эпоксид-редуктазу витамина K [63]. Это приводит к развитию дефицита витамин К-зависимых факторов свертывания крови и нарушению кишечной микрофлоры, ответственной за выработку менахинона. Однако не выявлено положительного влияния профилактического назначения витамина К у пациентов, длительное время получающих антибактериальные препараты, на развитие гипопротромбинемии [54]. Схема патогенеза вторичной БЭН у пациентов ОРИТ представлена на рисунке.
Рисунок. Патогенез развития вторичной острой БЭН у пациентов в критических состояниях
Особенности нутритивной поддержки пациентов в ОРИТ
У пациентов в критических состояниях наблюдается снижение секреторной и ферментативной функции желудочно-кишечного тракта. Уменьшение общей и свободной кислотности желудка вызывает снижение активности пепсина. Уменьшение активности панкреатических ферментов (липазы, амилазы) прямо зависит от выраженности БЭН. Сниженная секреторная и ферментативная активность определяет развитие мальдигестии, что усугубляет клинику БЭН [25, 30].
Нарушения функционирования желудочно-кишечного тракта определяются не только самим критическим состоянием, но также и лечением, которое может осложняться задержкой опорожнения желудка, непереносимостью питания, развитием синдромов мальабсорбции, диареи [30]. Нарушение мезентериальной перфузии снижает скорость внутрипросветного и пристеночного пищеварения, всасывания в тонкой кишке [30, 64]. К патологическому состоянию присоединяется изменение кишечного микробиома, что также способствует прогрессированию критического состояния [65]. Доказано наличие прямой связи между изменением микробиоты кишечника и метаболическими нарушениями, характеризующимися инсулинорезистентностью, развитием дислипидемии, атрофии скелетных мышц, прогрессированием мальнутриции [30]. Снижение продуцирующих короткоцепочечные жирные кислоты (КЦЖК) родов Faecalibacterium, Prevotella, Blautia и семейства Ruminococcaceae не только дополнительно способствует дисфункции кишечника, но и негативно влияет на истощение скелетных мышц [66]. Продуцируемые микробиотой КЦЖК играют важную роль в поддержании гомеостаза углеводного и липидного обменов. КЦЖК повышают чувствительность миоцитов к инсулину, стимулируют секрецию пептида YY и GLP-1 [30, 67]. В связи с этим снижение КЦЖК приводит к усилению инсулинорезистентности и прогрессированию БЭН. Доказано влияние Escherichia coli на развитие атрофии скелетных мышц через сигнальный путь IGF-1/PI3K/Akt/mTOR [68].
Несмотря на короткие сроки энтерального питания у пациентов педиатрических ОРИТ, часто пребывание в отделении сопровождается отсутствием самостоятельного перорального питания [69]. Осуществление нутритивной поддержки исключительно зондовым методом может не только повлиять на формирование навыков самостоятельного питания из-за отсутствия соблюдения режима кормления, но и привести к расстройству пищевого поведения, стрессу у детей после перевода из ОРИТ и выписки из стационара [22, 24].
В настоящее время в Российской Федерации доступен широкий спектр специализированных продуктов для организации как зондового, так и перорального питания у детей, нуждающихся в нутритивной поддержке. Для перорального и зондового питания детей с рождения применяется готовая к употреблению смесь Инфатрини. Она содержит все необходимые для ребенка младшего возраста макро- и микронутриенты, а также пребиотики GOS/FOS и обеспечивает поступление повышенного количества белка и энергии в небольшом объеме. Линейка возраст-адаптированных продуктов «Нутрини» применяется у детей старше 1 года и включает изо-, гиперкалорическую смесь, а также смесь с комбинацией пищевых волокон MF6. Для перорального питания детей старше 1 года применяется жидкая, готовая к употреблению смесь Нутринидринк с пищевыми волокнами с повышенным содержанием белка и энергии. Сухие смеси, такие как Нутризон Эдванс Нутридринк, могут применяться как в изо-, так и в гиперкалорическом разведении для зондового или энтерального питания. У пациентов с тяжелыми нарушениями ферментации и всасывания белка старше 6 лет применяется смесь Нутризон Эдванст Пептисорб, содержащая белок с высокой степенью гидролиза. Ключевые показатели смесей представлены в табл. 2.
Таблица 2. Смеси для энтерального питания детей
| Продукт | Минимальный возраст применения | Способ применения | Энергия, ккал/100 мл | Белок, г/100 мл | Тип белка | Жиры, г/100 мл | Углеводы, г/100 мл | Пищевые волокна, г/100 мл |
| Инфатрини | С рождения | Перорально или зонд | 101 | 2,6 | Цельный | 5,4 | 10,3 | 0,6 (ГОС/ФОС) |
| Нутринидринк с пищевыми волокнами | С 1 года | Перорально | 153 | 3,4 | Цельный | 6,8 | 18,8 | 1,5 (MF6) |
| Нутрини | С 1 года | Зонд | 100 | 2,5 | Цельный | 4,4 | 12,5 | - |
| Нутрини с пищевыми волокнами | С 1 года | Зонд | 101 | 2,5 | Цельный | 4,4 | 12,5 | 0,8 (MF6) |
| Нутрини Энергия | С 1 года | Зонд | 150 | 4,0 | Цельный | 6,7 | 18,5 | - |
| Нутризон Эдванс Нутридринк, сухая смесь | С 1 года | Перорально или зонд | 100 | 3,9 | Цельный | 3,9 | 12,2 | - |
| 150 | 5,9 | 5,9 | 18,3 | |||||
| Нутризон Эдванст Пептисорб | С 6 лет | Зонд | 100 | 4,0 | Гидролизованный | 1,7 | 17,7 | - |
Для проведения оптимальной индивидуальной нутритивной поддержки у пациентов в критическом состоянии следует регулярно определять целевые показатели энергетической потребности, учитывая динамику изменений метаболизма. Оптимальным является проведение непрямой калориметрии, динамика изменения которой в ходе заболевания позволяет определить переход от катаболического к анаболическому пути метаболизма, предупредить перекармливание. Однако, учитывая организационно-методические, экономические и иные особенности, в ОРИТ большинства клиник используется расчетный метод [21]. В настоящее время рекомендуется использование уравнений W. Schofield и нормативов Продовольственной и сельскохозяйственной организации/Всемирной организации здравоохранения [70].
Заключение
Таким образом, наличие острой БЭН у детей, госпитализированных в ОРИТ, является важной, не решенной в полной мере полиэтиологической проблемой. Наличие хронической БЭН является независимым фактором усугубления тяжести состояния ребенка при возникновении критического состояния, что требует тщательной оценки, своевременного и индивидуального подхода в терапии.
[1] United Nations Children’s Fund (UNICEF), World Health Organization, International Bank for Reconstruction and Development / The World Bank. Levels and trends in child malnutrition: key findings of the 2021 edition of the joint child malnutrition estimates. Geneva: World Health Organization; 2021.
Список литературы / References
Развернуть
- Захарова ИН, Дмитриева ЮА, Сугян НГ, Симакова МА. Недостаточность питания в практике педиатра: дифференциальная диагностика и возможности нутритивной поддержки. Медицинский совет. 2019;(2):200-208. https://doi.org/10.21518/2079-701X-2019-2-200-208.
- Mehta NM, Corkins MR, Lyman B, Malone A, Goday PS, Carney LN et al.; American Society for Parenteral and Enteral Nutrition Board of Directors. Defining pediatric malnutrition: a paradigm shift toward etiology-related definitions. JPEN J Parenter Enteral Nutr. 2013;37(4):460-481. https://doi.org/10.1177/0148607113479972.
- Тутельян ВА, Конь ИЯ (ред.). Детское питание. 4-е изд., перераб. и доп. М.: МИА; 2017. С. 452-465.
- Лейдерман ИН, Грицан АИ, Заболотских ИБ. Периоперационная нутритивная поддержка. Методические рекомендации Федерации анестезиологов и реаниматологов. Вестник интенсивной терапии имени А.И. Салтанова. 2021;(4):7-20. https://doi.org/10.21320/1818-474X-2021-4-7-20.
- Боровик ТЭ, Фомина МВ, Яцык СП, Звонкова НГ, Бушуева ТВ, Рославцева ЕА и др. Оценка нутритивного статуса и рисков развития недостаточности питания у детей в стационаре хирургического профиля. Педиатрия. Журнал имени Г.Н. Сперанского. 2022;101(2):103-112. https://doi.org/10.24110/0031-403X-2022-101-2-103-112.
- Грицинская ВЛ, Новикова ВП. К вопросу об эпидемиологии дефицита массы тела у детей и подростков (систематический обзор и мета-анализ научных публикаций). Экспериментальная и клиническая гастроэнтерология. 2023;215(7):125-135. https://doi.org/10.31146/1682-8658-ecg-215-7-125-135.
- McCarthy A, Delvin E, Marcil V. Prevalence of Malnutrition in Pediatric Hospitals in Developed and InTransition Countries: The Impact of Hospital Practices. Nutrients. 2019;11(2):236. https://doi.org/10.3390/nu11020236.
- Khlevner J, Naranjo K, Hoyer C. Healthcare Burden Associated with Malnutrition Diagnoses in Hospitalized Children with Critical Illnesses. Nutrients. 2023;15(13):3011. https://doi.org/10.3390/nu15133011.
- Dipasquale V, Cucinotta U, Romano C. Acute Malnutrition in Children: Pathophysiology, Clinical Effects and Treatment. Nutrients. 2020;12(8):2413. https://doi.org/10.3390/nu12082413.
- Wernerman J, Christopher KB, Annane D, Casaer MP, Coopersmith CM, Deane AM, et al. Metabolic support in the critically ill: a consensus of 19. Crit Care. 2019;23(1):318. https://doi.org/10.1186/s13054-019-2597-0.
- de Onis M, Onyango AW, Borghi E, Siyam A, Nishida C, Siekmann J. Development of a WHO growth reference for school-aged children and adolescents. Bull World Health Organ. 2007;85(9):660-667. https://doi.org/10.2471/blt.07.043497.
- Звонкова НГ, Боровик ТЭ, Маслова НА, Фомина МВ. Возможности использования показателя окружности средней трети плеча для скрининга недостаточности питания у детей. Вопросы детской диетологии. 2021;19(6):68-74. Режим доступа: https://www.phdynasty.ru/katalog/zhurnaly/voprosy-detskoy-dietologii/2021/tom-19-nomer-6/43113.
- Abdel-Rahman SM, Bi C, Thaete K. Construction of Lambda, Mu, Sigma Values for Determining Mid-Upper Arm Circumference z Scores in U.S. Children Aged 2 Months Through 18 Years. Nutr Clin Pract. 2017;32(1):68-76. https://doi.org/10.1177/0884533616676597.
- Tume LN, Valla FV, Joosten K. Nutritional support for children during critical illness: European Society of Pediatric and Neonatal Intensive Care (ESPNIC) metabolism, endocrine and nutrition section position statement and clinical recommendations. Intensive Care Med. 2020;46(3):411-425. https://doi.org/10.1007/s00134-019-05922-5.
- Carter LE, Shoyele G, Southon S. Screening for Pediatric Malnutrition at Hospital Admission: Which Screening Tool Is Best? Nutr Clin Pract. 2020;35(5):951-958. https://doi.org/10.1002/ncp.10367.
- Александрович ЮС, Александрович ИВ, Пшениснов КВ. Скрининговые методы оценки нутритивного риска у госпитализированных детей. Вестник интенсивной терапии имени А.И. Салтанова. 2015;(3):24-31. Режим доступа: https://www.elibrary.ru/vjiugz.
- Звонкова НГ, Боровик ТЭ, Черников ВВ, Гемджян ЭГ, Яцык СП, Фисенко АП и др. Адаптация и валидация русскоязычной версии опросника STRONGkids для оценки нутритивного риска у детей. Педиатрия. Журнал имени Г.Н. Сперанского. 2022;101(4):155-164. https://doi.org/10.24110/0031-403X-2022-101-4-155-164.
- Яковлева МН, Смирнова КИ, Лисица ИА, Мешков АВ, Новикова ИС. Лабораторные маркеры белково-энергетической недостаточности. Обзор литературы. Университетский терапевтический вестник. 2024;6(1):79-89. https://doi.org/10.56871/UTJ.2024.38.70.007.
- Завьялова АН, Новикова ВП, Яковлева МН. Саркопения у детей: лекция. Медицинский совет. 2024;18(1):245-253. https://doi.org/10.21518/ms2023-470.
- Киселева ЕВ, Пигарова ЕА, Мокрышева НГ. Эволюция оценки состава тела: от индекса массы тела до профилирования состава организма. FOCUS Эндокринология. 2023;4(2):12-18. https://doi.org/10.15829/15604071-2023-13.
- Mehta NM, Duggan CP. Nutritional deficiencies during critical illness. Pediatr Clin North Am. 2009;56(5):1143-1160. https://doi.org/10.1016/j.pcl.2009.06.007.
- Kyle UG, Akcan-Arikan A, Orellana RA, Coss-Bu JA. Nutrition support among critically ill children with AKI. Clin J Am Soc Nephrol. 2013;8(4):568-574. https://doi.org/10.2215/CJN.05790612.
- Селиванова АВ. Гормонально-метаболические изменения у больных, находящихся в критическом состоянии. Клиническая лабораторная диагностика. 2012;(11):13-17. Режим доступа: https://cyberleninka.ru/article/n/gormonalno-metabolicheskie-izmeneniya-u-bolnyhnahodyaschihsya-v-kriticheskom-sostoyanii.
- Лисица ИА, Александрович ЮС, Завьялова АН, Лисовский ОВ, Новикова ВП. Особенности синдрома возобновленного питания у пациентов педиатрических ОРИТ (обзор литературы). Вестник анестезиологии и реаниматологии. 2024;21(5):97-107. https://doi.org/10.24884/2078-5658-2024-21-5-97-107.
- Ровда ЮИ, Миняйлова НН, Строева ВП, Никитина ЕД. Белково-энергетическая недостаточность (БЭН) у детей (лекция). Мать и дитя в Кузбассе. 2021;(2):40-51. Режим доступа: https://mednauki.ru/index.php/MD/article/view/574.
- Закирова АМ, Файзуллина РА, Кадриев АГ, Шаяпова ДТ, Рашитова ЭЛ, Зарипов ИР и др. Нутритивная поддержка при различных состояниях, сопровождающихся белково-энергетической недостаточностью у детей. Медицинский совет. 2023;17(1):96-109. https://doi.org/10.21518/ms2022-019.
- Grover Z, Ee LC. Protein energy malnutrition. Pediatr Clin North Am. 2009;56(5):1055-1068. https://doi.org/10.1016/j.pcl.2009.07.001.
- Batool R, Butt MS, Sultan MT. Protein-energy malnutrition: A risk factor for various ailments. Crit Rev Food Sci Nutr. 2015;55:242-253. https://doi.org/10.1080/10408398.2011.651543.
- Sturgeon JP, Njunge JM, Bourke CD, Gonzales GB, Robertson RC, BwakuraDangarembizi M et al. Inflammation: the driver of poor outcomes among children with severe acute malnutrition? Nutr Rev. 2023;81(12):1636-1652. https://doi.org/10.1093/nutrit/nuad030.
- Zhang J, Luo W, Miao C, Zhong J. Hypercatabolism and Anti-catabolic Therapies in the Persistent Inflammation, Immunosuppression, and Catabolism Syndrome. Front Nutr. 2022;9:941097. https://doi.org/10.3389/fnut.2022.941097.
- Delgado AF, Okay TS, Leone C, Nichols B, Del Negro GM, Vaz FA. Hospital malnutrition and inflammatory response in critically ill children and adolescents admitted to a tertiary intensive care unit. Clinics. 2008;63(3):357-362. https://doi.org/10.1590/s1807-59322008000300012.
- Wen B, Njunge JM, Bourdon C, Gonzales GB, Gichuki BM, Lee D et al. Systemic inflammation and metabolic disturbances underlie inpatient mortality among ill children with severe malnutrition. Sci Adv. 2022;8(7):eabj6779. https://doi.org/10.1126/sciadv.abj6779.
- Tuttle CSL, Thang LAN, Maier AB. Markers of inflammation and their association with muscle strength and mass: A systematic review and meta-analysis. Ageing Res Rev. 2020;64:101185. https://doi.org/10.1016/j.arr.2020.101185.
- Pacheco-Navarro AE, Rogers AJ. The Metabolomics of Critical Illness. Handb Exp Pharmacol. 2023;277:367-384. https://doi.org/10.1007/164_2022_622.
- Vainshtein A, Sandri M. Signaling Pathways That Control Muscle Mass. Int J Mol Sci. 2020;21(13):4759. https://doi.org/10.3390/ijms21134759.
- Liu GY, Sabatini DM. mTOR at the nexus of nutrition, growth, ageing and disease. Nat Rev Mol Cell Biol. 2020;21(4):183-203. https://doi.org/10.1038/s41580-019-0199-y.
- Willett R, Martina JA, Zewe JP, Wills R, Hammond GRV, Puertollano R. TFEB regulates lysosomal positioning by modulating TMEM55B expression and JIP4 recruitment to lysosomes. Nat Commun. 2017;8(1):1580. https://doi.org/10.1038/s41467-017-01871-z.
- Van den Berghe G. Dynamic neuroendocrine responses to critical illness. Front Neuroendocrinol. 2002;23(4):370-391. https://doi.org/10.1016/s00913022(02)00006-7.
- Schakman O, Kalista S, Barbé C. Glucocorticoid-induced skeletal muscle atrophy. Int J Biochem Cell Biol. 2013;45(10):2163-2172. https://doi.org/10.1016/j.biocel.2013.05.036.
- Van Wyngene L, Vandewalle J, Libert C. Reprogramming of basic metabolic pathways in microbial sepsis: therapeutic targets at last? EMBO Mol Med. 2018;10(8):e8712. https://doi.org/10.15252/emmm.201708712.
- Karunaratne R, Sturgeon JP, Patel R. Predictors of inpatient mortality among children hospitalized for severe acute malnutrition: a systematic review and meta-analysis. Am J Clin Nutr. 2020;112(4):1069-1079. https://doi.org/10.1093/ajcn/nqaa182.
- Briend A. Kwashiorkor - New evidence in the puzzle of oedema formation. EBioMedicine. 2022;80:104070. https://doi.org/10.1016/j.ebiom.2022.104070.
- Knebusch N, Mansour M, Vazquez S. Macronutrient and Micronutrient Intake in Children with Lung Disease. Nutrients. 2023;15(19):4142. https://doi.org/10.3390/nu15194142.
- Güngör Ş, Doğan A. Diaphragm thickness by ultrasound in pediatric patients with primary malnutrition. Eur J Pediatr. 2023;182(7):3347-3354. https://doi.org/10.1007/s00431-023-05024-x.
- Ndlovu S, David-Govender C, Tinarwo P. Changing mortality amongst hospitalised children with Severe Acute Malnutrition in KwaZulu-Natal, South Africa, 2009-2018. BMC Nutr. 2022;8(1):63. https://doi.org/10.1186/s40795-022-00559-y.
- Mogensen KM, Lasky-Su J, Rogers AJ, Baron RM, Fredenburgh LE, Rawn J et al. Metabolites Associated with malnutrition in the intensive care unit are also associated with 28-day mortality. JPEN J Parenter Enteral Nutr. 2017;41(2):188-197. https://doi.org/10.1177/0148607116656164.
- Gonzales GB, Njunge JM, Gichuki BM. The role of albumin and the extracellular matrix on the pathophysiology of oedema formation in severe malnutrition. EBioMedicine. 2022;79:103991. https://doi.org/10.1016/j.ebiom.2022.103991.
- Golden MH. Nutritional and other types of oedema, albumin, complex carbohydrates and the interstitium - a response to Malcolm Coulthard’s hypothesis: Oedema in kwashiorkor is caused by hypo-albuminaemia. Paediatr Int Child Health. 2015;35(2):90-109. https://doi.org/10.1179/2046905515Y.0000000010.
- Thaxton GE, Melby PC, Manary MJ. New Insights into the Pathogenesis and Treatment of Malnutrition. Gastroenterol Clin North Am. 2018;47(4):813-827. https://doi.org/10.1016/j.gtc.2018.07.007.
- Georgieff MK. Nutrition and the developing brain: Nutrient priorities and measurement. Am J Clin Nutr. 2007;85(2):614S-620S. https://doi.org/10.1093/ajcn/85.2.614S.
- Shahrin L, Chisti MJ, Ahmed T. Primary and secondary malnutrition. World Rev Nutr Diet. 2015;113:139-146. https://doi.org/10.1159/000367880.
- Walson JL, Berkley JA. The impact of malnutrition on childhood infections. Curr Opin Infect Dis. 2018;31(3):231-236. https://doi.org/10.1097/QCO.0000000000000448.
- Casaer MP, Bellomo R. Micronutrient deficiency in critical illness: an invisible foe? Intensive Care Med. 2019;45(8):1136-1139. https://doi.org/10.1007/s00134-019-05678-y.
- Dao DT, Anez-Bustillos L, Cho BS. Assessment of Micronutrient Status in Critically Ill Children: Challenges and Opportunities. Nutrients. 2017;9(11):1185. https://doi.org/10.3390/nu9111185.
- Dos Reis Santos M, Leite HP, Luiz Pereira AM. Factors associated with not meeting the recommendations for micronutrient intake in critically ill children. Nutrition. 2016;32(11-12):1217-1222. https://doi.org/10.1016/j.nut.2016.03.019.
- Thurnham DI, Northrop-Clewes CA. Inflammation and biomarkers of micronutrient status. Curr Opin Clin Nutr Metab Care. 2016;19(6):458-463. https://doi.org/10.1097/MCO.0000000000000323.
- Grosso G, Bei R, Mistretta A. Effects of vitamin C on health: a review of evidence. Front Biosci. 2013;18(3):1017-1029. https://doi.org/10.2741/4160.
- Conway FJ, Talwar D, McMillan DC. The relationship between acute changes in the systemic inflammatory response and plasma ascorbic acid, alphatocopherol and lipid peroxidation after elective hip arthroplasty. Clin Nutr. 2015;34(4):642-646. https://doi.org/10.1016/j.clnu.2014.07.004.
- Madden K, Feldman HA, Chun RF. Critically Ill Children Have Low Vitamin D-Binding Protein, Influencing Bioavailability of Vitamin D. Ann Am Thorac Soc. 2015;12(11):1654-1661. https://doi.org/10.1513/AnnalsATS.201503-160OC.
- McNally JD, Menon K, Chakraborty P. Canadian Critical Care Trials Group. The association of vitamin D status with pediatric critical illness. Pediatrics. 2012;130(3):429-436. https://doi.org/10.1542/peds.2011-3059.
- Ebenezer K, Job V, Antonisamy B. Serum Vitamin D Status and Outcome among Critically Ill Children Admitted to the Pediatric Intensive Care Unit in South India. Indian J Pediatr. 2016;83(2):120-125. https://doi.org/10.1007/s12098-015-1833-0.
- Ghashut RA, Talwar D, Kinsella J. The effect of the systemic inflammatory response on plasma vitamin 25 (OH) D concentrations adjusted for albumin. PLoS ONE. 2014;9(3):e92614. https://doi.org/10.1371/journal.pone.0092614.
- Aziz F, Patil P. Role of prophylactic vitamin K in preventing antibiotic induced hypoprothrombinemia. Indian J Pediatr. 2015;82(4):363-367. https://doi.org/10.1007/s12098-014-1584-3.
- Chapple LS, Plummer MP, Chapman MJ. Gut dysfunction in the ICU: diagnosis and management. Curr Opin Crit Care. 2021;27(2):141-146. https://doi.org/10.1097/MCC.0000000000000813.
- Завьялова АН, Новикова ВП, Игнатова ПД. Ось «микробиота - мышцы». Экспериментальная и клиническая гастроэнтерология. 2022;207(11):60-69. https://doi.org/10.31146/1682-8658-ecg-207-11-60-69.
- Лисица ИА, Александрович ЮС, Завьялова АН, Лисовский ОВ, Разумов СА. Дисфагия у пациентов педиатрических отделений реанимации и интенсивной терапии (обзор литературы). Вестник анестезиологии и реаниматологии. 2023;20(6):97-105. https://doi.org/10.24884/20785658-2023-20-6-97-105.
- den Besten G, Bleeker A, Gerding A. Short-Chain Fatty Acids Protect Against High-Fat Diet-Induced Obesity via a PPARγ-Dependent Switch From Lipogenesis to Fat Oxidation. Diabetes. 2015;64(7):2398-2408. https://doi.org/10.2337/db14-1213.
- Schieber AM, Lee YM, Chang MW. Disease tolerance mediated by microbiome E. coli involves inflammasome and IGF-1 signaling. Science. 2015;350(6260):558-563. https://doi.org/10.1126/science.aac6468.
- Morton K, Marino LV, Pappachan JV. Feeding difficulties in young paediatric intensive care survivors: A scoping review. Clin Nutr ESPEN. 2019;30:1-9. https://doi.org/10.1016/j.clnesp.2019.01.013.
- Fuentes-Servín J, Avila-Nava A, González-Salazar LE. Resting Energy Expenditure Prediction Equations in the Pediatric Population: A Systematic Review. Front Pediatr. 2021;9:795364. https://doi.org/10.3389/fped.2021.795364.








