
Журнал "Медицинский совет" №11/2024
DOI: 10.21518/ms2024-315
Ю.А. Дмитриева1,2, И.Н. Захарова1,2,
И.М. Османов2,4, А.Д. Гостюхина1,2,
С.Е. Тесленко3, Е.Р. Радченко2,
А.Р. Миянова1, Е.В. Скоробогатова1,2
1 Российская медицинская академия непрерывного профессионального образования; 125993, Россия, Москва, ул. Баррикадная, д. 2/1, стр. 1
2 Детская городская клиническая больница имени З.А. Башляевой; 125373, Россия, Москва, ул. Героев Панфиловцев, д. 28
3 Московский государственный университет имени М.В. Ломоносова; 119991, Россия, Москва, Ленинские горы, д. 1
4 Российский национальный исследовательский медицинский университет имени Н.И. Пирогова; 117997, Россия, Москва, ул. Островитянова, д. 1
Введение. Серологические методы исследования являются основным инструментом для проведения скрининга на целиакию. В качестве первичного исследования рекомендуется определение антител к тканевой трансглутаминазе IgA (tTG-IgA) в сочетании с оценкой концентрации общего IgA сыворотки. Иные серологические маркеры, в частности антитела к деамидированным пептидам (DGP-IgG/IgA) и нативному глиадину (AGA-IgA/IgG), не рекомендованы к применению в процессе скрининга на целиакию у иммунокомпетентных пациентов.
Цель. Определить диагностическую ценность серологических маркеров при первичном обследовании на целиакию у детей.
Материалы и методы. Проведен анализ чувствительности, специфичности, положительной и отрицательной прогностической ценности антител tTG-IgA/IgG, DPG-IgA/IgG, AGA-IgA/IgG в группе 1 247 детей.
Результаты. В группе исследования целиакия была диагностирована у 101 пациента. Антитела к тканевой трансглутаминазе IgA продемонстрировали максимально высокую чувствительность, специфичность, положительную и отрицательную прогностическую ценность, составившие 98,02, 99,48, 94,29 и 99,82% соответственно. DPG-IgA/IgG, AGA-IgA по чувствительности и специфичности уступали tTG-IgA, положительная прогностическая ценность DGP-IgG и AGA-IgA составила 34,62 и 34,21% соответственно. Худшие показатели специфичности (40,3%) и положительной прогностической ценности (12,41%) продемонстрировали AGA-IgG.
Обсуждение. Низкая прогностическая ценность положительных результатов AGA IgA и DPG IgG определяет крайне высокий процент ложноположительных результатов данных тестов. Ни в одном случае изолированного повышения AGAи DPG-антител диагноз целиакии не нашел подтверждения в условиях нормальной концентрации антител к тканевой трансглутаминазе Ig A.
Выводы. Результаты нашего исследования полностью соответствуют позиции современных клинических рекомендаций, демонстрируя максимальную диагностическую ценность антител к тканевой трансглутаминазе IgA при обследовании на целиакию. Другие антитела не рекомендованы к использованию в процессе скрининга во избежание неоправданного направления пациентов на эндоскопическое исследование и в целях снижения затрат в системе здравоохранения.
Для цитирования: Дмитриева ЮА, Захарова ИН, Османов ИМ, Гостюхина АД, Тесленко СЕ, Радченко ЕР, Миянова АР, Скоробогатова ЕВ. Диагностическая ценность серологических маркеров при целиакии у детей. Медицинский совет. 2024;18(11):180–187. https://doi.org/10.21518/ms2024-315.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Diagnostic value of serological markers for celiac disease in children
Yulia A. Dmitrieva1,2, Irina N. Zakharova1,2,
Ismail M. Osmanov2,4, Anastasia D. Gostyukhina2,
Svyatoslav E. Teslenko3, Elena R. Radchenko2,
Aliya R. Miyanova1, Ekaterina V. Scorobogatova2
1 Russian Medical Academy of Continuous Professional Education; 2/1, Bldg. 1, Barrikadnaya St., Moscow, 125993, Russia
2 Bashlyaeva Children’s City Clinical Hospital; 28, Geroev Panfilovtsev St., Moskow, 125373, Russia
3 Lomonosov Moscow State University; 1, Lenin Hills, Moscow, 119991, Russia
4 Pirogov Russian National Research Medical University; 1, Ostrovityanov St., Moscow, 117997, Russia
Introduction. Serologic tests are the main tool to screen for celiac disease. The serologic tests for tissue transglutaminase (tTG-IgA) antibodies combined with the assessment of the total serum IgA concentration is recommended as a primary test. Other serological markers, in particular IgA and/or IgG antibodies against deamidated gliadin peptides (DGP-IgG/IgA) and native gliadin (AGA-IgA/IgG), are not recommended for use in diagnosing celiac disease in immunocompetent patients.
Aim. To determine the diagnostic value of serological markers during the initial examination for celiac disease in children.
Materials and methods. The sensitivity, specificity, positive and negative predictive value of tTG-IgA/IgG, DPG-IgA/IgG, AGA-IgA/IgG were calculated for a group of 1247 children.
Results. Celiac disease was diagnosed in 101 patients of the study group. Tissue transglutaminase IgA antibodies demonstrated the highest sensitivity, specificity, positive and negative predictive values of 98.02, 99.48, 94.29 and 99.82%, respectively. DPG-IgA/IgG, AGA-IgA were inferior in sensitivity and specificity to tTG-IgA, the positive predictive value of DGP-IgG and AGA-IgA was 34.62 and 34.21%, respectively. AGA-IgG showed the worst specificity (40.3%) and positive predictive values (12.41%).
Discussion. The low predictive value of the positive results of AGA IgA and DPG IgG determines the extremely high percentage of false-positive results for these tests. In none of the cases of an isolated elevation in AGA and DPG antibodies the diagnosis of celiac disease was confirmed, if tissue transglutaminase IgA antibody concentrations were normal.
Conclusion. The results of our study are fully consistent with the position of modern clinical guidelines, demonstrating the maximum diagnostic value of tissue transglutaminase IgA antibody during examination for celiac disease. Other antibodies are not recommended for use in the screening process to avoid unnecessary referrals of patients for endoscopic examination and to reduce healthcare costs.
For citation: Dmitrieva YuA, Zakharova IN, Osmanov IM, Gostyukhina AD, Teslenko SE, Radchenko ER, Miyanova AR, Scorobogatova EV. Diagnostic value of serological markers for celiac disease in children. Meditsinskiy Sovet. 2024;18(11):180–187. (In Russ.) https://doi.org/10.21518/ms2024-315.
Conflict of interest: the authors declare no conflict of interest.
Введение
Действующие клинические рекомендации определяют целиакию как системное иммуноопосредованное заболевание, развивающееся у генетически предрасположенных лиц при регулярном употреблении глютена и характеризующееся наличием многообразия глютен-зависимых симптомов, повышением в сыворотке аутоантител, формированием атрофической энтеропатии и присутствием в генотипе HLA-DQ2/DQ8 гаплотипов [1–3]. Данное определение основано на понимании патогенеза заболевания; в нем заложены основные критерии диагностики целиакии, включающие специфические серологические маркеры и характерные гистологические изменения, выявляемые при исследовании биоптатов слизистой двенадцатиперстной кишки. Дополнительную роль в сложных диагностических случаях может иметь генетическое исследование.
Серологические методы исследования являются основным инструментом для проведения первичного скрининга в группах риска и среди пациентов, имеющих клинические проявления, настораживающие в отношении целиакии [1–3]. В настоящее время доступно определение различных типов антител – к тканевой трансглутаминазе (tTG), эндомизию (EMA), деамидированным пептидам (DPG) и нативному глиадину (AGA). Согласно действующим рекомендациям Европейского общества детских гастроэнтерологов, гепатологов и нутрициологов (ESPGHAN), в качестве первичного исследования рекомендуется определение антител к тканевой трансглутаминазе IgA в сочетании с оценкой концентрации общего IgA сыворотки [3]. Результаты зарубежных исследований продемонстрировали, что у пациентов с нормальной концентрацией общего IgA сыворотки иные маркеры (DGP-IgG, DGP-IgA, AGA-IgA) не дополняют диагностическую ценность первичного серологического исследования [4]. Кроме того, повышение антител к деамидированным пептидам и нативному глиадину у детей первых 4 лет жизни является распространенным преходящим явлением и не влияет на риск развития целиакии в последующем [5]. Антителам к эндомизию определена роль подтверждающего теста при выполнении протокола диагностики целиакии без биопсии. В качестве первичного диагностического теста исследование EMA не рекомендовано, в т.ч. потому, что в реальной клинической практике данный анализ менее доступен, а оценка титра EMA является достаточно субъективной и зависит от квалификации специалиста [1, 3, 4]. Антитела к глиадину, в особенности класса IgG, обладают крайне низкой специфичностью, что в целом не позволяет их использовать в процессе диагностики целиакии [1–4].
Несмотря на официальную позицию действующих российских и зарубежных клинических рекомендаций, исследование неспецифических антител при первичном обследовании на целиакию в России очень распространено, при этом изолированное повышение AGA и DPG часто становится основанием для направления пациентов на эндоскопическое исследование, что демонстрирует недостаточную приверженность педиатров и гастроэнтерологов к официальным протоколам диагностики целиакии и существенно увеличивает затраты в системе здравоохранения.
Цель работы – определение диагностической ценности различных серологических маркеров при первичном обследовании на целиакию у детей.
Материалы и методы
Для ретроспективного клинического исследования были отобраны истории болезни 1 482 пациентов, проходивших стационарное обследование в ДГКБ им. З.А. Башляевой в период с 01.01.2023 г. по 31.12.2023 г. и имеющих данные о концентрации антител к тканевой трансглутаминазе IgA. Из данной группы в последующем были исключены дети с ранее диагностированной целиакией (n = 175), имеющие селективный дефицит IgA (n = 19), а также пациенты, которым не проводилось эндоскопическое и гистологическое исследование (n = 41). В результате была сформирована группа из 1 247 пациентов. У 101 ребенка в ходе углубленного обследования был впервые установлен диагноз целиакии, у 1 146 детей были диагностированы другие заболевания. Диагноз целиакии у 99 пациентов был верифицирован на основании общепринятых критериев, включающих наличие глютензависимых симптомов, повышенной концентрации антител к тканевой трансглутаминазе IgA и гистологических изменений, соответствующих атрофической энтеропатии с межэпителиальным лимфоцитозом в стадии Marsh 2–3 согласно классификации Marsh – Oberhuber. У двух детей диагноз целиакии установлен при отсутствии повышения антител при наличии характерных клинических проявлений и типичных морфологических изменений, в качестве дополнительного диагностического теста в обоих случаях проводилось генетическое исследование, подтвердившее наличие типичных генов предрасположенности к заболеванию. В качестве наиболее вероятной причины серонегативной целиакии у обоих пациентов рассматривалось ограничение употребления глютена на догоспитальном этапе. В исследуемой группе были выделены пациенты с известной концентрацией иных антител – AGA-IgA (n = 233), AGA-IgG (n = 220), DPG-IgA (n = 90), DPG-IgG (n = 95). По результатам серологических тестов проведен анализ чувствительности, специфичности, положительной и отрицательной прогностической значимости как отдельных маркеров, так и совместного определения нескольких показателей. Для статистического анализа были использованы Microsoft Office Excel 2021 и STATISTICA 10.0.1011.0. Проверка на нормальность распределения проведена при помощи критерия Шапиро – Уилка. Для оценки параметров, имеющих ненормальное распределение, использовались медиана и значения 25-го и 75-го процентилей величин, непараметрический критерий Краскела – Уоллиса для определения статистической значимости различий. Оценка корреляции проводилась с использованием метода Спирмена.
Результаты
В группу исследования были включены пациенты в возрасте от 1 до 17 лет. Медиана возраста обследованных детей 8 лет (от 5 до 13 лет), доля мальчиков составила 38,81%, девочек – 61,19%.
В группе пациентов с впервые выявленной целиакией были выделены 99 пациентов с повышением tTG-IgA (n = 99). Положительный результат теста фиксировался при концентрации антител более 10 Ед/мл. Медиана концентрации антител составила 92,79 Ед/мл (40,95–170,72). У 50 детей в дебюте целиакии было определено повышение концентрации антител к тканевой трансглутаминазе IgG. Медиана уровня tTG IgG составила 23,88 Ед/мл (16,17–57,80). Статистически значимых различий концентрации антител у пациентов разных возрастных групп определено не было, однако была отмечена тенденция к более выраженному повышению концентрации tTG-IgA и IgG в дебюте целиакии у детей раннего возраста (рис. 1, табл. 1).
Рисунок 1. Возрастная динамика концентрации антител к тканевой трансглутаминазе в дебюте целиакии
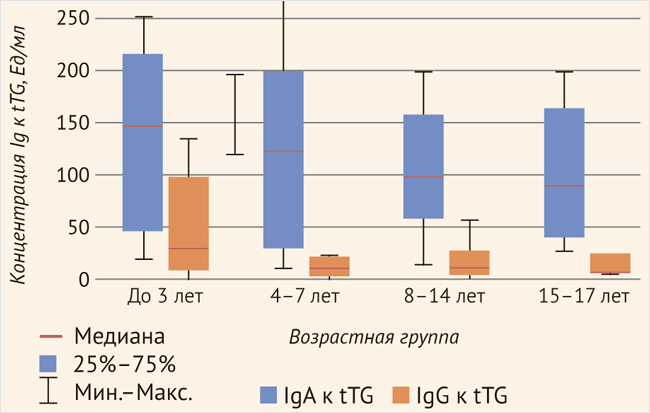
Таблица 1. Возрастные особенности концентрации антител к тканевой трансглутаминазе в дебюте целиакии
| Возрастная группа | Концентрация tTG-IgA, медиана [25–75%], Ед/мл | Концентрация tTG-IgG, медиана [25–75%], Ед/мл |
|---|---|---|
| 1–3 года | 128,76 [43,07–210,995] | 80,4 [28,49–114,74] |
| 4–7 лет | 97,34 [29,38–199,55] | 22,28 [18,99–64,45] |
| 8–14 лет | 96,05 [56,17–138,8] | 23,24 [15,31–50,9] |
| >14 лет | 70,72 [46,61–124,875] | 18,83 [12,065–24,53] |
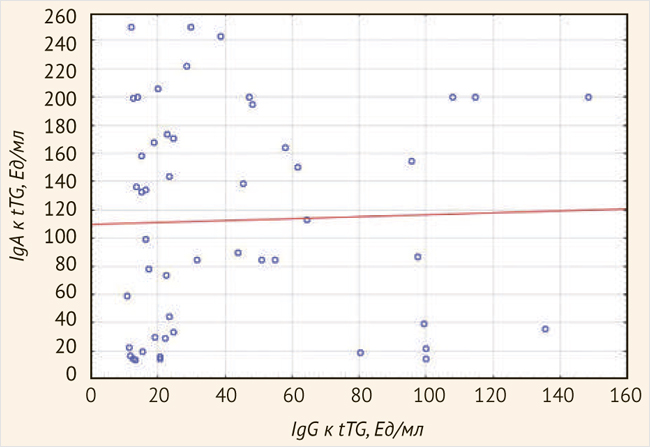
При проведении корреляционного анализа статистически значимой взаимосвязи между концентрацией tTG-IgA и IgG в дебюте заболевания у детей выявлено не было (R = 0,1428, p = 03224) (рис. 2).
Рисунок 2. Возрастная динамика концентрации антител к тканевой трансглутаминазе в дебюте целиакии
Чувствительность, специфичность, а также прогностическая ценность положительного и отрицательного результата исследования концентрации антител к тканевой трансглутаминазе представлены в табл. 2. Аналогичные параметры были рассчитаны в подгруппах пациентов с известной концентрацией антител к деамидированным пептидам и нативному глиадину.
Таблица 2. Чувствительность и специфичность серологических маркеров при целиакии
| Маркеры | Чувствительность | Специфичность | «+» прогностическая ценность | «-» прогностическая ценность |
|---|---|---|---|---|
| tTG-IgA | 98,02% | 99,48% | 94,29% | 99,82% |
| tTG-IgG | 53,19% | 93,01% | 39,37% | 95,88% |
| DPG-IgA | 77,78% | 97,53% | 77,78% | 97,53% |
| DPG-IgG | 90,00% | 80,00% | 34,62% | 98,55% |
| AGA-IgA | 72,22% | 88,37% | 34,21% | 97,44% |
| AGA-IgG | 89,47% | 40,30% | 12,41% | 97,59% |
Результаты анализа наглядно демонстрируют, что только антитела к тканевой трансглутаминазе IgA обладают одновременно высокой чувствительностью и специфичностью, что полностью соотносится с действующими рекомендациями использования данного маркера в качестве первичного диагностического теста при подозрении на целиакию. Обращает на себя внимание, что наименьшая чувствительность, специфичность и прогностическая ценность положительного результата была определена для антител к глиадину, которые, однако, продолжают использоваться в клинической практике в процессе диагностики заболевания вопреки действующим протоколам.
Для оценки дополнительной диагностической ценности неспецифических аутоантител при их совместном определении с антителами к тканевой трансглутаминазе были проанализированы результаты лабораторных исследований 298 детей, у которых при первичном скрининге было выявлено повышение хотя бы одного серологического маркера. Количество серопозитивных результатов и их взаимосвязь с подтвержденными случаями целиакии представлены в табл. 3.
Таблица 3. Диагностическая ценность различных серологических маркеров при целиакии у детей
| Маркеры | Изолированное повышение | Повышение совместно с tTG-IgA | ||
|---|---|---|---|---|
| Количество серопозитивных результатов | Диагностировано целиакии | Количество серопозитивных результатов | Диагностировано целиакии | |
| tTG-IgG | 55 | 0 | 50 | 50 |
| DPG-IgA | 2 | 0 | 7 | 7 |
| DPG-IgG | 6 | 0 | 10 | 9 |
| AGA-IgA | 2 | 0 | 15 | 15 |
| AGA-IgG | 81 | 0 | 17 | 17 |
Таким образом, полученные данные показали, что у иммунокомпетентных пациентов повышение антител к тканевой трансглутаминазе IgG, антител к деамидированным пептидам и нативному глиадину свидетельствует в пользу целиакии только тогда, когда сочетается с повышением tTG-IgA, в то время как изолированное повышение данных антител не является маркером заболевания. Соответственно, определение tTG-IgG, DPG-IgA/IgG-AGA IgA/IgG не дополняет ценности при первичной диагностике целиакии и не должно использоваться в целях сокращения затрат в системе здравоохранения и предотвращения неоправданных дальнейших инвазивных исследований.
Обсуждение
Диагностика целиакии основана на понимании патогенеза заболевания и регламентируется федеральными и зарубежными клиническими рекомендациями. В качестве первичного исследования при подозрении на глютеновую энтеропатию рекомендовано исследование антител к тканевой трансглутаминазе IgA [1–4].
Трансглутаминазы представляют собой кальций-зависимые ферменты, которые экспрессируются повсеместно, катализируют перекрестное сшивание белков внеклеточного матрикса, а также могут превращать остатки глутамина в глутаминовую кислоту посредством гидролиза (деамидирования) [6]. Многочисленные исследования показали, что фермент не распространен во внеклеточной среде при нормальных условиях, а деамидирование, опосредованное внеклеточной tTG, индуцируется лишь во время воспаления тканей [7]. В патогенезе целиакии тканевая трансглутаминаза играет важную роль в преобразовании глиадина на уровне слизистой оболочки тонкой кишки, в результате чего в пептидах формируются отрицательно заряженные участки, повышающие их аффинность (сродство) к связывающим участкам молекул HLA-DQ2 и HLA-DQ8 [8]. Пептиды глиадина являются чрезвычайно хорошими субстратами для тканевой трансглутаминазы, позволяя образовывать прочные комплексы tTG-глиадин, что вызывает активацию tTG-специфичных В-клеток и, как следствие, образование tTG-специфичных аутоантител [9–11]. Собственная пластинка слизистой оболочки тонкой кишки содержит самую большую популяцию плазматических клеток во всем организме. Большинство этих клеток секретируют Ig класса А [10]. Используя поверхностную экспрессию B-клеточного рецептора плазматическими клетками, были проведены исследования, показавшие, что на тканевую трансглутаминазу отвечают 10–20% этих клеток, в то время как лишь 1% реагирует на деамидированные пептиды глиадина [12–14]. Таким образом, идентификация антигенспецифических плазматических клеток указывает на то, что реакция B-клеток в собственной пластинке слизистой оболочки при целиакии сильно смещена в сторону образования антител именно против тканевой трансглутаминазы, а не против деамидированных пептидов и нативного глиадина. Кроме того, было показано, что сывороточные IgA вырабатываются кишечными плазматическими клетками, в то время как сывороточные IgG не секретируются IgG-плазматическими клетками кишечника и, вероятно, экспрессируются в дренирующих тонкую кишку мезентериальных лимфатических узлах, которые также подвергаются действию пептидов глиадина и тканевой трансглутаминазы [12]. Эти иммунологические аспекты и определяют максимальную чувствительность и специфичность tTG-антител класса А при целиакии. При этом, учитывая, что с целиакией в 5–10% случаев ассоциирован селективный дефицит иммуноглобулина A, концентрация общего IgA должна обязательно определяться при первичном серологическом обследовании [1–4]. Метаанализ, опубликованный в 2022 г., продемонстрировал, что исследование антител к тканевой трансглутаминазе IgA при целиакии имеет чувствительность 90,7% у взрослых и 97,7% у детей. Специфичность этого метода несколько ниже и была определена на уровне 87,4% у взрослых и 70,2% у детей [15]. В ходе нашего исследования tTG-IgAантитела продемонстрировали максимальную чувствительность (98,02%) и специфичность (99,48%) при использовании в детской популяции, что полностью соотносится с рекомендациями применения данного теста в качестве скринингового при подозрении на целиакию. Стоит отметить, что, по нашим данным, максимальная концентрация антител к тканевой трансглутаминазе в дебюте целиакии была определена у детей раннего возраста, что противоречит ранее высказанным суждениям о недостаточной эффективности использования данного серологического теста у детей первых лет жизни [1]. Несмотря на отсутствие статистически значимых различий в концентрации tTG в дебюте целиакии у детей разных возрастных групп, тенденция к максимально высокой концентрации антител у детей 1–3 лет определяет данную возрастную группу как наиболее перспективную для применения протокола диагностики целиакии без выполнения биопсии согласно критериям ESPGHAN 2012/2020 г. [3, 4].
В клинической практике антитела к тканевой трансглутаминазе IgA часто оцениваются вместе с антителами класса IgG. Согласно действующим клиническим рекомендациям оценка концентрации tTG-IgG показана при выявлении у пациентов селективного дефицита IgA [1–4, 16]. Чувствительность и специфичность данного теста при гипоIgA-состоянии достаточно высоки и варьируются в пределах 84–97 и 91–93% соответственно. Однако повышение tTG-IgG у иммунокомпетентных пациентов обладает довольно низкой прогностической ценностью положительного результата и не должно расцениваться как показание к выполнению эндоскопического исследования. Результаты ранее проведенных исследований продемонстрировали, что эффективность исследования tTG-IgG при диагностике целиакии у пациентов с неуточненным иммунологическим статусом не превышает 3% [17]. Повышение концентрации tTG-IgG может отмечаться у пациентов с воспалительными заболеваниями кишечника, ревматологическими заболеваниями, аутоиммунными эндокринопатиями (сахарный диабет 1-го типа, аутоиммунный тиреоидит), онкологическими заболеваниями [17]. По результатам нашего исследования прогностическая ценность положительного результата исследования антител к тканевой трансглутаминазе IgG не превысила 40%, при этом изолированное повышение показателя у иммунокомпетентных детей не позволило выявить ни одного случая заболевания в условиях нормальной концентрации tTG-IgA.
Антитела к эндомизию в качестве своего субстрата также имеют тканевую трансглутаминазу, расположенную в межклеточном веществе, окружающем гладкомышечные элементы собственной пластинки слизистой оболочки тонкой кишки. EMA определяются методом непрямой иммунофлуоресценции. Метод полуколичественный, имеет высокую чувствительность и специфичность, однако требует специального оборудования, а оценка результатов исследования является субъективной и зависит от квалификации специалистов [1, 2]. Результаты исследований продемонстрировали, что чувствительность ЕМА-IgA несколько уступает аналогичным показателям tTG-IgA и составляет 88,0% у взрослых и 94,5% у детей, в то время как специфичность метода существенно выше – 99,6% у взрослых и 93,8% у детей [15]. Именно поэтому в настоящее время антителам к эндомизию отводится роль подтверждающего теста при диагностике целиакии без проведения биопсии. Согласно действующим рекомендациям пациентам с симптомами, характерными для целиакии, в случае выявления значительного повышения содержания антител к тканевой трансглутаминазе IgA (более чем в 10 раз превышающего верхнюю границу нормы) рекомендовано дополнительное определение содержания антител IgA к эндомизию. В случае положительного результата проведение эндоскопического исследования с забором биоптатов слизистой двенадцатиперстной кишки для постановки диагноза не требуется, хотя может индивидуально обсуждаться с пациентами и выполняться при подозрении на сопутствующую гастроэнтерологическую патологию [4, 18, 19]. Исследование титра EMA-IgA также может быть рекомендовано при низких концентрациях tTG-IgA при первичном обследовании (менее чем трехкратное повышение относительно верхней границы нормы) во избежание неоправданного проведения биопсии. В случае позитивного результата EMA ребенка следует направить на эзофагогастродуоденоскопию с забором биоптатов слизистой оболочки двенадцатиперстной кишки. При нормальной концентрации EMA-IgA возможно продолжить наблюдение за пациентом на глютенсодержащей диете с контролем антител к тканевой трансглутаминазе через 3 мес. [4, 9, 18].
В нашем исследовании оценка диагностической ценности антител к эндомизию не проводилась ввиду малой доступности данного метода на амбулаторном и стационарном этапах обследования.
С учетом крайне низкой чувствительности и специфичности определение концентрации антител к нативному глиадину при диагностике целиакии не рекомендуется [3, 4, 18]. В настоящее время убедительно показано, что антитела к глиадину могут определяться у пациентов с воспалительными заболеваниями кишечника, пищевой аллергией, инфекционной патологией, а также у части здоровых людей при активном употреблении глютенсодержащих продуктов [4, 9, 20, 21]. В европейском многоцентровом плацебо-контролируемом интервенционном исследовании у младенцев с генетическим риском развития целиакии участникам с 4-месячного возраста регулярно выполнялось исследование антител к тканевой трансглутаминазе и глиадину IgA, аналогичные антитела класса G исследовались при выявлении дефицита Ig A. Биопсия выполнялась детям, у которых отмечалось стойкое повышение tTG-IgA, высокая концентрация AGAIgA, нарастающая в динамике, или симптомы, настораживающие в отношении целиакии независимо от результатов серологического исследования. Все IgA-компетентные дети с гистологически подтвержденным диагнозом целиакии имели повышение концентрации tTG-IgA. В то же время 17 пациентов с нормальным уровнем tTG-IgA, которым биопсия была выполнена на основании наличия симптомов или положительных результатов антиглидиновых антител, имели нормальную структуру слизистой. Транзиторное повышение антиглиадиновых антител наблюдалось у трети младенцев и не определяло риск дебюта целиакии в последующем [5]. В другом исследовании была проведена оценка дополнительной диагностической ценности AGA-IgA при совместном исследовании с антителами к тканевой трансглутаминазе у детей в возрасте до 2 лет [22]. Было протестировано 4 122 ребенка, повышение концентрации tTG-IgA или EMA-IgA было выявлено у 312 (8%) пациентов, 85 участников имели изолированное повышение AGA-IgA. Клинические данные были доступны в отношении 63 участников, результаты биопсии двенадцатиперстной кишки — у 33 детей с повышением антиглиадиновых антител. Диагноз целиакии был установлен пятерым, в то время как у 57 пациентов были выявлены заболевания, отличные от целиакии [22].
Более специфичным маркером целиакии, по сравнению с антиглиадиновыми антителами, рассматривались антитела к деамидированным пептидам глиадина. По мнению экспертов, они могут дополнить ценность серологической диагностики, особенно у детей младше 2 лет, в случае дефицита общего IgA и отрицательного результата теста на tTG-IgA [1–4, 18, 19], однако позиция действующих рекомендаций ESPGHAN указывает на то, что исследование антител к деамидированным пептидам глиадина крайне редко дополняет диагностическую ценность исследования антител к тканевой трансглутаминазе у иммунокомпетентных пациентов и не рекомендуется в качестве метода первичного скрининга на целиакию [4]. По результатам нашего исследования AGA-IgA и DPGIgG, несмотря на чувствительность и специфичность, превосходящие 72%, продемонстрировали крайне низкую прогностическую ценность положительного результата, не достигающую 35%, что демонстрирует крайне высокий процент ложноположительных результатов данных тестов. Обращает на себя внимание, что худшие показатели специфичности и положительной прогностической ценности нами были определены для антиглиадиновых антител класса IgG, которые продолжают часто использоваться при обследовании пациентов в государственных и частных лабораториях. Нами было продемонстрировано, что ни в одном случае изолированного повышения антител к нативному глиадину и деамидированным пептидам диагноз целиакии не нашел подтверждения в условиях нормальной концентрации антител к тканевой трансглутаминазе Ig A. Кроме того, ни один серологический маркер не позволил дополнить диагностическую ценность исследования tTG-IgA.
Выводы
Таким образом, результаты нашего исследования полностью соответствуют позиции современных российских и международных клинических рекомендаций и демонстрируют максимальную диагностическую ценность антител к тканевой трансглутаминазе IgA при первичном обследовании на целиакию. Другие антитела не рекомендованы к использованию в процессе скрининга на целиакию во избежание неоправданного направления пациентов на эндоскопическое исследование и в целях снижения затрат в системе здравоохранения. Стоит отметить, что обязательным требованием является проведение серологической диагностики на фоне употребления обычного количества глютенсодержащих продуктов. Ограничение количества глютена в рационе может привести к довольно быстрому снижению титра специфических антител, что сделает дальнейший диагностический поиск затруднительным, а иногда и невозможным.
Список литературы / References
Развернуть
- Боровик ТЭ, Захарова ИН, Потапов АС, Бельмер СВ, Хавкин АИ, Ревнова МО и др. Федеральные клинические рекомендации по оказанию медицинской помощи детям с целиакией. 2015. 22 с. Режим доступа: https://mosgorzdrav.ru/.
- Парфенов АИ, Маев ИВ, Баранов АА, Бакулин ИГ, Сабельникова ЕА, Крумс ЛМ и др. Всероссийский консенсус по диагностике и лечению целиакии у детей и взрослых. Альманах клинической медицины. 2016;44(6):661–688. doi: 10.18786/2072-0505-2016-44-6-661-688. / Parfenov AI, Mayev IV, Baranov AA, Bakulin IG, Sabelnikova YeA, Krums LM et al. The Russian consensus on diagnosis and treatment of coeliac disease in children and adults. Almanac of Clinical Medicine. 2016;44(6):661–668. doi: 10.18786/2072-0505-2016-44-6-661-688.
- Husby S, Koletzko S, Korponay-Szabó IR, Mearin ML, Phillips A, Shamir R et al. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease. J Pediatr Gastroenterol Nutr. 2012;54(1):136–160. doi: 10.1097/MPG.0b013e31821a23d0.
- Husby S, Koletzko S, Korponay-Szabó I, Kurppa K, Mearin ML, Ribes-Koninckx C et al. European Society Paediatric Gastroenterology, Hepatology and Nutrition Guidelines for Diagnosing Coeliac Disease 2020. J Pediatr Gastroenterol Nutr. 2020;70(1):141–156. doi: 10.1097/MPG.0000000000002497.
- Vriezinga SL, Auricchio R, Bravi E, Castillejo G, Chmielewska A, Crespo Escobar P et al. Randomized feeding intervention in infants at high risk for celiac disease. N Engl J Med. 2014;371(14):1304–1315. doi: 10.1056/NEJMoa1404172.
- Iversen R, Sollid LM. The Immunobiology and Pathogenesis of Celiac Disease. Annu Rev Pathol. 2023;18:47–70. doi: 10.1146/annurev-pathmechdis-031521-032634.
- Abadie V, Kim SM, Lejeune T, Palanski BA, Ernest JD, Tastet O et al. IL-15, gluten and HLA-DQ8 drive tissue destruction in coeliac disease. Nature. 2020;578(7796):600–604. doi: 10.1038/s41586-020-2003-8.
- Aboulaghras S, Piancatelli D, Oumhani K, Balahbib A, Bouyahya A, Taghzouti K. Pathophysiology and immunogenetics of celiac disease. Clin Chim Acta. 2022;528:74–83. doi: 10.1016/j.cca.2022.01.022.
- Al-Toma A, Volta U, Auricchio R, Castillejo G, Sanders DS, Cellier C et al. European Society for the Study of Coeliac Disease (ESsCD) guideline for coeliac disease and other gluten-related disorders. United European Gastroenterol J. 2019;7(5):583–613. doi: 10.1177/2050640619844125.
- Iversen R, Sollid LM. The Immunobiology and Pathogenesis of Celiac Disease. Annu Rev Pathol. 2023;18:47–70. doi: 10.1146/annurev-pathmechdis-031521-032634.
- Jabri B, Sollid LM. T Cells in Celiac Disease. J Immunol. 2017;198(8):3005–3014. doi: 10.4049/jimmunol.1601693.
- Iversen R, Snir O, Stensland M, Kroll JE, Steinsbø Ø, Korponay-Szabó IR et al. Strong Clonal Relatedness between Serum and Gut IgA despite Different Plasma Cell Origins. Cell Rep. 2017;20(10):2357–2367. doi: 10.1016/j.celrep.2017.08.036.
- Lindeman I, Zhou C, Eggesbø LM, Miao Z, Polak J, Lundin KEA et al. Longevity, clonal relationship, and transcriptional program of celiac disease-specific plasma cells. J Exp Med. 2021;218(2):e20200852. doi: 10.1084/jem.20200852.
- Steinsbø Ø, Henry Dunand CJ, Huang M, Huang M, Mesin L, Salgado-Ferrer M et al. Restricted VH/VL usage and limited mutations in gluten-specific IgA of coeliac disease lesion plasma cells. Nat Commun. 2014;5:4041. doi: 10.1038/ncomms5041.
- Sheppard AL, Elwenspoek MMC, Scott LJ, Corfield V, Everitt H, Gillett PM et al. Systematic review with meta-analysis: the accuracy of serological tests to support the diagnosis of coeliac disease. Aliment Pharmacol Ther. 2022;55(5):514–527. doi: 10.1111/apt.16729.
- Korponay-Szabó IR, Dahlbom I, Laurila K, Koskinen S, Woolley N, Partanen J et al. Elevation of IgG antibodies against tissue transglutaminase as a diagnostic tool for coeliac disease in selective IgA deficiency. Gut. 2003;52(11):1567–1571. doi: 10.1136/gut.52.11.1567.
- Absah I, Rishi AR, Gebrail R, Snyder MR, Murray JA. Lack of Utility of AntitTG IgG to Diagnose Celiac Disease When Anti-tTG IgA Is Negative. J Pediatr Gastroenterol Nutr. 2017;64(5):726–729. doi: 10.1097/MPG.0000000000001351.
- Giersiepen K, Lelgemann M, Stuhldreher N, Ronfani L, Husby S, Koletzko S, Korponay-Szabó IR. Accuracy of diagnostic antibody tests for coeliac disease in children: summary of an evidence report. J Pediatr Gastroenterol Nutr. 2012;54(2):229–241. doi: 10.1097/MPG.0b013e318216f2e5.
- Werkstetter KJ, Korponay-Szabó IR, Popp A, Villanacci V, Salemme M, Heilig G et al. Accuracy in Diagnosis of Celiac Disease Without Biopsies in Clinical Practice. Gastroenterology. 2017;153(4):924–935. doi: 10.1053/j.gastro.2017.06.002.
- Rubio-Tapia A, Hill ID, Kelly CP, Calderwood AH, Murray JA. ACG clinical guidelines: diagnosis and management of celiac disease. Am J Gastroenterol. 2013;108(5):656–676. doi: 10.1038/ajg.2013.79.
- Downey L, Houten R, Murch S, Longson D. Recognition, assessment, and management of coeliac disease: summary of updated NICE guidance. BMJ. 2015;351:h4513. doi: 10.1136/bmj.h4513.
- Hojsak I, Mozer-Glassberg Y, Segal Gilboa N, Weinberger R, Hartman C, Shamir R. Celiac disease screening assays for children younger than 3 years of age: the performance of three serological tests. Dig Dis Sci. 2012;57(1):127–132. doi: 10.1007/s10620-011-1857-x.








