
Журнал "Медицинский совет" №5/2024
DOI: 10.21518/ms2024-135
А.Н. Акавов1, ORCID: 0000-0002-5440-5615
Е.А. Корабельникова2, ORCID: 0000-0003-4548-0012
З.Р. Умаханова1, ORCID: 0000-0001-7084-0572
М.Л. Баранов3, ORCID: 0000-0002-0534-8343
Н.Р. Моллаева1, ORCID: 0000-0003-2332-2996
1 Дагестанский государственный медицинский университет; 367000, Россия, Республика Дагестан, Махачкала, площадь Ленина, д. 1
2 Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет); 119991, Россия, Москва, ул. Трубецкая, д. 8, стр. 2
3 Главный военный клинический госпиталь войск национальной гвардии Российской Федерации; 143914, Россия, Московская обл., Балашиха, микрорайон Никольско-Архангельский, Вишняковское шоссе, вл. 101
Введение. Инсульт является одной из основных причин заболеваемости и смертности среди населения различных популяций. Нарушения сна широко распространены у пациентов, перенесших острое нарушение мозгового кровообращения, затрудняют восстановление двигательных функций, ухудшают эмоциональное состояние, ассоциируются с худшим состоянием здоровья и качества жизни в целом.
Цель. Изучить влияние нарушений сна на эмоциональное состояние постинсультных больных.
Материалы и методы. В исследование были включены 100 человек, которые были разделены на две группы. 50 пациентов, перенесших острое нарушение мозгового кровообращения и страдающих инсомнией, составили основную группу, которая была разделена на 2 подгруппы. ОГ1 – основная подгруппа 1 (26 человек), получавшие в составе комплексной терапии курс краткосрочной (5 сеансов) когнитивно-поведенческой терапии инсомнии в сочетании с препаратом ВалокординДоксиламин 25 мг. ОГ2 – основная подгруппа 2 (24 человека), получавшие только стандартное лечение основного заболевания. Пациенты группы сравнения, перенесшие ОНМК, без сопутствующей инсомнии (ГС, 50 человек) также получали только стандартное лечение основного заболевания. В дополнение к клиническому обследованию для оценки состояния больных использовались госпитальная шкала тревоги и депрессии (HADS), Питтсбургский опросник качества сна (PSQI) и шкала тяжести инсомнии (ISI).
Результаты. Исходно по уровню депрессии (клинически выраженная депрессия) основная группа статистически значимо превосходила группу сравнения (субклинически выраженная депрессия) (U = 54,6; p = 0,012). В результате лечения в ОГ1, где проводили коррекцию инсомнии, происходило не только улучшение сна (медианные значения баллов до лечения по PSQI 8 (6; 10) и после лечения – 5 (5; 6), p = 0,022), но и снижение уровня депрессии (HADS-D до лечения: 12 (10; 14) и после лечения – 5 (4; 6), p = 0,022) и выраженности тревоги (HADS-A до лечения: 9 (7; 10) и после лечения – 5 (4; 6), p = 0,013). В ОГ2, где не проводилась коррекция инсомнии, улучшение сна не происходило (PSQI до лечения 8 (6; 11), после лечения – 8 (7; 10), p = 0,433), редукция уровня депрессии (HADS-D до лечения: 9 (8; 11) и после лечения – 8 (6; 9), p = 0,171) и тревоги (HADS-A до лечения: 9 (6; 10) и после лечения – 8 (6; 9), p = 0,064) отмечалась в меньшей степени, чем в ОГ1 ГС (HADS-D: H (2, N = 100) = 25,73829, p = 0,016; HADS-A: H (2, N = 100) = 28,42621, p = 0,004).
Выводы. Проведенная комплексная терапия пациентов, перенесших инсульт, страдающих инсомнией, включающая лекарственные и нелекарственные методы коррекции инсомнии, повышает эффективность лечения за счет не только улучшения качества сна, но и снижения выраженности тревоги и депрессии.
Для цитирования: Акавов АН, Корабельникова ЕА, Умаханова ЗР, Баранов МЛ, Моллаева НР. Влияние инсомнии и ее коррекции на эмоциональное состояние постинсультных больных. Медицинский совет. 2024;18(5):90–97. https://doi.org/10.21518/ms2024-135.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Influence of insomnia and its correction on the emotional state of post-stroke patients
Adilkhan N. Akavov1, ORCID: 0000-0002-5440-5615
Elena A. Korabelnikova2, ORCID: 0000-0003-4548-0012
Zoya R. Umakhanova1, ORCID: 0000-0001-7084-0572
Maksim L. Baranov3, ORCID: 0000-0002-0534-8343
Naida R. Mollaeva1, ORCID: 0000-0003-2332-2996
1 Dagestan State Medical University; 1, Lenin Square, Makhachkala, Republic of Dagestan, 367000, Russia
2 Sechenov First Moscow State Medical University (Sechenov University); 8, Bldg. 2, Trubetskaya St., Moscow, 119991, Russia
3 Main Military Clinical Hospital of the National Guard Forces; 101, Vishnyakovskoye Shosse, Nikolsko-Arkhangelsky Microdistrict, Balashikha, Moscow Region, 143914, Russia
Introduction. Stroke is a major cause of morbidity and mortality in various populations. Sleep disturbances are common in patients who have suffered an acute cerebral circulatory disorder, complicating the recovery of motor functions, worsening the emotional state and being associated with poorer health and quality of life in general.
Aim. To investigate the impact of sleep disturbance on the emotional state of stroke patients.
Materials and methods. The study included 100 people who were divided into two groups. 50 patients who had suffered an acute cerebral circulatory disorder and who suffered from insomnia formed the main group, which was divided into 2 subgroups. MG1 – main subgroup 1 (26 people), who received a course of short-term (5 sessions) cognitive-behavioural therapy for insomnia in combination with the drug Valocordin-Doxylamine 25 mg as part of complex therapy. – MG2 main subgroup 2 (24 people), who received only standard treatment of the main disease. Patients in the comparison group who underwent acute cerebral circulatory disorder without concomitant insomnia (CG, 50 people) also received only standard treatment for the primary condition. In addition to clinical examination, the Hospital Anxiety and Depression Scale (HADS), the Pittsburgh Sleep Quality Questionnaire (PSQI) and the Insomnia Severity Scale (ISI) were used to assess patients.
Results. Initially, the main group had a statistically significant higher level of depression (clinically expressed depression) than the comparison group (subclinically expressed depression) (U = 54.6; p = 0.012). As a result of treatment in main subgroup 1, where insomnia was corrected, there was not only an improvement in sleep (median PSQI score before treatment 8 (6; 10) and after treatment 5 (5; 6), p = 0.022), but also a reduction in depression (HADS-D score before treatment 12 (10; 14) and after treatment 12 (10; 14)): 12 (10; 14) and post-treatment – 5 (4; 6), p = 0.022) and anxiety (HADS-A pre-treatment: 9 (7; 10) and post-treatment – 5 (4; 6), p = 0.013). In the main subgroup 2, where insomnia was not corrected, there was no improvement in sleep (PSQI before treatment 8 (6; 11) and after treatment 8 (7; 10), p = 0.433), depression (HADS-D before treatment: 9 (8; 11) and after treatment – 8 (6; 9), p = 0.171) and anxiety (HADS-A before treatment: 9 (6; 10) and after treatment – 8 (6; 9), p = 0.064) were less pronounced than in the main subgroup 1 and the comparison group (HADS-D: H (2, N = 100) = 25.73829, p = 0.016; HADS-A: H (2, N = 100) = 28.42621, p = 0.004).
Conclusion. Complex therapy for stroke patients suffering from insomnia, including drug and non-drug methods of insomnia correction, increases the effectiveness of treatment by not only improving the quality of sleep, but also reducing the severity of anxiety and depression.
For citation: Akavov AN, Korabelnikova EA, Umakhanova ZR, Baranov ML, Mollaeva NR. Influence of insomnia and its correction on the emotional state of post-stroke patients. Meditsinskiy Sovet. 2024;18(5):90–97. (In Russ.) https://doi.org/10.21518/ms2024-135.
Conflict of interest: the authors declare no conflict of interest.
Введение
Сон имеет фундаментальное значение для физического и психического благополучия человека [1–3]. Расстройства сна и бодрствования широко распространены среди населения в целом и оказывают серьезное влияние на общее состояние здоровья, эмоциональное состояние, работоспособность и качество жизни [4, 5]. Расстройства сна тесно взаимосвязаны с сердечно-сосудистыми заболеваниями и повышают риск развития цереброваскулярных событий [6–8], которые, в свою очередь, считаются одной из основных причин заболеваемости и смертности среди населения различных популяций. При этом инсомния является значимым фактором, затрудняющим восстановление двигательных функций и снижающим качество жизни этой категории пациентов [9–12]. Недавний метаанализ исследований электрофизиологических коррелятов сна у пациентов, перенесших инсульт, показал для данной категории пациентов существенно более низкое качество сна, чем у здоровых лиц, что выражалось в показателях эффективности, времени сна и пробуждения после начала сна [13].
По некоторым данным, частота инсомнии у пациентов, перенесших инсульт, составляет 20–56% [14, 15]. У 18% пациентов инсомния впервые возникает после перенесенного инсульта [16, 17].
Предикторами развития инсомнии после инсульта являются локализация инсульта, факторы окружающей среды (госпитализация, незнакомая обстановка, потеря непрерывного сна и побочные эффекты лекарств), эмоциональные нарушения [6]. Показано, что инсомния после перенесенного инсульта повышает тревожность, снижает уровень энергии в дневное время, ухудшает концентрацию внимания и память и отрицательно сказывается на работоспособности во время реабилитации [18, 19].
Есть данные о том, что изменения в циркадном ритме, особенно в цикле «сон – бодрствование», приводящие к фрагментации и снижению эффективности сна, коррелируют с развитием постинсультной апатии, которая определяется как синдром снижения целенаправленного поведения и включает отсутствие мотивации, эмоций и интереса к жизни [20–22].
Наличие бессонницы у пациентов, перенесших инсульт, связано с выраженностью не только тревоги и депрессии [23, 24], но и когнитивных нарушений и оказывает негативное влияние на функциональное восстановление и возвращение к работе [25–29].
Целью нашего исследования было изучение влияния нарушений сна на эмоциональное состояние постинсультных больных.
Материалы и методы
Проведено проспективное когортное исследование 100 пациентов, перенесших острое нарушение мозгового кровообращения (ОНМК). Изучалось влияние инсомнии и ее коррекции на эмоциональную сферу этих больных. Средний возраст пациентов составил 63,5 ± 7,3 лет. Гендерный состав был представлен 44% женщин и 56% мужчин.
Вошедшие в исследование пациенты были разделены на две группы. 50 пациентов, перенесших ОНМК и страдающих инсомнией, составили основную группу. Эта группа простым выбором по правилу случайной выборки в программе Statistica 12 была разделена на 2 подгруппы. ОГ1 – основная подгруппа 1 (26 человек), получали в составе комплексной терапии не только стандартную терапию основного заболевания: антиоксиданты (актовегин, милдронат), нейропротекторы (церебролизин, цитиколин), антикоагулянты, антиагреганты, по показаниям ноотропные препараты (пирацетам, фенотропил), средства, влияющие на холинергическую (холина альфосцерат), глутаматергическую (акатинол мемантин) системы, – но и курс краткосрочной (5 сеансов с периодичностью 1 встреча каждые 2 дня) когнитивно-поведенческой терапии инсомнии (КПТ-И) в сочетании с препаратом Валокордин-Доксиламин 25 мг за 15– 30 мин до сна в течение 10 дней.
Валокордин-Доксиламин – удобная форма доксиламина сукцината, предложенная германской компанией «Кревель Мойзельбах». В 1 мл (22 капли) препарата содержится 25 мг доксиламина сукцината. Препарат имеет запах мяты, обеспечивающий дополнительный седативный эффект. Из всех антигистаминных снотворных доксиламин наиболее удобен для применения в клинической практике, особенно для лечения острых и симптоматических нарушений сна. Он обладает хорошим профилем эффективности и безопасности, включен в отечественные рекомендации по лечению инсомнии.
ОГ2 – основная подгруппа 2 (24 человека), получали только стандартное лечение основного заболевания, которое не отличалось от терапии получаемой пациентами ОГ1.
Пациенты группы сравнения (ГС, 50 человек) также получали только стандартное лечение основного заболевания.
Критерии включения в основную группу: возраст от 40 до 70 лет, наличие перенесенного ОНМК, подтвержденного методами нейровизуализации (КТ/МРТ головного мозга), установленный диагноз хронической инсомнии согласно критериям 3-й версии Международной классификации расстройств сна (МКРС-3).
Критерии включения в группе сравнения были аналогичны таковым для основной группы, за исключением наличия у пациентов инсомнии.
Из исследования исключались пациенты, принимавшие препараты, влияющие на сон, как минимум за 1 нед. до начала и на весь период исследования; злоупотреблявшие лекарственными средствами, алкоголем, наркотическими веществами в анамнезе; имеющие эндогенные психические и сопутствующие неврологические заболевания, деменцию и выраженные органические расстройства, соматические заболевания в стадии обострения или декомпенсации.
Использовались следующие методы: клинико-анамнестический, психометрический (госпитальная шкала тревоги и депрессии HADS-A, HADS-D), оценка качества сна, а также статистический метод. Качество сна оценивалось с помощью Питтсбургского опросника качества сна – PSQI, по результатом которого сумма баллов более 5 оценивалась как низкое качество сна, а 5 и менее баллов характеризовало удовлетворительный сон, а также шкалу тяжести инсомнии – ISI, выделяющую следующие критерии тяжести инсомнии: 0–7 баллов – норма; 8–14 баллов – легкие нарушения сна; 15–21 – умеренные; 22–28 – выраженные нарушения сна.
Статистическая обработка данных осуществлялась с помощью пакета программ StatSoft, Inc. (2014 г.), STATISTICA (data analysis software system), version 12. Статистический анализ заключался в предварительной оценке нормальности распределения количественных переменных с помощью критериев Колмогорова – Смирнова с поправкой Лиллиефорса и Шапиро – Уилка. Для описания количественных переменных с распределением, отличным от нормального, применялись медиана и интерквартильные размахи в виде Ме (25%; 75%). Категориальные и ранговые переменные были представлены как количество случаев ‒ абсолютное число (N) и удельный вес ‒ относительное число (%). Среди других критериев применялись: критерий U Манна – Уитни (оценка межгрупповых различий в несвязанных выборках по количественным переменным), критерий Уилкоксона (оценка различий между двумя зависимыми группами), критерий Краскела – Уоллиса (изучение различий между тремя независимыми группами), критерий Мак-Немара (сравнение долей пациентов в зависимых группах). Уровень критической значимости α, при котором отвергалась нулевая гипотеза, был равен 0,05.
Результаты
Для оценки качества сна в ОГ1 и ОГ2 пациенты основной группы были протестированы с помощью опросников PSQI и ISI. Медианные значения баллов по PSQI в ОГ1 составили 8 (6; 10) и 8 (6; 11) в ОГ2, что свидетельствовало о низком качестве сна.
Опросник ISI до лечения также в среднем показал легкие нарушения сна в ОГ1 и ОГ2. В ГС медианные значения по опросникам PSQI и ISI находились в диапазоне нормальных значений, что соответствовало отсутствию жалоб на нарушения сна у этих пациентов.
Оценка эмоционального состояния пациентов клинических групп до лечения показала субклинически выраженную тревогу без статистически незначимых различий между клиническими группами: H (2, N = 100) = 3,012175, p = 0,429. По уровню депрессии (клинически выраженная депрессия) основная группа статистически значимо превосходила группу сравнения (субклинически выраженная депрессия) (U = 54,6; p = 0,012).
Полученные результаты позволили высказать предположение, что инсомния ухудшает эмоциональное состояние пациентов, перенесших ОНМК, что проявляется в повышении у них уровня депрессии.
При анализе результатов лечения инсомнии в основной группе были получены следующие данные. Сравнительные результаты опросника PSQI указывают на статистически значимую (p = 0,022; критерий Уилкоксона) положительную динамику качества сна у пациентов ОГ1 после лечения (рис. 1).
Рисунок 1. Сравнительные данные опросника ISI в клинических группах до и после лечения
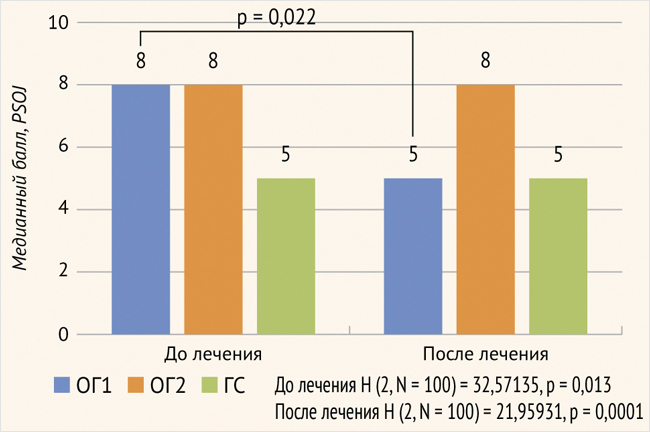
ОГ1 – основная подгруппа 1; ОГ2 – основная подгруппа 2; ГС – группа сравнения; различия между клиническими группами до лечения/после лечения статистически значимы при p < 0,05 (критерий Краскела – Уоллиса); различия между зависимыми группами до и после лечения (критерий Уилкоксона) статистически значимы при p < 0,05
Похожий результат был получен по данным опросника ISI, который показал статистически значимое улучшение качества сна у пациентов ОГ1 после лечения до уровня нормальных значений (p = 0,0221; критерий Уилкоксона) (рис. 2).
Рисунок 2. Сравнительные данные опросника ISI в клинических группах до и после лечения
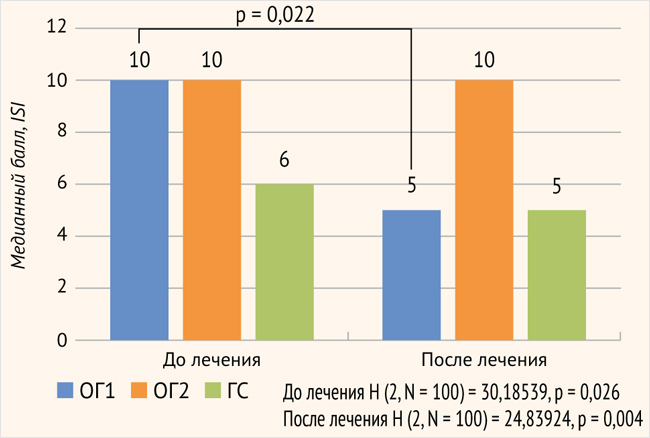
ОГ1 – основная подгруппа 1; ОГ2 – основная подгруппа 2; ГС – группа сравнения; различия между клиническими группами до лечения/после лечения статистически значимы при p < 0,05 (критерий Краскела – Уоллиса); различия между зависимыми группами до и после лечения (критерий Уилкоксона) статистически значимы при p < 0,05
У пациентов ОГ2, не получавших коррекцию инсомнии, так же как и у пациентов ГС, после проведенного лечения показатели сна достоверно не менялись. Из полученных данных можно сделать вывод, что примененная фармакологическая и психотерапевтическая коррекция инсомнии у пациентов ОГ1 улучшает качество сна, что подтверждается статистически значимыми различиями в значениях до и после лечения.
Анализ результатов опросника HADS-А после лечения с применением критерия Краскела – Уоллиса выявил статистически значимую редукцию уровня тревоги у пациентов ОГ1 и ГС до и после лечения (HADS-A ОГ1 до лечения: 9 (7; 10) и после лечения – 5 (4; 6), p = 0,013; HADSAГС до лечения: 9 (7; 10) и после лечения – 7 (6; 8), p = 0,028), при статистической значимости различий (H (2, N = 100) = 28,42621, p = 0,004) (рис. 3). Проведение попарных сравнений с использованием критерия Манна – Уитни в группах ОГ1 и ГС показало положительную статистически значимую динамику (снижение) значений выраженности тревоги. Причем более выраженное статистически значимое улучшение состояния наблюдалось в ОГ1 в сравнении с ГС (p = 0,003; коэффициент Манна – Уитни). В ОГ2 по данному показателю также наблюдалась положительная динамика, однако снижение уровня тревоги в данном случае было статистически незначимым (рис. 3).
Рисунок 3. Сравнительная оценка эмоционального состояния в клинических группах до и после лечения по шкале HADS-A
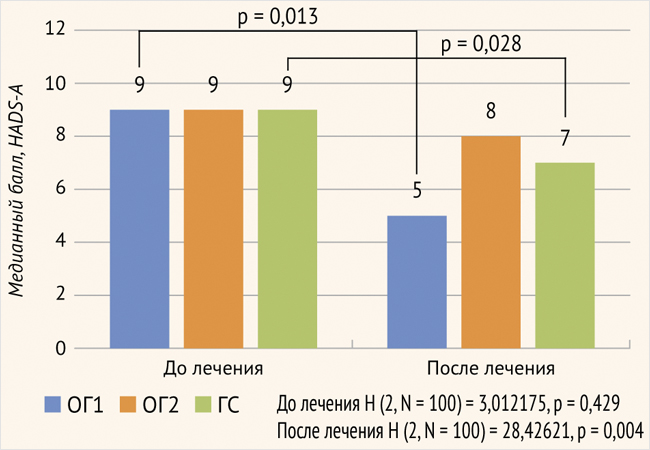
ОГ1 – основная подгруппа 1; ОГ2 – основная подгруппа 2; ГС – группа сравнения; различия между клиническими группами до лечения/после лечения статистически значимы при p < 0,05 (критерий Краскела – Уоллиса); различия между зависимыми группами до и после лечения (критерий Уилкоксона) статистически значимы при p < 0,05
Анализ результатов опросника HADS-D после лечения с применением критерия Краскела – Уоллиса выявил статистически значимые различия (H (2, N = 100) = 25,73829, p = 0,016) (рис. 4).
Рисунок 4. Сравнительная оценка эмоционального состояния в клинических группах до и после лечения по шкале HADS-D
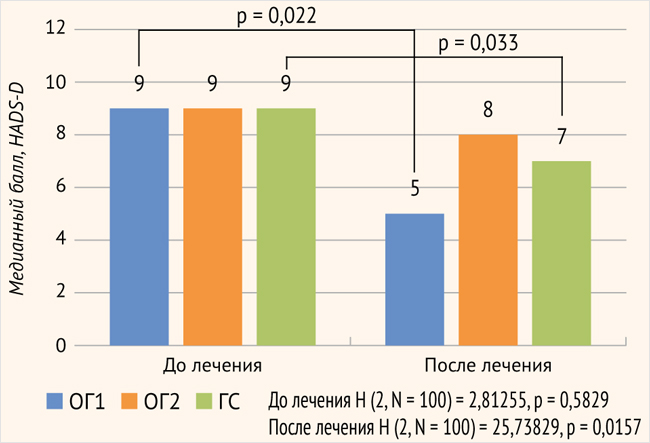
ОГ1 – основная подгруппа 1; ОГ2 – основная подгруппа 2; ГС – группа сравнения; различия между клиническими группами до лечения/после лечения статистически значимы при p < 0,05 (критерий Краскела – Уоллиса); различия между зависимыми группами до и после лечения (критерий Уилкоксона) статистически значимы при p < 0,05
Различия в уровне депрессии в ОГ1 до и после лечения и в ГС до и после лечения также были статистически значимы (HADS-D ОГ1 до лечения: 12 (10; 14) и после лечения – 5 (4; 6), p = 0,022; HADS-D ГС до лечения: 9 (8; 11) и после лечения – 7 (5; 7), p = 0,033) при статистической значимости различий по критерию Краскела – Уоллиса (H (2, N = 100) = 25,73829, p = 0,016) (рис. 4). Результаты распределения пациентов по степени тяжести тревоги/депрессии по HADS-A и HADS-D до и после лечения представлены на рис. 5. Наиболее выраженная положительная статистически значимая динамика наблюдалась в ОГ1 по сравнению с ОГ2 и ГС. Свидетельством тому является увеличение после лечения в ОГ1 пациентов с нормальным уровнем тревоги (менее 7 баллов) до 75%, снижение доли пациентов с субклинической депрессией до 25% и отсутствие пациентов с клинически выраженной тревогой. В ОГ2 наблюдалась наименее выраженная положительная статистически незначимая динамика уровня тревоги.
Рисунок 5. Распределение пациентов по степени тяжести тревоги / депрессии по HADS-A и HADS-D в клинических группах до и после лечения
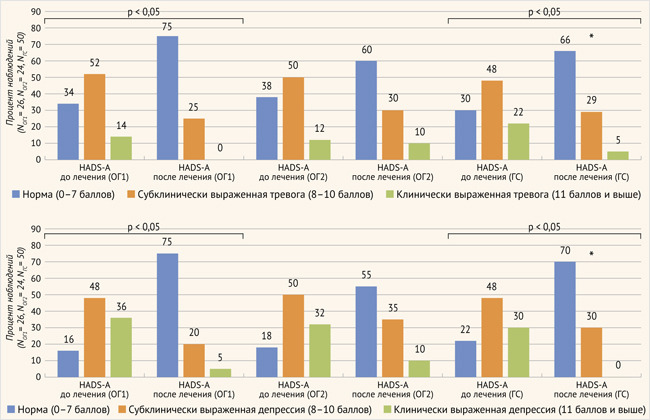
ОГ1 – основная подгруппа 1; ОГ2 – основная подгруппа 2; ГС – группа сравнения.
* Статистически значимые различия между ОГ1 и ГС после лечения (критерий χ2-Пирсона); квадратными горизонтальными скобками указаны различия между зависимыми группами (до/после лечения; критерий Мак-Немара)
При рассмотрении распределения долей пациентов по категориям тяжести депрессии можно отметить, что после лечения наиболее выраженная динамика уровня депрессии (снижение) наблюдалась в ОГ1 и ГС. Доля пациентов с нормальным уровнем по шкале депрессии после лечения в ОГ1 составила 75%, в ОГ2 – 55%, а в группе сравнения – 70%. При этом доля пациентов ОГ2 с субклинически выраженной депрессией была сравнима с таковой у пациентов ГС. Доля пациентов со значениями уровня субклинически выраженной депрессии в ОГ1 была ниже, чем у пациентов ОГ2 и ГС, и статистически значимо отличалась от долей пациентов ОГ2 (критерий Манна – Уитни; p = 0,009) и ГС (критерий Манна – Уитни; p = 0,003) с аналогичным уровнем депрессии. Несмотря на общую положительную динамику, более значительную в ОГ1, чем в ОГ2 и ГС, у 5% пациентов ОГ1 и у 10% пациентов ОГ2 после лечения выявлялась клинически выраженная депрессия, чего не наблюдалось в ГС. Различия между клиническими группами после лечения были статистически значимыми (H (2, N = 100) = 25,73829, p = 0,016) (рис. 5).
Таким образом, лечение основного заболевания в комбинации с методами, направленными на коррекцию инсомнии, позволило снизить степень эмоциональных нарушений до уровня нормальных значений, чего не произошло в клинической группе пациентов с инсомнией, получавших только стандартное лечение. Следовательно, непролеченная инсомния негативно влияет на эмоциональное состояние пациентов, что может снижать эффективность терапии основного заболевания.
Обсуждение
По данным ряда авторов, тревожно-депрессивная симптоматика имеет место приблизительно у трети пациентов, перенесших сосудистую катастрофу [30–32].
Полученные нами результаты указывают на очевидную зависимость выраженности эмоциональных нарушений, как тревожных, так и депрессивных, у пациентов, перенесших инсульты, от наличия сопутствующей инсомнии. Вместе с тем эмоциональное состояние на фоне лечения также лучше восстанавливалось у пациентов, получавших в составе комплексной терапии не только стандартную терапию основного заболевания, но и курс краткосрочной (5 сеансов с периодичностью 1 встреча каждые 2 дня) когнитивно-поведенческой терапии инсомнии. Такая терапия позволяла снизить уровень тревоги и депрессии до нормальных значений, чего не отмечалось в клинической группе пациентов с инсомнией, получавших только стандартное лечение.
Несмотря на проведенное лечение, среди пациентов обеих подгрупп основной группы после лечения обнаруживались пациенты с субклинически и клинически выраженной депрессией, в отличие от группы сравнения, где таких пациентов не было.
Существуют различные взгляды на взаимосвязь эмоциональных нарушений и расстройств сна. Чаще всего расстройства сна рассматривают как первичные и приводящие к формированию тревожных и депрессивных расстройств [33, 34]. В условиях коморбидности основного заболевания (перенесенного острого нарушения мозгового кровообращения) и инсомнии эмоциональные расстройства выступают как посредник между данными состояниями, усиливая и усложняя их взаимовлияние.
Выводы
Таким образом, наличие инсомнии у пациентов, перенесших инсульт, негативно влияет на эмоциональное состояние, снижает эффективность терапии основного заболевания и требует применения мероприятий, направленных на ее коррекцию. Комплексная терапия таких пациентов, включающая применение лекарственной и нелекарственной терапии нарушений сна, улучшает эмоциональное состояние больных и повышает эффективность лечения.
Список литературы / References
Развернуть
- Luyster FS, Strollo PJ Jr, Zee PC, Walsh JK. Sleep: A health imperative. Sleep. 2012;35(6):727–734. doi: 10.5665/sleep.1846.
- Mason GM, Lokhandwala S, Riggins T, Spencer RMC. Sleep and human cognitive development. Sleep Med Rev. 2021;57:101472. doi: 10.1016/j.smrv.2021.101472.
- Troynikov O, Watson CG, Nawaz N. Sleep environments and sleep physiology: A review. J Therm Biol. 2018;78:192–203. doi: 10.1016/j.jtherbio.2018.09.012.
- Ancoli-Israel S, Roth T. Characteristics of insomnia in the United States: results of the 1991 National Sleep Foundation Survey. I. Sleep. 1999;22(Suppl. 2):347‒353. Available at: https://pubmed.ncbi.nlm.nih.gov/.
- Aernout E, Benradia I, Hazo J-B, Sy A, Askevis-Leherpeux F, Sebbane D, Roelandt J-L. International study of the prevalence and factors associated with insomnia in the general population. Multicenter Study Sleep Med. 2021;82:186‒192. doi: 10.1016/j.sleep.2021.03.028.
- Ferre A, Ribó M, Rodríguez-Luna D, Romero O, Sampol G, Molina CA, Álvarez-Sabin J. Strokes and their relationship with sleep and sleep disorders. Neurologia. 2013;28(2):103–118. doi: 10.1016/j.nrl.2010.09.016.
- Javaheri S, Redline S. Insomnia and Risk of Cardiovascular Disease. Chest. 2017;152(2):435–444. doi: 10.1016/j.chest.2017.01.026.
- Andersen ML, Poyares D, Tufik S. Insomnia and cardiovascular outcomes. Sleep Sci. 2021;14(1):1–2. doi: 10.5935/1984-0063.20200109.
- Курушина ОВ, Барулин АЕ. Куракова ЕА, Сарай РС. Лечение инсомнии у пациентов с цереброваскулярными заболеваниями. Медицинский совет. 2018;(9):20–24. doi: 10.21518/2079-701X-2018-9-20-24. / Kurushina OV, Barulin AE, Kurakova EA, Saray RS. Insomnias in patients with cerebrovascular disorders. Meditsinskiy Sovet. 2018;(9):20–24. (In Russ.) doi: 10.21518/2079-701X-2018-9-20-24.
- Hermann DM, Bassetti CL. Role of sleep-disordered breathing and sleep-wake disturbances for stroke and stroke recovery. Neurology. 2016;87(13):1407–1416. doi: 10.1212/wnl.0000000000003037.
- Cai H, Wang XP, Yang GY. Sleep Disorders in Stroke: An Update on Management. Aging Dis. 2021;12(2):570–585. doi: 10.14336/AD.2020.0707.
- Matas A, Amaral L, Patto AV. Is post-ischemic stroke insomnia related to a negative functional and cognitive outcome? Sleep Med. 2022;94:1–7. doi: 10.1016/j.sleep.2022.03.022.
- Baglioni C, Nissen C, Schweinoch A, Riemann D, Spiegelhalder K, Berger M et al. Polysomnographic Characteristics of Sleep in Stroke: A Systematic Review and Meta-Analysis. PLoS ONE. 2016;11(3):e0148496. doi: 10.1371/journal.pone.0148496.
- Kim KT, Moon HJ, Yang JG, Sohn SI, Hong JH, Cho YW. The prevalence and clinical significance of sleep disorders in acute ischemic stroke patients – a questionnaire study. Sleep Breath. 2017;21(3):759–765. doi: 10.1007/s11325-016-1454-5.
- Baylan S, Griffiths S, Grant N, Broomfield NM, Evans JJ, Gardani M. Incidence and prevalence of post-stroke insomnia: A systematic review and meta-analysis. Sleep Med Rev. 2020;49:101222. doi: 10.1016/j.smrv.2019.101222.
- Joa KL, Kim WH, Choi HY, Park CH, Kim ES, Lee SJ et al. The effect of sleep disturbances on the functional recovery of rehabilitation inpatients following mild and moderate stroke. Am J Phys Med Rehabil. 2017;96(10):734–740. doi: 10.1097/PHM.0000000000000744.
- Bassetti CLA, Randerath W, Vignatelli L, Ferini-Strambi L, Brill AK, Bonsignore MR et al. EAN/ERS/ESO/ESRS statement on the impact of sleep disorders on risk and outcome of stroke. Eur Respir J. 2020;55(4):1901104. doi: 10.1183/13993003.01104-2019.
- Campbell Burton CA, Murray J, Holmes J, Astin F, Greenwood D, Knapp P. Frequency of anxiety after stroke: a systematic review and meta-analysis of observational studies. Int J Stroke. 2013;8(7):545–559. doi: 10.1111/j.1747-4949.2012.00906.x.
- Hasan F, Muhtar MS, Wu D, Lee HC, Fan YC, Chen TJ, Chiu HY. Post-Stroke Insomnia Increased the Risk of Cognitive Impairments: A Hospital-Based Retrospective Cohort Study. Behav Sleep Med. 2023;21(6):802–810. doi: 10.1080/15402002.2023.2165491.
- Arzt M, Young T, Finn L, Skatrud JB, Bradley TD. Association of sleep-disordered breathing and the occurrence of stroke. Am J Respir Crit Care Med. 2005;172(11):1447–1451. doi: 10.1164/rccm.200505-702oc.
- Tay J, Morris RG, Markus HS. Apathy after stroke: Diagnosis, mechanisms, consequences, and treatment. Int J Stroke. 2021;16(5):510–518. doi: 10.1177/1747493021990906.
- Douven E, Köhler S, Rodriguez MMF, Staals J, Verhey FRJ, Aalten P. Imaging Markers of Post-Stroke Depression and Apathy: a Systematic Review and Meta-Analysis. Neuropsychol Rev. 2017;27(3):202–219. doi: 10.1007/s11065-017-9356-2.
- Гоголева АГ, Захаров ВВ. Тревожно-депрессивные расстройства у пациентов после инсульта: распространенность, подходы к диагностике и терапии. Эффективная фармакотерапия. 2019;15(34):36–44. doi: 10.33978/2307-3586-2019-15-34-36-44. / Gogoleva A.G., Zakharov V.V. Anxiety-depressive disorders in patients after stroke: prevalence, approaches to diagnosis and therapy. Effective Pharmacotherapy. 2019;15(34):36–44. (In Russ.) doi: 10.33978/2307-3586-2019-15-34-36-44.
- Бойко АН, Лебедева АВ, Щукин ИА, Солдатов МА, Петров СВ, Хозова АА и др. Эмоциональные расстройства и качество жизни у пациентов с постинсультной астенией. Журнал неврологии и психиатрии им. С.С. Корсакова. 2013;113(11):27–33. Режим доступа: https://www.mediasphera.ru/. / Boĭko AN, Lebedeva AV, Shchukin IA, Soldatov MA, Petrov SV, Khozova AA et al. Emotional disorders and quality of life in patients with post stroke asthenia. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2013;113(11):27–33. (In Russ.) Available at: https://www.mediasphera.ru/.
- Duss SB, Seiler A, Schmidt MH, Pace M, Adamantidis A, Müri RM, Bassetti CL. The role of sleep in recovery following ischemic stroke: a review of human and animal data. Neurobiol Sleep Circadian Rhythms. 2016;2:94–105. doi: 10.1016/j.nbscr.2016.11.003.
- Tang WK, Grace LC, Mok V, Ungvari GS, Wong KS. Insomnia and health-related quality of life in stroke. Top Stroke Rehabil. 2015;22:201–207. doi: 10.1179/1074935714z.0000000026.
- Glozier N, Moullaali TJ, Sivertsen B, Kim D, Mead G, Jan S et al. The course and impact of poststroke insomnia in stroke survivors aged 18 to 65 years: results from the Psychosocial Outcomes In Stroke (POISE) study. Cerebrovasc Dis Extra. 2017;7(1):9–20. doi: 10.1159/000455751.
- Klingman KJ, Skufca JD, Duncan PW, Wang D, Fulk GD. Study Protocol: Sleep Effects on Poststroke Rehabilitation Study. Nurs Res. 2022;71(6):483–490. doi: 10.1097/NNR.0000000000000611.
- Sachdev PS. Post-Stroke Cognitive Impairment, Depression and Apathy: Untangling the Relationship. Am J Geriatr Psychiatry. 2018;26(3):301–303. doi: 10.1016/j.jagp.2017.12.002.
- Hackett ML, Pickles K. Part I: frequency of depression after stroke: an updated systematic review and meta-analysis of observational studies. Int J Stroke. 2014;9(8):1017–1025. doi: 10.1111/ijs.12357.
- Hackett ML, Anderson CS. Predictors of depression after stroke: a systematic review of observational studies. Stroke. 2005;36(10):2296–2301. doi: 10.1161/01.str.0000183622.75135.a4.
- Mitchell AJ, Sheth B, Gill J, Yadegarfar M, Stubbs B, Yadegarfar M, Meader N. Prevalence and predictors of post-stroke mood disorders: A meta-analysis and meta-regression of depression, anxiety and adjustment disorder. Gen Hosp Psychiatry. 2017;47:48–60. doi: 10.1016/j.genhosppsych.2017.04.001.
- Leahy E, Gradisar M. Dismantling the bidirectional relationship between paediatric sleep and anxiety. Clinical Psychologist. 2012;16(1):44–56. doi: 10.1111/j.1742-9552.2012.00039.x.
- Полуэктов МГ, Пчелина ПВ. Расстройства сна и тревога. Эффективная фармакотерапия. 2017;(35):80–89. Режим доступа: https://www.elibrary.ru/. / Poluektov MG, Pchelina PV. Sleep disorders and anxiety. Effective Pharmacotherapy. 2017;(35):80–89. (In Russ.) Available at: https://www.elibrary.ru/.








