
Л.М. АНТОНЕНКО, к.м.н., Н.В. БЕСТУЖЕВА, В.А. ПАРФЕНОВ, д.м.н., профессор, Кафедра нервных болезней и нейрохирургии Первого МГМУ им. И.М. Сеченова
Проведено пострегистрационное, открытое, рандомизированное, сравнительное исследование клинической эффективности и безопасности препаратов бетагистина Вестикап и Бетасерк у пациентов с вестибулярным головокружением. В наблюдение были включены 62 пациента, соответствовавшие критериям включения, 17 мужчин и 45 женщин, средний возраст участников -- 47 ± 13,1 лет. Программу лечения завершили все 62 пациента. Значимый клинический эффект в виде уменьшения тяжести головокружения по шкале выраженности головокружения и улучшения качества жизни по шкале снижения качества жизни вследствие головокружения DHI был получен при приеме обоих препаратов. Достоверных различий в эффективности, переносимости и безопасности при лечении препаратами Вестикап и Бетасерк, не выявлено.
Лечение головокружения -- одна из актуальных проблем практического здравоохранения. Жалоба на головокружение -- причина обращения около 10% пациентов на амбулаторном приеме невролога или оториноларинголога [1, 4, 8]. Наиболее частые причины головокружения: доброкачественное пароксизмальное позиционное головокружение (ДППГ), фобическое постуральное головокружение, синдром и болезнь Меньера, вестибулярный нейронит и центральное вестибулярное головокружение [4 ,8, 9].
Среди лекарственных средств, эффективных при лечении различных видов головокружения, ведущее место занимает бетагистин, влияющий на гистаминовые Н1- и Н3-рецепторы внутреннего уха и вестибулярных ядер головного мозга [3, 4, 6, 8, 9, 12]. Бетагистин был впервые зарегистрирован в 1968 году и к настоящему времени одобрен более чем в 115 странах для лечения болезни Меньера и симптоматического лечения различных причин вестибулярного головокружения [14]. Лечение бетагистином приводит к уменьшению количества приступов вестибулярного головокружения при многих заболеваниях, что обусловлено увеличением тока крови во внутреннем ухе, снижением повышенного эндолимфатического давления, восстановлением баланса между продукцией и обратным всасыванием эндолимфы в лабиринте [14, 15, 16, 17, 22]. Бетагистин способствует нормализации вестибулярной функции при вестибулярном нейроните, односторонней и двусторонней вестибулопатии [4, 20, 23]. Лечение ДППГ проводится при помощи специальных упражнений и лечебных маневров, направленных на выведение отолитов из полукружных каналов лабиринта в область преддверия и более быстрое их растворение. Проведение позиционных маневров Семонта и Эпли в 90% случаев позволяет добиться улучшения в течение недели [4, 9, 10]. Бетагистин ускоряет процессы вестибулярной компенсации при ДППГ [4, 14, 21].
Бетагистин стимулирует Н1-рецепторы сосудов внутреннего уха, а также опосредованно Н3-гистаминовые рецепторы вестибулярных ядер центральной нервной системы (ЦНС) и вследствие этого улучшает микроциркуляцию и проницаемость капилляров, нормализует давление эндолимфы в лабиринте и улитке, увеличивает кровоток в основной артерии. Он ускоряет восстановление вестибулярной функции, облегчает центральную вестибулярную компенсацию, снижает генерацию потенциалов действия в нейронах латеральных и медиальных вестибулярных ядер. Бетагистин имеет очень сильный аффинитет к гистаминовым Н3-рецепторам и слабый аффинитет к гистаминовым H1-рецепторам [14, 15]. Предполагается, что бетагистин повышает в стволе мозга уровень такого нейромедиатора, как серотонин, который снижает активность вестибулярных ядер. Фармакологические исследования на животных выявили отчетливое снижение электрической активности вестибулярных ядер после введения бетагистина. Взаимодействие с H3-рецепторами может являться главным механизмом, посредством которого бетагистин реализует свои клинические эффекты [15].
В нашей стране широко используется оригинальный препарат бетагистина -- Бетасерк, производимый Эбботт Хелскеа Продактс Б.В., Нидерланды [4]. В настоящее время российской фармацевтической компанией ООО Озон производится препарат бетагистина Вестикап. Сравнение эффективности и безопасности препаратов Вестикап и Бетасерк у больных с периферическим вестибулярным головокружением представляет несомненный клинический и практический интерес для получения информации о клинической эффективности и безопасности Вестикап.
Целью настоящего исследования являлось сравнительное изучение клинической эффективности и безопасности препаратов Вестикап и Бетасерк у пациентов с вестибулярным головокружением.
Характеристика, пациенты и методы исследования
Дизайн исследования -- пострегистрационное, открытое, рандомизированное, сравнительное исследование в параллельных группах, клиническое исследование IV фазы. В задачи исследования входило проведение сравнительной оценки эффективности препаратов Вестикап и Бетасерк в отношении тяжести головокружения, качества жизни пациентов с головокружением, а также их безопасности и переносимости у пациентов, получивших хотя бы одну дозу препарата.
Критерии включения/исключения представлены в таблице 1.
|
Таблица 1. Критерии включения/исключения |
|
| Критерии включения | Критерии исключения |
| Мужчины и женщины от 18 до 55 лет | Непереносимость лактозы, синдром мальабсорбции |
| Наличие периферического вестибулярного головокружения | Гиперчувствительность к бетагистину или другим компонентам препарата |
| Выраженность головокружения 1 балл и выше по 5-ти бальной шкале выраженности головокружения | Прием антигистаминных средств или ингибиторов моноаминоксидазы за месяц до начала участия в данном исследовании |
| Отсутствие тяжелых или нестабильных соматических или психических заболеваний, известных злокачественных новообразований | Наличие тяжелых или нестабильных соматических или психических заболеваний, известных злокачественных новообразований |
|
Для женщин -- отсутствие беременности |
Беременность и/или период лактации |
После подписания формы информированного согласия пациенты, соответствующие критериям включения/исключения, в соотношении 1:1 были рандомизированы (методом конвертов) в основную и контрольную группы для получения терапии тестируемым препаратом Вестикап или препаратом сравнения Бетасерк [27].
В соответствии с дизайном в наблюдение были включены 62 пациента, успешно прошедшие период скрининга и соответствовавшие всем критериям включения.
Из 62 пациентов, включенных в исследование, программу лечения завершили все 62 пациента. Среди включенных в анализ пациентов -- 17 мужчин и 45 женщин, что составляет 27% и 73% соответственно. Самому молодому участнику наблюдения 19 лет, самому пожилому 55 лет. Средний возраст составляет 47 ± 13,1 лет, медианное значение возраста 50 лет. Мужчины и женщины, включенные в исследование, достоверно не различались по возрасту (Р > 0,05).
Группа пациентов, принимавших Вестикап, включала 21 женщину (68%) и 10 мужчин (32%). Группа пациентов, принимавших Бетасерк, включала 24 женщины (77%) и 7 мужчин (23%). Средний возраст в группе пациентов, принимавших Вестикап, составил 45 ± 2,7 лет, самому молодому участнику группы было 19 лет, самому пожилому -- 55 лет. Средний возраст в группе пациентов, принимавших Бетасерк, составил 49 ± 2,6 лет, самому молодому участнику группы было 33 года, самому пожилому -- 55 лет. Достоверных различий в сравниваемых группах пациентов, принимавших Вестикап или Бетасерк, по половому и возрастному составу выявлено не было (Р > 0,05).
В группе пациентов, получавших Вестикап, были диагностированы следующие заболевания: ДППГ в 27 случаях (87%), синдром Меньера в 2 случаях (7%), вестибулярный нейронит в 1 случае (3%), двусторонняя вестибулопатия в 1 случае (3%).
В группе пациентов, получавших Бетасерк, были диагностированы следующие заболевания: ДППГ в 21 случае (68%), синдром Меньера в 4 случаях (13%), вестибулярный нейронит в 3 случаях (10%), вторичный гидропс лабиринта в 2 случаях (6%), двусторонняя вестибулопатия в 1 случае (3%).
До начала терапии, а также на 30-й и 60-й день терапии всем пациентам было проведено физикальное неврологическое обследование. Лабораторное обследование, включающее общий анализ крови и мочи, проводилось до начала терапии и на 60-й день приема препаратов. Пациенты принимали Вестикап и Бетасерк внутрь, по 24 мг 2 раза в день (с интервалом 12 часов). Длительность проводимой терапии составляла 60 ± 4 дней. Предварительная оценка эффективности лечения проводилась на 30-й день лечения, окончательная -- на 60-й день терапии.
Тяжесть головокружения оценивалось по 5-бальной шкале выраженности головокружения [18]. Качество жизни пациентов определялось по шкале DHI [18].
Переносимость и безопасность препаратов оценивалась по данным врачебных осмотров (артериальное давление, частота сердечных сокращений, температура тела, частота дыхания), анализ данных лабораторного обследования (общий анализ крови и мочи).
Статистическая обработка материала проводилась с использованием программы STATISTICA, версия 12. Для сравнения групп пациентов, получавших Вестикап или Бетасерк, по шкале тяжести головокружения был использоваться непараметрический U-тест Манна-Уитни. Для сравнения групп пациентов, получавших Вестикап или Бетасерк, по шкале снижения качества жизни вследствие головокружения DHI был использован параметрический t-тест Стьюдента для независимых выборок [25, 26].
 Результаты наблюдения по 5-бальной шкале выраженности головокружения в группе пациентов, получавших Вестикап в начале лечения, на 30-й и 60-й день терапии, представлены на рисунке 1.
Результаты наблюдения по 5-бальной шкале выраженности головокружения в группе пациентов, получавших Вестикап в начале лечения, на 30-й и 60-й день терапии, представлены на рисунке 1.Как видно из рисунка 1, на 1-м визите (начало терапии) в группе пациентов, принимавших Вестикап, преобладали пациенты с выраженным головокружением -- 19 человек (65%), у 6 человек (19%) было выявлено умеренно выраженное головокружение, у 5 человек (16%) отмечалось очень выраженное головокружение. На 3-м визите (60-й день терапии препаратом Вестикап) в этой группе преобладали пациенты с легким головокружением, которое было выявлено у 15 человек (48%), у 12 человек (39%) головокружение полностью отсутствовало, у 4 человек (13%) отмечалось умеренное головокружение. Пациентов с выраженным и очень выраженным головокружением выявлено не было. При этом отмечалось достоверное (Р<0,05) уменьшение тяжести головокружения по 5-бальной шкале выраженности головокружения на 60-й день терапии препаратом Вестикап.
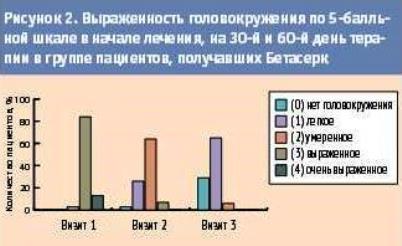 Результаты наблюдения по 5-бальной шкале выраженности головокружения в группе пациентов, получавших Бетасерк, представлены на рисунке 2.
Результаты наблюдения по 5-бальной шкале выраженности головокружения в группе пациентов, получавших Бетасерк, представлены на рисунке 2.Как видно из рисунка 2, на 1-м визите (начало терапии) в группе пациентов, принимавших Бетасерк, преобладали пациенты с выраженным головокружением -- 26 человек (84%), у 1 пациента (3%) было выявлено умеренно выраженное головокружение, у 4 человек (13%) отмечалось очень выраженное головокружение. На 3-м визите (60-й день терапии) в этой группе преобладали пациенты с легким головокружением, которое было выявлено у 20 человек (65%), у 9 человек (29%) головокружение полностью отсутствовало, у 2 человек (6%) отмечалось умеренное головокружение, пациентов с выраженным и очень выраженным головокружением выявлено не было.
Были выявлены достоверные различия (Р<0,05) по 5-бальной шкале выраженности головокружения на 1-м и 3-м визитах в группе пациентов, получавших Бетасерк, что указывает на достоверное снижение тяжести головокружения на 60-й день терапии препаратом Бетасерк.
Динамика уменьшения выраженности головокружения на фоне приема препаратов Вестикап или Бетасерк показана на рисунке 3.
 Как видно из рисунка 3, наблюдалось значительное снижение выраженности головокружения через 30 дней лечения (2-ой визит) и 60 дней терапии (3-ий визит) в группах пациентов, принимавших Вестикап или Бетасерк. Снижение среднего балла по 5-балльной шкале выраженности головокружения за период лечения 2 месяца в группе пациентов, принимавших Вестикап, составило 2,23 балла, в группе пациентов, принимавших Бетасерк, составило 2,32 балла. Это указывает на высокую эффективность лечения препаратами Вестикап и Бетасерк на 60-й день приема обоих препаратов.
Как видно из рисунка 3, наблюдалось значительное снижение выраженности головокружения через 30 дней лечения (2-ой визит) и 60 дней терапии (3-ий визит) в группах пациентов, принимавших Вестикап или Бетасерк. Снижение среднего балла по 5-балльной шкале выраженности головокружения за период лечения 2 месяца в группе пациентов, принимавших Вестикап, составило 2,23 балла, в группе пациентов, принимавших Бетасерк, составило 2,32 балла. Это указывает на высокую эффективность лечения препаратами Вестикап и Бетасерк на 60-й день приема обоих препаратов.Таким образом, в обеих группах пациентов, получавших Вестикап или Бетасерк, был достигнут результат, соответствующий первичному критерию эффективности: уменьшение степени тяжести головокружения (снижение среднего балла по 5-балльной шкале выраженности головокружения на один балл и более) за период лечения 2 месяца, который носил достоверный характер (Р<0,05).
Результаты наблюдения по шкале снижения качества жизни вследствие головокружения (по шкале DHI) в группах пациентов, получавших Вестикап или Бетасерк, представлены в таблице 2 и на рисунке 4.
|
Таблица 2. Средние значения по шкале снижения качества жизни вследствие головокружения (DHI) в группах пациентов, получавших Вестикап или Бетасерк, на 1-3 визитах |
||
|
Номер визита |
Средний балл по шкале DHI | |
| В группе пациентов, принимавших Вестикап | В группе пациентов, принимавших Бетасерк | |
| Визит 1 | 62,90 ± 7,19 | 71,80 ± 6,61 |
| Визит 2 | 34,71 ± 6,32 | 38,19 ± 6,14 |
| Визит 3 | 15,68 ± 5,18 | 17,03 ± 4,48 |
 Из рисунка 4 видно, что средние значения по шкале снижения качества жизни вследствие головокружения (DHI) через 30 дней (2-ой визит) и 60 дней (3-ий визит) уменьшались с экспоненциальным характером и были значимо различны, что свидетельствует о значимом эффекте лечения на 30-й и 60-й день приема обоих препаратов. Были выявлены достоверные различия (Р<0,05) по шкале снижения качества жизни вследствие головокружения (DHI) на 1-м и 3-м визитах в группах пациентов, получавших Вестикап или Бетасерк, что указывает на достоверное улучшение качества жизни на 60-й день терапии обоими препаратами.
Из рисунка 4 видно, что средние значения по шкале снижения качества жизни вследствие головокружения (DHI) через 30 дней (2-ой визит) и 60 дней (3-ий визит) уменьшались с экспоненциальным характером и были значимо различны, что свидетельствует о значимом эффекте лечения на 30-й и 60-й день приема обоих препаратов. Были выявлены достоверные различия (Р<0,05) по шкале снижения качества жизни вследствие головокружения (DHI) на 1-м и 3-м визитах в группах пациентов, получавших Вестикап или Бетасерк, что указывает на достоверное улучшение качества жизни на 60-й день терапии обоими препаратами.Сравнение эффективности лечения препаратами Вестикап и Бетасерк по выраженности головокружения приведено в таблице 3, по качеству жизни пациентов -- в таблице 4.
|
Таблица 3. Сравнение выраженности головокружения в группах пациентов, получавших Вестикап или Бетасерк через 30 и 60 дней (по U-тесту Манна-Уитни) |
||||
| Выраженность головокружения |
Rank Sum в группе пациентов, принимавших Вестикап |
Rank Sum в группе пациентов, принимавших Бетасерк |
U | p |
|
Начало терапии |
1029 | 1024 | 428 | 0,48 |
| Через 30 дней |
1006 |
1002 |
443 | 0,53 |
| Через 60 дней |
998 |
955 | 459 | 0,76 |
Как видно из данных, представленных в таблице 3, при сравнении групп пациентов, получавших Вестикап или Бетасерк, по шкале выраженности головокружения не получено достоверных различий (Р>0,05).
|
Таблица 4. Сравнение качества жизни вследствие головокружения (DHI) в группах пациентов, получавших Вестикап или Бетасерк через 30 и 60 дней (по t-тесту Стьюдента для независимых выборок) |
||||
| Качество жизни вследствие головокружения | Средние значения | Стандартное отклонение | t | p |
| Начало терапии |
62,90 |
71,80 |
-1,86 |
0,08 |
| Через 30 дней |
36,23 |
17,45 | -0,96 | 0,17 |
| Через 60 дней | 15,67 |
15,03 |
-0,40 | 0,68 |
Как видно из данных, представленных в таблице 4, при сравнении групп пациентов, получавших Вестикап или Бетасерк, по шкале снижения качества жизни вследствие головокружения (DHI) не получено достоверных различий (Р>0,05).
За весь период наблюдения не выявлено изменений показателей жизненно важных функций (артериальное давление, частота сердечных сокращений, температура тела, частота дыхания), лабораторных анализов (общий анализ крови и мочи) ни у одного из 62 пациентов.
За время исследования были зарегистрированы нежелательные явления (НЯ) у трех пациентов: двух пациентов, принимавших Вестикап (6%) и одного пациента, принимавшего Бетасерк (3%). Различия между группами статистически не достоверны (p˃0,05). Данные НЯ относились к разряду легких и не послужили причиной исключения пациентов из исследования. НЯ проявлялись в виде тошноты после приема препаратов Вестикап или Бетасерк. Пациентам были даны рекомендации по соблюдению режима питания и приему препаратов после еды. Во всех случаях НЯ регрессировали и не потребовали отмены препарата.
Зарегистрированные НЯ были типичны для препаратов бетагистина и описаны в инструкциях по применению препаратов Вестикап и Бетасерк [14, 15, 20]. Сравнение частоты НЯ в группах пациентов, принимавших Вестикап или Бетасерк, представлено в таблице 5.
|
Таблица 5. Частота нежелательных явлений в группах пациентов, получавших Вестикап или Бетасерк (по U-тесту Манна-Уитни) |
||||
| Показатель |
Rank Sum в группе пациентов, принимавших Вестикап |
Rank Sum в группе пациентов, принимавших Бетасерк |
U | p |
| Частота НЯ |
961,00 |
992,00 | 465,00 | 0,83 |
Как видно из данных, представленных в таблице 5, не было получено достоверных различий по частоте возникновения НЯ в группах пациентов, принимавших Вестикап или Бетасерк, (Р>0,05).
Обсуждение
В данном исследовании отмечена терапевтическая эффективность и безопасность применения препарата Вестикап (бетагистина дигидрохлорид) в сравнении с оригинальным препаратом Бетасерк. Полученные данные согласуются с результатами других исследований, в которых отмечена эффективность бетагистина при синдроме и болезни Меньера [14, 15, 17, 22], ДППГ [10, 11, 21], вестибулярном нейроните [7, 14, 20].
Значимый клинический эффект в виде уменьшения тяжести головокружения, оцениваемого по шкале выраженности головокружения, и улучшения качества жизни, определяемого по шкале снижения качества жизни вследствие головокружения DHI, был получен при приеме обоих препаратов. Достоверных различий в эффективности препаратов Вестикап и Бетасерк не выявлено. Эти данные свидетельствуют о терапевтической эффективности сравниваемых препаратов в лечении головокружения при вестибулярных нарушениях различной этиологии.
Получен достоверный терапевтический эффект в лечении вестибулярного головокружения с использованием обоих препаратов: Вестикап и Бетасерк, у пациентов с ДППГ, вестибулярным нейронитом, синдромом Меньера, двусторонней вестибулопатией, вторичным гидропсом лабиринта. Лечение пациентов с ДППГ включало проведение лечебных маневров с целью выведения отолитов из полукружных каналов лабиринта и назначение препаратов Вестикап или Бетасерк для улучшения вестибулярной компенсации, а также для предупреждения рецидивов возникновения отолитиаза [4, 9, 10, 11, 21].
При проведении статистического анализа было выявлено достоверное уменьшение основных симптомов головокружения и улучшение качества жизни пациентов, при этом достоверных отличий между исследованными препаратами выявлено не было.
Не было выявлено достоверных различий и в отношении переносимости и безопасности обоих препаратов, а также характера и частоты возникновения НЯ при лечении в рекомендуемой терапевтической дозе 48 мг в сутки.
Таким образом, согласно результатам проведенного исследования, препарат Вестикап по терапевтической эффективности в отношении симптомов вестибулярного головокружения, переносимости и безопасности достоверно не отличается от оригинального препарата Бетасерк.
Литература
1. Борнштейн А., Лемперт Т. Головокружение: практический подход к диагностике и лечению М., ГЭОТАР, 2010 – 216 с.
2. Вейс Г. Головокружение // Неврология / Под ред. М. Самуэльса. — М., 1997. — С. 9–120.
3. Крюков А.И., Федорова О.К., Антонян Р.Г., Шеремет А.С. Клинические аспекты болезни Меньера. - М., Медицина 2006. – 239 с.
4. Парфенов В.А., Замерград М.В., Мельников О.А. Головокружение: диагностика и лечение, распространенные диагностические ошибки. М., МИА, 2009 – 152 с.
5. Albera R., Ciuffolotti R., Di Cicco M. et al. Double-blind, randomized, multicenter study comparing the effect of betahistine and flunarizine on the dizziness handicap in patients with recurrent vestibular vertigo // Acta Otolaryngol. 2003;123 :588–593.
6. Baloh R.W. Dizziness, Hearing Loss, and Tinnitus. —New York: Oxford University Press, 1998. —240 p.
7. Benecke H. et al. OSVaLD (Observational Study in patients suffering from recurrent peripheral vestibular Vertigo to Assess the effect of betahistine 48 mg/day on quality of Life and Dizziness symptoms) // Int Tinnitus J. 2010;16:14-24.
8. Brandt T. Vertigo. Its Multicensory Syndromes. – 2nd Ed. – London, 2000.
9. Brandt T. Dieterich M. Vertigo and dizziness: common complains. Springer. 2004
10. Brandt Т., Huppert D., Hecht J. et al. Benign paroxysmal positional vertigo: A long-term follow-up (6-17 years) of 125 patients // ActaOtolaryngol. - 2006. - Vol. 126. - P. 160-163.
11. Guneri EA, Kustutan O. The Effects of Betahistine in Addition to Epley Maneuver in Posterior Canal Benign Paroxysmal Positional Vertigo //Otolaryngol Head Neck Surg. 2011 Aug 22
12. Hanley K., O'Dowd T., Considine N. A systematic review of vertigo in primary care. // Br J Gen Pract. 2001;51: 666-671.
13. Kawabata A, Sasa M, Kishimoto T, et al. Effects of anti-vertigo drugs on medial vestibular nucleus neurons activated by horizontal rotation, Jpn J Pharmacol 1991; 55: 101-6.
14. Lacour M, Sterkers O. Histamine and betahistine in the treatment of vertigo. Elucidation of mechanisms of action. CNS Drugs 2001; 15: 853-70.
15. Lezius F, Adrion C, Mansmann U, Jahn K, Strupp M. High-dosage betahistine dihydrochloride between 288 and 480 mg/day in patients with severe Menière's disease: a case series // Eur Arch Otorhinolaryngol. 2011; 268:1237-1240
16. Meyer P, Schmidt R, Grutzmacher W et al. Inner ear blood flow with betahistine – an animal experiment study. Laryngorhinootologie 1994; 73: 153-156.
17. Minor L.B., Schessel D.A., Carey J.P. Meniere's disease. // Curr Opin Neurol. 2004;17: 9–16.
18. Morris A.E., Lutman M.E., Yardley L. Measuring outcome from vestibular rehabilitation, part II: refinement and validation of a new self-report measure. Int J Audiol 2009; 48: 1: 24—37.
19. Neuhauser H.K. Epidemiology of vertigo. // Curr Opin Neurol. 2007; 20:40–46.
20. Oosterveld W.J. Betahistine dihydrochloride in the treatment of vertigo of peripheral vestibular origin. A double-blind placebo-controlled study // J Laryngol Otol. 1984; 98:37–41.
21. Stambolieva K, Angov G. Effect of treatment with betahistine dihydrochloride on the postural stability in patients with different duration of benign paroxysmal positional vertigo// Int Tinnitus J. 2010; 16:32-36.
22. Strupp M, Hupert D, Frenzel C, Wagner J, Hahn A, Jahn K, Zingler VC, Mansmann U, Brandt T. Long-term prophylactic treatment of attacks of vertigo in Menière's disease--comparison of a high with a low dosage of betahistine in an open trial. Acta Otolaryngol. 2008; 128(5):520-4.
23. Swartz R., Longwell P. Treatment of vertigo. // Am Fam Physician. 2005; 71:1115–1122.
24. Tighilet B, Leonard J, Lacour M. Betahistine dihydrochloride treatment facilitates vestibular compensation in the cat. J Vestib Res 1995; 5: 53-66.
25. Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета программ Statistica М., МедиаСфера, 2002, 2003, 2006 гг., 312 с.
26. Юнкеров В.И., Григорьев С.Г. Математико-статистическая обработка данных медицинских исследований. - СПб.: Военно-медицинская академия, 2002. – 266 с.
27. Оценка биоэквивалентности лекарственных средств: Методические указания. Министерство здравоохранения и социального развития РФ, Федеральная служба по надзору в сфере здравоохранения и социального развития, ФГУ Научный центр экспертизы средств медицинского применения. - М., 2008. – 33 с.
Источник: Медицинский совет, №18, 2014








